免疫细胞培养的六个基本流程:样本制备、细胞分选、分型鉴定、扩增&培养、质量优化、后续研究。
扩增&培养(Amplification and Culture)
从样本制备到细胞分选、分型鉴定,我们终于获得了纯度高、活性好的目的细胞之后,便需要在体外人工模拟其在体内的生长环境,同时保证无菌、适宜的温度和pH,给予免疫细胞充足的营养使其不断生长繁殖,这个过程便是扩增&培养,主要可分为培养体系建立、传代流程、冻存和复苏。
培养体系建立
不同免疫细胞涉及的细胞因子、激活信号大不相同,因此培养体系也不可同一而论;同一免疫细胞不同来源(如PBMC来源、脐带血来源、iPSCs或ESCs)的具体培养方案也存在差别。小优列举了一些免疫细胞的培养体系以作参考,大家可以针对自己的实验需求进行摸索和优化,以获得扩增效率高、细胞纯度高、活性好的最佳培养方案。
T细胞(human)的活化、增殖培养与分化
T细胞的激活涉及到两个信号:TCR/CD3与APC表面特异的MHC-多肽复合物结合产生的特异性抗原刺激信号;APC表面多对共刺激分子和T细胞相应受体作用后产生的非特异性的共刺激信号。最常见的用于T细胞体外活化的是Anti-CD3和Anti-CD28,在两者的协同作用下,可使T细胞充分活化[1]。此外,我们还需添加不同的细胞因子以诱导T细胞向不同的方向分化(图1)。
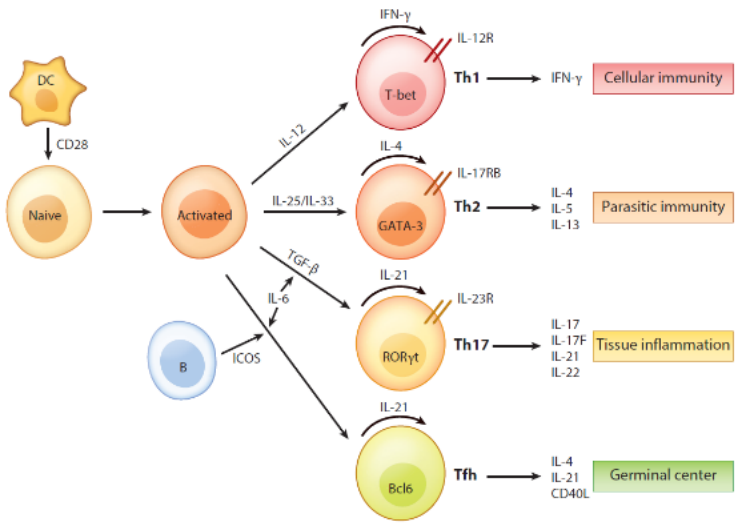
图1 细胞因子在T细胞中的调节和功能[2]
① 将含有1%青霉素-链霉素及5%血清的X-VIVO15培养基恢复至室温,重悬分离后的T细胞,加入anti-human CD3/CD28磁珠(与细胞数量1:1),促进T细胞活化和增殖;
② 加入300 U/mL IL-2使其分化和增殖为效应T细胞;或5 ng/mL IL-15促使T细胞分化和增殖为记忆T细胞[3]。
以上是一篇文献的T细胞分化方案,小优也汇总了体外诱导T细胞分化的一些细胞因子(图2),可供大家参考。

图2 体外诱导T细胞分化方案[4]
Tips:原代T细胞一般在体外的培养时间不超过三周,用于功能实验的T细胞建议培养时间在14天以内。
PBMC(human)来源的NK细胞体外扩增[5]
① 调整分离后的NK细胞密度为1*106 cells/mL,重悬至含有5%血清的X-VIVO 10培养基中;
② 加入200 U/mLIL-2,10 ng/mL IL-15和1*106 cells/mL的K562细胞(丝裂霉素处理灭活)。在15天的扩增过程中,每隔2-3天对NK细胞进行一次传代,补充细胞因子和新鲜制备的K562细胞。
当然,PBMC(human)来源的NK细胞体外扩增的方法有很多:细胞因子−抗体融合、饲养细胞或膜颗粒。小优也找到一篇24.1分的综述,详细列举了不同扩增方案的培养基、添加物、培养天数、扩增效率、细胞纯度,大家可以按需保存!
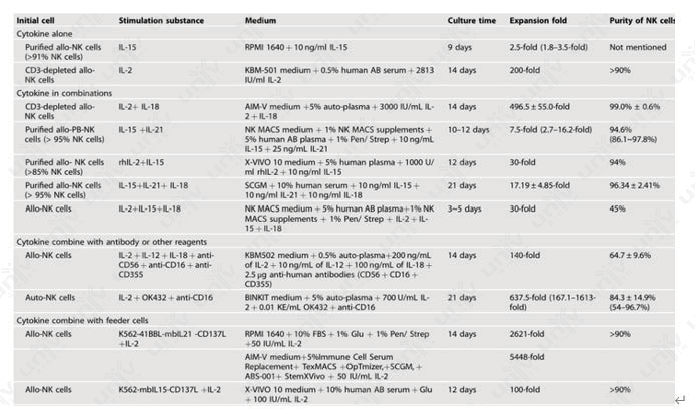
图2 PBMC(human)来源的NK细胞体外扩增方案[6]
单核细胞(human)的培养以及诱导分化为巨噬细胞[7]
① 将含有1%青霉素-链霉素及2%人血清的X-VIVO 15培养基恢复至室温,使用上述培养基将分离的单核细胞重悬,细胞密度为1x106cells/mL,放入37°C、5%CO2的培养箱中,等待1小时左右使细胞贴壁;
② 单核细胞经培养后即开始分化为广义M0巨噬细胞。接种后第三天,更换新鲜培养基并加入25 ng/mL粒细胞-巨噬细胞集落刺激因子(GM-CSF),以促进M1表型,或50ng/mL巨噬细胞集落刺激因子(M-CSF),以促进M2表型。第六天,可再次更换新鲜培养基并加入100 ng/mL LPS和20 ng/mL IFN-γ,使细胞极化为M1-巨噬细胞表型,或加入10 ng/mL M-CSF和20 ng/mL IL-4;继续培养24h即可。
树突状细胞的培养[8]
① 树突状细胞体外培养时一般不增殖,可在培养环境中存活1周或更长时间。如果细胞需要持续培养超过一夜,建议在X-VIVO15添加500 U/mL GM-CSF和500 U/mL IL4,以确保维持DC表型。
② 树突状细胞在10ng/mL TNF-α、5 ng/mL IL-1β、15 ng/mL IL-6和10ug/mL 前列腺素E2(Prostaglandin E2)或0.2 U/mL肝素(Heparin)和50 μg/mL 血蓝蛋白(Keyhole Limpet Hemocyanin)或0.2 U/mL肝素(Heparin)中可分化为成熟的树突状细胞。
传代流程
冻存与复苏[9]
(1)冻存:在细胞密度达到107 cells/mL时可进行冻存,采用分步冷冻法。具体步骤如下:
① 悬浮细胞500 g室温离心10 min收集细胞沉淀,贴壁细胞胰酶消化并终止后离心收集;
② 弃上清,冻存液重悬细胞沉淀,1 mL分装并做好标记;
③ 将冻存管放置-20℃ 1 h;-80℃过夜;转移至液氮中进行长期保存。
(2)复苏:
① 从液氮中取出细胞,37℃水浴快速解冻细胞;
② 将细胞转移到含有12 mL培养基的15 mL离心管中;
③ 500 g室温离心5 min,弃上清;
④ 加入培养基重悬细胞进行后续的培养。
Tips:复苏的免疫细胞建议通过血细胞计数计算细胞悬液中的细胞数量,并通过台盼蓝染料测定细胞活力。
参考文献:
1. Gunnlaugsdottir, B., Anti-CD28-induced co-stimulation and TCR avidity regulates the differential effect of TGF- 1 on CD4+ and CD8+ naive human T-cells. International Immunology, 2004. 17(1): p. 35-44.
2. Dong, C., Cytokine Regulation and Function in T Cells. Annual Review of Immunology, 2021. 39(1): p. 51-76.
3. Nguyen, D.N., et al., Polymer-stabilized Cas9 nanoparticles and modified repair templates increase genome editing efficiency. Nature Biotechnology, 2019. 38(1): p. 44-49.
4. Sekiya, T. and A. Yoshimura, In Vitro Th Differentiation Protocol, in TGF-β Signaling. 2016. p. 183-191.
5. Li, F., et al., CCL5-armed oncolytic virus augments CCR5-engineered NK cell infiltration and antitumor efficiency. Journal for ImmunoTherapy of Cancer, 2020. 8(1).
6. Fang, F., et al., Advances in NK cell production. Cellular & Molecular Immunology, 2022. 19(4): p. 460-481.
7. K. Plaisance-Bonstaff, C.F., D. Wyczechowska, et al., Isolation, Transfection, and Culture of Primary Human Monocytes. J Vis Exp, 2019(154): p. 10.3791/59967.
8. Boudewijns, S., et al., Autologous monocyte-derived DC vaccination combined with cisplatin in stage III and IV melanoma patients: a prospective, randomized phase 2 trial. Cancer Immunology, Immunotherapy, 2020. 69(3): p. 477-488.
9. Raulf, M., T Cell: Primary Culture from Peripheral Blood, in Allergy. 2019. p. 17-31.
来源于优宁维药物研发官网

