HTRF®(均相时间分辨荧光,Homogeneous Time-Resolved Fluorescence )技术将荧光共振能量转移(FRET)技术和时间分辨荧光(TRF))技术将结合,构建了一种均相免洗的检测试验方法。该方法通过将一个供体荧光素(长半衰期荧光)和一个受体荧光素(短半衰期荧光)各自耦合到两个生物分子上从而来评估这两个生物分子的相互作用。当这两个生物分子靠的足够近时,通过用320nm光源激发供体荧光素后,便能测得两种荧光染料之间的能量转移,并且受体荧光素的665nm荧光强度与相互作用的生物分子数量成正比。
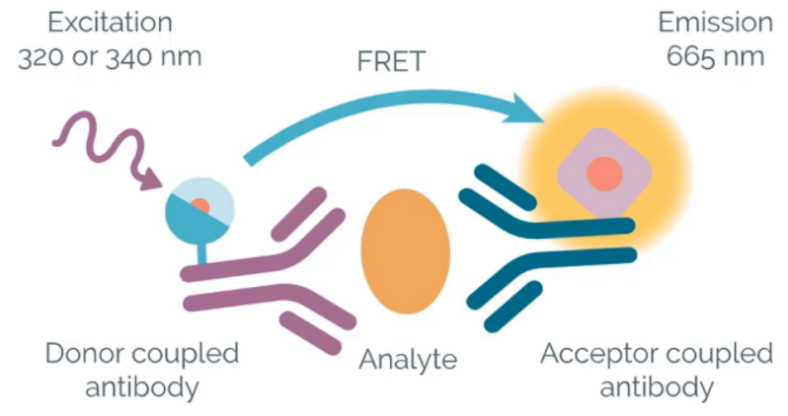
一
试验步骤
HTRF KinEASE试剂盒可以用来评估丝氨酸/苏氨酸(STK)和酪氨酸(TK)激酶活性。HTRF KinEASE试剂盒检测酶活试验分为两个主要步骤,步骤1是酶促(激酶反应)步骤,步骤2是HTRF试剂的检测步骤(图2)。
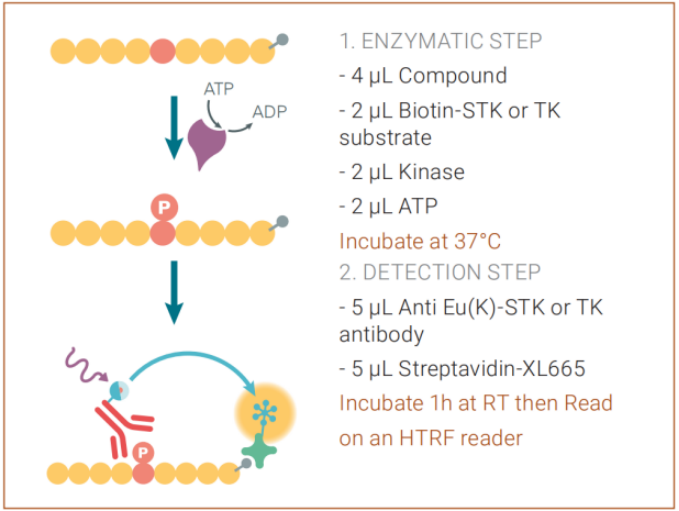
图2. 激酶试验步骤
二
优化步骤
01
最佳的激酶浓度
即信号达到最大浓度的80%(EC80)。激酶的浓度从0.10ng/孔到10ng/孔,与生物素-底物(1μM)和ATP(100μM)孵育30 min。加入含有EDTA的检测试剂后,反应终止。生物素-底物/SA XL665的比例为8/1,即62.2nM SA XL665和Eu标记的磷酸化特异性抗体保持不变。最佳酶浓度选择在滴定曲线 EC80 处。如MAPKAP-K2浓度为0.4ng/孔。
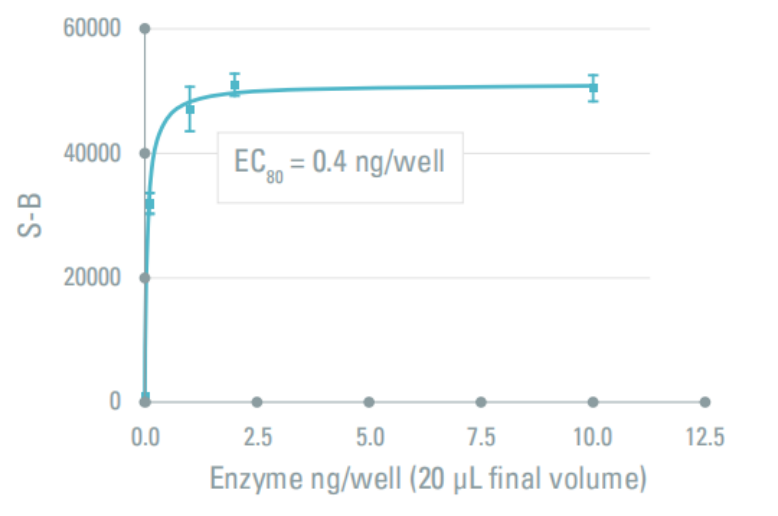
图3: MAPKAP-K2 浓度
02
酶反应时间
使用上述实验中确定的激酶浓度,每孔0.4ng MAPKAP-K2,1µM底物和ATP(100μM)。通过加入检测试剂在1、2、5、10、15、30和60 min不同时间停止反应。MAPKAP-K2浓度为0.4ng/孔达到最大信号,并选择5 min的线性时间,该孵育时间在接下来优化时间中保持不变。

图4: MAPKAP-K2反应时间
03
底物浓度
使用上述酶浓度:0.4ng/孔,孵育时间:5 min,底物浓度从1nM到2μM。在检测步骤中,调整SA-XL665的浓度,使生物素-底物/链霉亲和素-XL665的比值保持在8/1。绘制信号与底物浓度的关系,使用米氏-Menten方程计算得到的KM(app)为80nM。
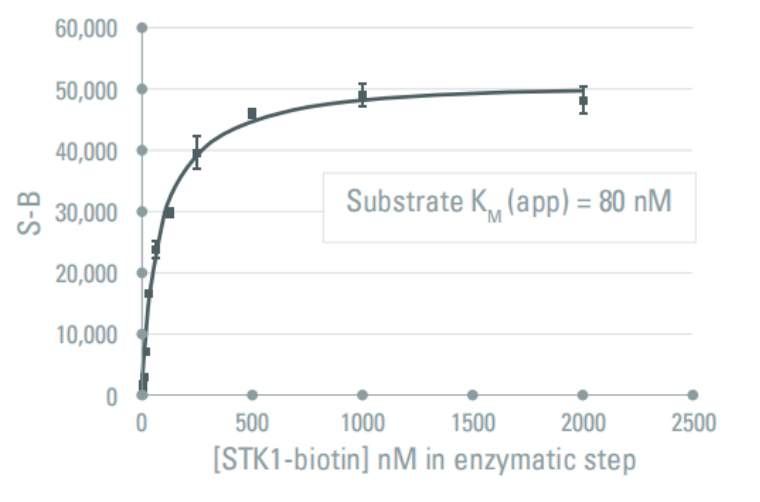
04
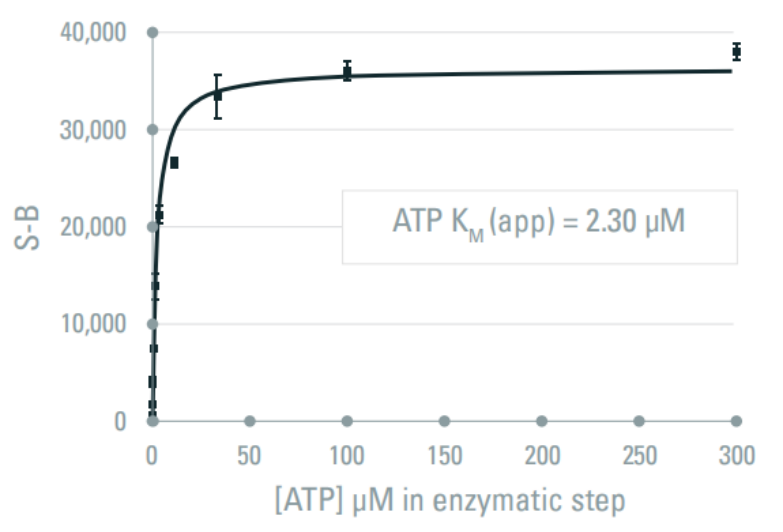
ATP浓度
使用上述酶浓度0.4ng/孔,孵育时间5 min,ATP浓度从1.7 nM至300μM,得到2.3µM的ATP KM(app)。
05
抗体对优化
生物素-底物/SA-XL665比值也是影响信号的因素。该实验使用上述已确定的酶、ATP和底物浓度进行。生物素-底物/链霉亲和素-XL665的摩尔比为2/1、4/1、8/1。
选择原则:
①信噪比佳;②试剂用量少。
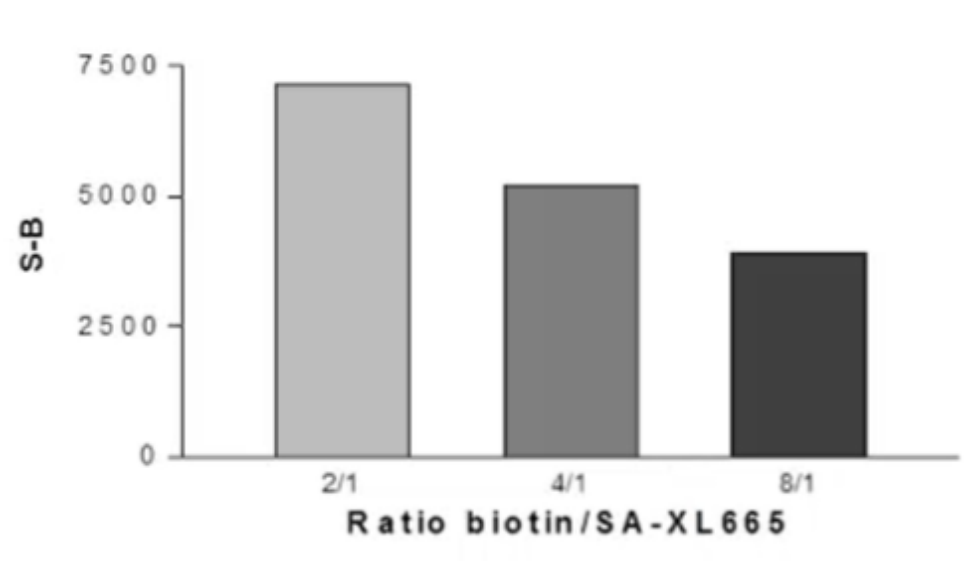
通过上述步骤确定的最终检测体系为,酶浓度:0.4ng/孔,孵育时间:5 min,ATP 2.3µM,底物浓度80nM和生物素-底物/链霉亲和素-XL665的摩尔比为4/1。在此条件基础上,进行下一步抑制剂筛选实验。
06
抑制剂IC50
微孔板中依次加入4μl Staurosporine,2μl生物素-底物 ,2μl激酶 ,2μl ATP,37℃孵育5分钟后,加入检测试剂各5μl,加盖封板膜,室温静置60分钟。
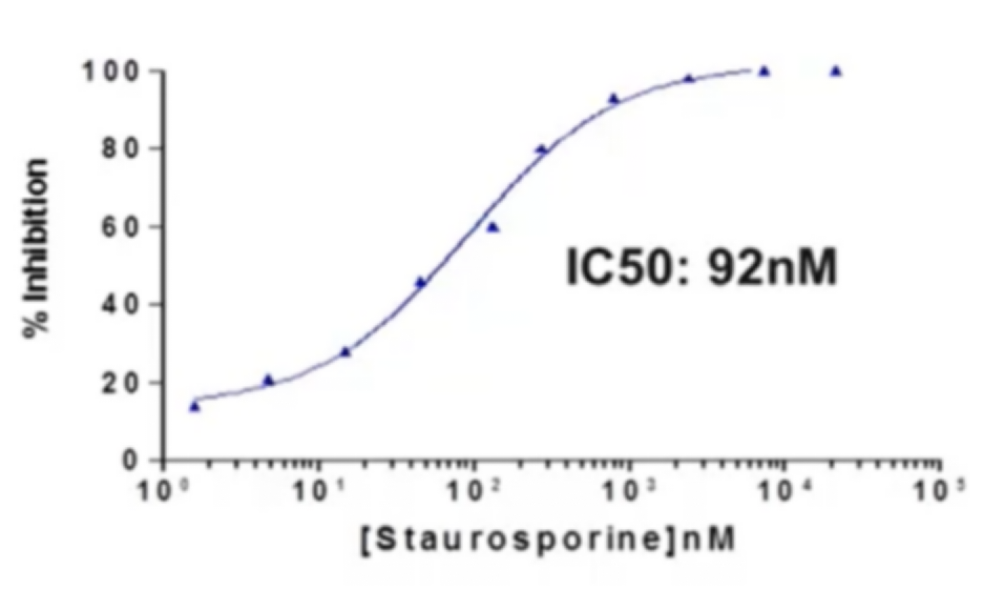
综上所述,本实验最终优化体系为:酶浓度:0.4ng/孔,孵育时间:5 min,ATP 2.3µM,底物浓度80nM和生物素-底物/链霉亲和素-XL665的摩尔比为4/1。Staurosporine抑制剂IC50:92nM。
HTRF KinEASE试剂盒已验证激酶名单如下(验证所用激酶均来源于Carna,如有需要请联系优宁维)。若测定未经验证的丝苏氨酸激酶,可以利用HTRF KinEASE STK Discovery Kit进行验证试验。

来源于优宁维药物研发官网

