根据Sullivan统计,全球核酸药物市场规模从2017年的1.04亿美元增长至2021年的32.5亿美元,年复合增长率高达136%。据Evaluate Pharma和BCG统计分析,预计2024年全球小核酸市场规模将达到86亿美元,2020年-2025年复合年增长率35%,2026年全球小核酸类药物市场规模将超150亿美元。我国核酸药物市场仍处于发展初期,与传统药物相比,核酸药物具有治疗效率高、药物毒性低、特异性强等优点,有望成为继小分子药物和抗体药物后的第三大类药物。
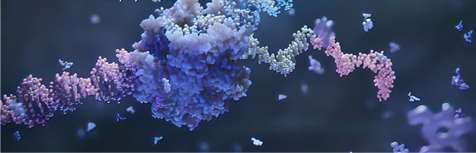
核酸药物可主要分为寡核苷酸(小核酸)药物和mRNA两大类。寡核苷酸药物主要包括反义寡核苷酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、适配体(Aptamer)等。可用于通过一系列过程调节基因表达,包括RNAi、RNase H 介导的切割靶标降解、剪接调节、非编码RNA抑制、基因激活和程序性基因编辑,具有治疗或控制多种疾病的潜力。
寡核苷酸药物从作用机理来看,能够直接靶向致病靶基因或RNA片段,理论上可以调节任何基因表达,因此其治疗领域更广,有望攻克尚无药物的遗传疾病和其他难治疾病(尤其是可针对以往认为难成药的蛋白)。此外,寡核苷酸药物还具有其他优势,如研发周期短、不易产生耐药性、效果持久、研发成功率较高等,被认为是继小分子药、抗体药后推动医药产业变革的第三代制药创新技术。
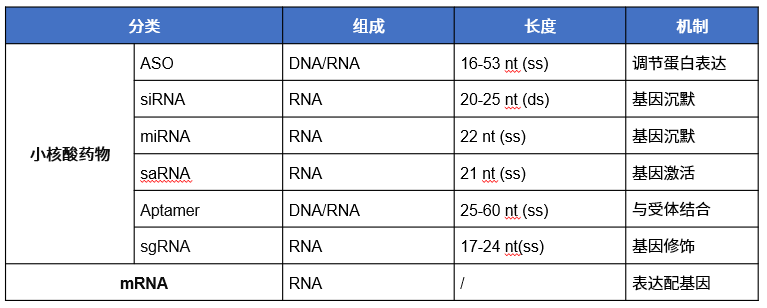
反义寡核苷酸(ASO)是单链核酸,是指短的(16~53个核苷酸)、合成的低聚核苷酸,用于阻断RNA(包括miRNA)的功能。ASO通常与小RNA高度互补,通过Watson-Crick碱基配对特异性结合其同源RNA靶标。RNA结合后,ASO调节靶向RNA的功能。它们的反义机制可以根据它们促进或不促进RNA降解的能力进行广泛分类。结构上包含化学修饰过的核苷酸或者在两端添加特定序列,以提高其结合靶序列的亲和力并使其抵抗细胞内核酸酶降解[3-4]。目前临床上使用的ASO具有两种作用机制,其中一种机制涉及通过诱导RNaseH依赖性RNA降解来下调靶基因表达。具有这种作用机制的 ASO 称为间隙聚体,包含硫代磷酸酯 (PS) DNA 核苷酸的中心序列,两侧是两端的糖修饰残基序列。另一种作用机制涉及剪接过程的调节,由与剪接调控区域结合引起。具有这种作用机制的ASO称为剪接切换寡核苷酸(SSO),它们通过外显子跳跃或包涵上调功能性靶基因表达[5]。
图 两种主要类型的ASO:间隙体和SSO
小干扰RNA(Small interfering RNA;siRNA)有时称为短干扰RNA(Short interfering RNA)或沉默RNA(silencing RNA),是一个长20到25个核苷酸的双链RNA小干扰RNA(siRNA)。
RNA干扰(RNAinterference,RNAi)的概念于1998年被发现,是一种天然存在的防御机制,可抵御外来核酸入侵和控制基因表达,指内源性或外源性双链RNA(dsRNA)介导的细胞内mRNA发生特异性降解,从而导致靶基因的表达沉默,产生相应的功能表型缺失的现象[6]。沉默机制可导致由小干扰RNA(Small interfering RNA,siRNA)或短发夹RNA(Short hairpin RNA,shRNA)诱导实现靶mRNA的降解,或者通过小RNA(Micro RNA,miRNA)诱导特定mRNA翻译的抑制。
siRNA药物作用机理:核糖核酸内切酶 Dicer 将较长的双链RNA或shRNA加工成成熟的siRNA,这种siRNA作为化学合成的分子直接递送至细胞,在细胞质中被引入RNA诱导的沉默复合体(RNA-induced silencing complex,RISC),紧接着siRNA中的一条链(正义链)被降解,另外一条链(反义链,或者叫做向导链)引导RISC与靶信使RNA(mRNA)结合,从而通过复合体中的核糖核酸酶II剪切靶mRNA,从而达到调节靶基因[7]。
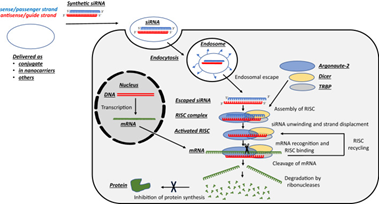
图 合成siRNA作用机理图[8]
MicroRNA (miRNA)是大小为19至25个核苷酸的短RNA分子,是转录后调节基因表达的小内源性RNA,可调节靶基因的转录后沉默,也是生物标志物开发的有希望的候选者。目前处于临床前开发阶段的MiRNA模拟物和miRNA抑制剂已被证明是新型治疗剂。
miRNA广泛存在于多种真核生物中。在细胞核内,基因组DNA转录生成较长的RNA分子(长度达1000nt),其被双链RNA特异性的核糖核酸酶Drosha切割成长度大约70-100碱基的具有发夹结构的RNA分子(primary transcripts,pri-miRNA)。这些具有发夹结构的RNA分子经核输出蛋白exportin5机制转运到细胞质,然后被第二个双链RNA特异的核糖核酸酶Dicer切割,形成19-23nt大小的成熟的miRNAs。成熟的单链miRNAs与类似RNA诱导沉默复合物(RISC)结合,并参与RNA干扰反应(RNAi)。在动物中,结合在复合物上的miRNA以一种目前尚未完全清楚的机制结合到基序基本互补的mRNA上,但这种结合并不像RNAI反应那样参与mRNA降解,而是阻止所结合的mRNA的翻译,导致相应基因表达水平的降低[9]。

图 miRNA的经典作用机制
saRNA与其他的RNA药物(ASO,RNAi,siRNA等)相似,通过与目标核酸的结合而发挥作用,但不同的是,saRNA最终会激活基因表达。saRNA作用机制:双链的saRNA(长度一般在21个核苷酸)通过内吞作用进入细胞;装载到AGO2蛋白上;载体链被降解;AGO2和活性链复合物被运输进细胞核内和启动子区域结合;通过与RNA解旋酶和RNA多聚酶联系蛋白(CTR9)的结合吸引RNA多聚酶从而激活相应基因的转录;最终促进相应蛋白的表达[10]。
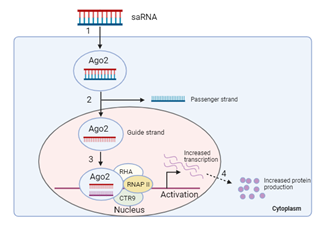
图 saRNA作用机制
Aptamers是无毒且非免疫原性的单链DNA或RNA寡核苷酸,也可以是多肽分子,长度在20至80个核苷酸之间。它们具有独特的三维结构,具有与抗体相似的结合亲和力,能够选择性地结合特定的靶分子,例如蛋白质、核酸、小分子,甚至细胞。Aptamer有时被称为“化学抗体”,因为它们能够以高特异性和亲和力识别并结合其靶标。Aptamer与抗体相比具有多种优势,包括尺寸更小、易于合成以及修饰潜力。并且可以大规模合成、修饰,以实现优化药代动力学特性。Aptamers通常通过SELEX开发,用于多种分子或细胞靶标[11]。可以使用已知的分子靶标(例如蛋白质或肽或小分子)进行适配体筛选。使用这种策略,已经确定了各种疾病相关生物标志物的适配体,例如白细胞介素6受体(IL-6R)[12]、PSMA[13]和VEGF[14]。直接使用分子靶标进行适配体筛选的一个明显优势是,所得适配体肯定能够与相应的靶标结合。
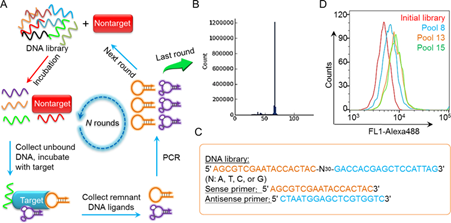
Aptamers已被探索用于广泛的生物医学应用。用于从体外诊断(IVD)、分子成像、药物递送到生物标志物发现和药物筛选等多种生物医学应用。并且随着核酸化学和生物技术的进步,通过化学修饰或者纳米材料修改,显著提高了核酸的生物稳定性,为适配体在包括生物成像和靶向治疗在内的各种生物医学领域的应用奠定了基础[11]。
来源于生工生物官网

