3D细胞培养模型是改变药物研发和个性化医疗的前沿技术。通过在体外更真实地再现人体组织的病理生理过程,3D细胞培养模型有可能跨越2D细胞实验与人体真实反应之间的转化鸿沟“死亡之谷”。
类器官可通过健康或患病的成体干细胞培育,包括肿瘤细胞或诱导多能干细胞(iPSC),其能更准确地反映组织的细胞异质性,并保留源材料的基因组和表型特征,与其他3D模型相比具有独特的优势。尽管药理学和毒理学领域迫切需要此类模型,但由于其实验操作流程上的困难,可能会出现缺乏再现性和扩展性的问题,进而影响下游检测,因此使用类器官进行体外高通量筛选仍然没有得到广泛应用。
解决类器官模型在高通量筛选中应用的两个关键瓶颈
2. 针对3D细胞培养模型进行了优化和验证的检测方法,包括可进行实时连续测量的检测方法。
使用CellRaft® Technology建立定制类器官检测方法
提高类器官模型在筛选中的扩展性、效率和再现性是研究人员在使用这些复杂的3D模型进行研发项目时面临的最大挑战之一。
CellRaft® Technology为研究人员在使用类器官时遇到的诸多难点提供了独具优势的解决方案。利用核心技术CellRaft® Array及CellRaft® AIR® System(图1),用户可以:
-
在CellRaft® Array上的单个焦平面内培养和维持数百个空间上互相分隔的类器官的同时减少培养基和试剂的消耗。
-
可自动成像,捕捉每个类器官随时间变化的序列图像。
-
使用软件工具对CellRaft® Array上生长的异源类器官进行表型鉴定,并根据表型和形态学特性鉴别目的类器官。
-
分离单个完整的类器官用于后续研究,包括药物筛选检测。
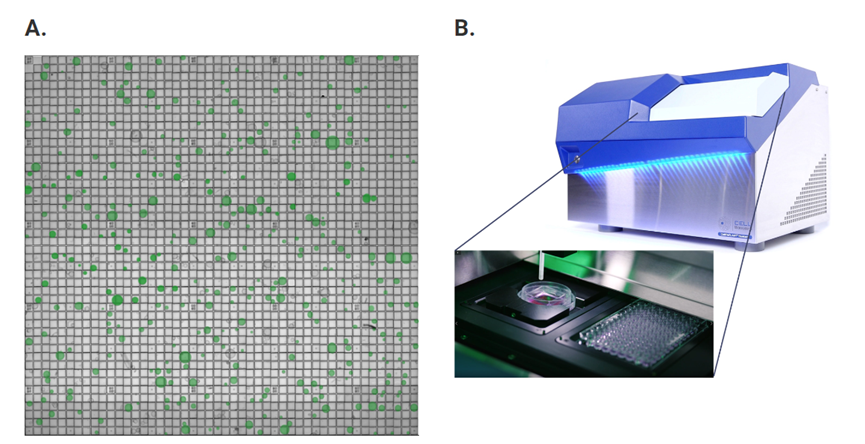

图1. CellRaft® Array和CellRaft® AIR System可实现数百个类器官的单独自动成像、识别和分离。将通过CellRaft® AIR System采集的成像视野图拼接在一起,以生成整个CellRaft® Array的图像(A)。绿色圆圈标出阵列中包含单个类器官的CellRaft®。可以可靠地生成每个CellRaft®随时间推移的图像,以识别含有单一目的类器官的CellRaft,用于下游检测。使用CellRaft® AIR System(B)将附着了目的类器官的CellRaft分离到96孔收集板中,以建立自定义类器官检测板,且每个孔中仅有单个类器官(C)。
Promega针对3D细胞培养模型进行优化及验证的孔板细胞健康检测试剂盒\
Promega的细胞健康检测试剂盒已作为一种常规实验手段用于不同的3D细胞培养模型,并在必要时使用增强试剂(如CellTiter-Glo® 3D Cell Viability Assay)或改良方案(如Caspase-Glo® 3/7 3D Assay)进行特异性优化,以获得更优秀的穿透3D组织的能力。本文中使用的每种试剂盒的详细信息,请参见图2。

图2 各检测方法反应机制。CellTiter-Glo® Cell Viability Assay(A)是一种裂解试剂,通过萤火虫萤光素酶反应量化ATP含量,发光信号与活细胞数量成正比。Caspase-Glo® 3/7 3D Assay(B)是一种由Z-DEVD萤光素前体底物组成的裂解试剂,使用半胱天冬酶-3/7切割该底物以产生萤光素,发光信号与半胱天冬酶-3/7活性成正比。RealTime-Glo™ MT Cell Viability Assay(C)是非裂解型的检测方法,通过活细胞还原后的底物与NanoLuc® Luciferase反应进行检测,发光信号与活细胞数量成正比。CellTox™ Green Cytotoxicity Assay(D)是一种与死细胞DNA结合的非裂解试剂,荧光信号与死细胞数量成正比。
类器官尺寸对药物筛选检测的影响
在药物和毒性筛选中使用传统的批量培养的类器官的一个局限性是实验中不同孔之间以及多个实验之间类器官数量和大小的可变性。
我们通过使用CellRaft® Array和CellRaft® AIR System培养、成像和分离小鼠肝脏类器官,来证明该方案能够为毒性测试提供一致且可重复的类器官检测。使用CellRaft® Cytometry,根据类器官直径,选择含有单个小鼠肝脏类器官的CellRaft进行分离。使用CellRaft® AIR System分离两个完全不同的类器官群体,以评估检测的一致性。第一个群体由大小不等的类器官(>50µm)组成,第二个群体是直径为300~500µm的类器官。
我们使用了两种方法来证明类器官大小对检测一致性的重要性。使用RealTime-Glo™ MT Cell Viability Assay,每24小时测量一次未处理的随机大小和选择大小的类器官群体(每个群体有n=50个孔)的动力学活性,持续72小时。此外,对来自两个群体的单个类器官进行6个浓度(5倍系列稀释)的对乙酰氨基酚(APAP;0.0008~2.5mM)平行处理,每个剂量设有5个复孔。使用2种Promega细胞健康检测试剂盒进行毒性评估。使用CellTox™ Green Cytotoxicity Assay,每24小时测量一次动力学活性,持续72小时,并使用CellTiter-Glo® 3D Cell Viability Assay测量处理72小时后的总ATP含量。
使用CellRaft® Technology,我们证明了类器官大小对于保证检测内一致性至关重要。正如预期,与进行了尺寸筛选的类器官相比,随机大小的未处理类器官的动力学活性表现出更大的孔间变异性(图3)。
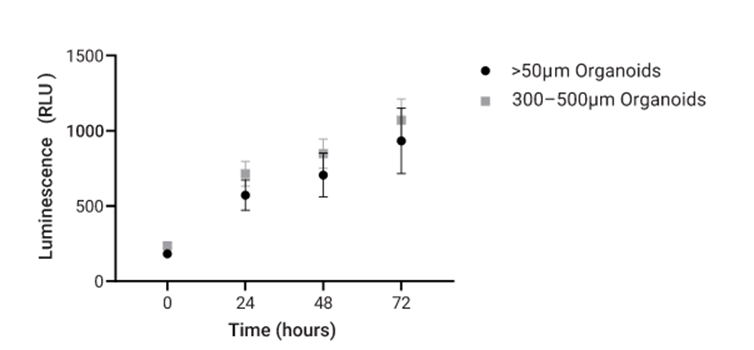
图3 从CellRaft® Array中分离的单个小鼠肝脏类器官的动力学活性。随着时间推移,与经过尺寸筛选的类器官(300~500µm)相比,未经尺寸筛选的类器官(>50µm)具有更大的孔间变异性。每组的结果数值为95%置信区间内的平均值(n=50)。
此外,在平行处理的毒性剂量曲线中,与随机大小的类器官群体(图4A)相比,选择大小的类器官复孔之间的活性和ATP检测结果的标准误差值较小(图4B)。而且,经过尺寸筛选的类器官的孔间一致性对于确认ED 50%(0.6mM)非常关键,而由于孔间差异较大,在随机大小类器官的剂量曲线中确认ED 50%是不可能的。这些数据证明了CellRaft® Technology和软件分析工具在开发用于药物疗效和毒性分析的实验内与实验间重复更一致且更可靠的类器官筛选检测方案的可行性。
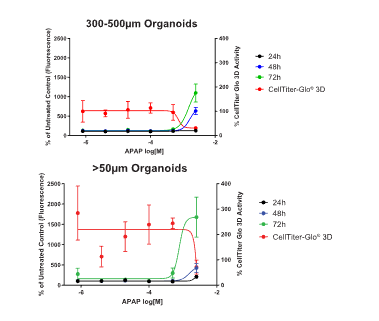
图4 小鼠肝脏类器官的剂量反应曲线。用6个浓度的对乙酰氨基酚(APAP;0.0008~2.5mM)处理类器官,每个剂量设有5个复孔,持续处理72小时。左侧y轴显示24小时(黑色)、48小时(蓝色)和72小时(绿色)相对于DMSO对照孔的CellTox™ Green活性。右轴显示了处理72小时后相对于DMSO对照孔的CellTiter-Glo® 3D活性百分比。
用于药物筛选的克隆iPSC衍生类器官
由 iPSCs 衍生的类器官填补了无法获取的组织或无法从成人干细胞培养的类器官三维模型的空白。过去的十年间,人们研发出了许多实验方案和商品化试剂盒以诱导iPSC分化为多细胞神经元类器官,这些类器官的形成过程与人脑发育非常相似,包括特定区域的细胞组成和生理功能。这些模型对于发育障碍和神经退行性疾病的建模至关重要,但由于其再现性和扩展性方面的问题,实用性有限。使用标准方法,将iPSC细胞群接种到96孔板中,并在后续多个阶段中用移液器移到较大的孔板中,并手动嵌入Matrigel®液滴中。除了在技术上具有挑战性外,标准工作流程仅限于生成96个类器官,并且这些类器官在整个分化过程中无法被跟踪或分析。
我们将这一复杂的工作流程整合到了CellRaft® Array上,提供了一种更便捷的方法来同时培养数百个单一iPSC衍生的神经元类器官,用于后续的毒性筛选。在CellRaft® Array上,经过胚状体形成、神经诱导和扩增,完成对单个iPSC的接种和分化(图5)。第 10 天,根据直径(100-300µm)使用 CellRaft® Cytometry 筛选出感兴趣的单个脑器官组织,并使用 CellRaft® AIR 系统将其分离到成熟培养基中。这一过程维持了类器官的形态和活性,随后类器官在大脑成熟培养基中脱离阵列培养至第42天(图5)。

图5 单个iPSC在500µm的CellRaft® Array上分化形成单个神经类器官。将iPSC接种在CellRaft® Array上,使用稀释的细胞外基质(ECM)培养,并在胚状体形成和神经诱导脉络丛类器官分化的过程中连续一周、每天进行成像。第10天,根据直径(100~300µm)挑选单个类器官,将其分离接种到96孔板中,并用成熟培养基培养。大脑类器官在成熟培养基中培养至第42天。
在第40天,大脑类器官完全成熟后,对每个类器官进行成像。由于在第10天我们根据类器官的尺寸挑选了要分离的类器官,96孔板中的单个成熟类器官大小相似,可用于后续的毒性筛选(图6A)。在第43天,用6个浓度的乙醇(6.25~50mM)处理类器官6小时,以模拟急性酒精暴露。为评估不同酒精浓度对细胞凋亡的诱导效果,使用Caspase-Glo® 3/7 3D Assay检测半胱天冬酶的相对活性。在最高剂量下,我们观察到半胱天冬酶的活化具有剂量依赖性,表明了酒精在该浓度下可以诱发细胞凋亡(图6B)。
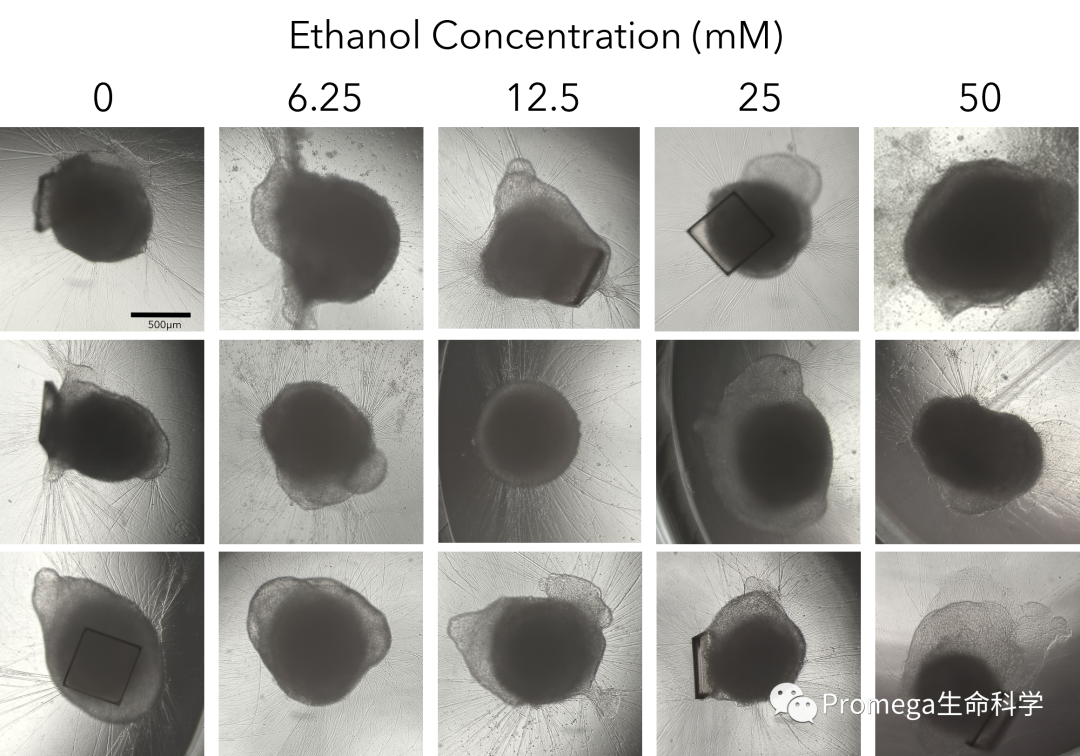
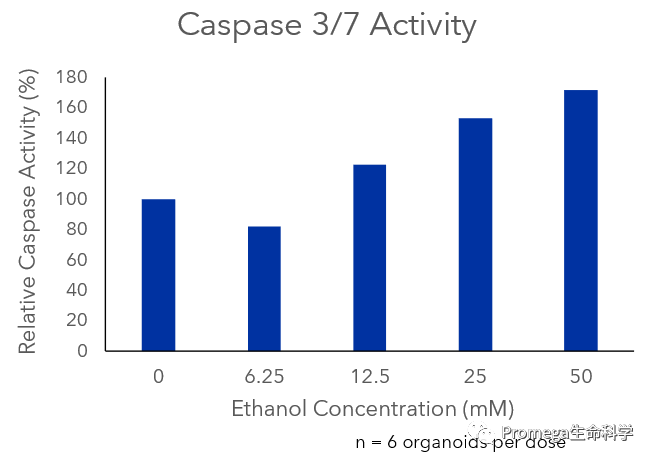
图6. 在神经元类器官中酒精诱导的细胞凋亡。对酒精处理前、第40天的成熟大脑类器官进行成像,图像来自六个复孔中的三个,证明了通过在第10天根据大小筛选类器官可使在第40天进行的下游检测具有孔间再现性(A)。在第43天,将成熟的大脑类器官暴露于5个浓度的乙醇(6.25~50mM,每个剂量6个复孔)中,以模拟急性酒精暴露。处理6小时后,使用Caspase-Glo® 3/7 3D Assay评估类器官是否存在酒精诱导的细胞凋亡。我们观察到半胱天冬酶活性的上升具有剂量依赖性,证明在最高剂量的乙醇暴露下,细胞凋亡被激活(B)。
结论
1. 与标准培养方法相比,利用CellRaft® Array可以规模性地培养上百个类器官,并在一段时间内对类器官进行监测,同时消耗的培养基和ECM试剂更少。增加类器官数量的同时减少试剂的使用,减轻了研究人员在培养类器官过程中产生的材料和劳动力负担,为高通量下游检测提供了便利。
2. 使用基于图像及软件指导的方法来根据大小和其他表型特征分离类器官,提升了下游检测的再现性,并使多个阵列和实验的归一化成为可能。
3. CellRaft® AIR 系统提供了一种自动化解决方案,可为下游类器官筛选实验创建定制的96孔板预表征类器官。针对3D模型专门设计和进行验证的CellRaft® Technology和Promega检测试剂盒为药物和毒性筛选提供了广泛、可靠的类器官检测方案。
来源于promega官网

