类风湿关节炎(rheumatoid arthritis,RA)是一种致残的自身免疫性慢性炎症性关节病,病理特征表现为慢性滑膜炎和关节破坏,但是目前治疗手段尚未能完全满足临床需求[1, 2]。持续活化的成纤维细胞样滑膜细胞(fibroblast-like synoviocytes,FLS)在RA滑膜血管翳形成和骨质侵蚀过程中发挥着关键作用[3-5]。因此,靶向活化的RA-FLS可能是治疗RA的新策略。
Hedgehog信号通路在胚胎发育过程中扮演着重要角色,并在健康成人组织中通常处于静止状态[6, 7]。而Hedgehog信号通路的异常激活和失调,会导致各种恶性肿瘤疾病(如基底细胞癌、髓母细胞瘤、生殖系统肿瘤及消化道肿瘤)和风湿性疾病的发生发展[8, 9]。课题组前期研究发现,Hedgehog信号通路在RA中异常活化,导致RA-FLS侵袭性表型形成[10]。由于Smoothened(SMO)蛋白是Hedgehog信号通路传导过程的关键分子,靶向干扰SMO抑制Hedgehog信号通路活性可能有利于RA治疗[11]。但SMO小分子抑制剂药物的全身给药不良反应及基因突变导致耐药的问题,限制其治疗RA的开发与应用[12, 13]。
精确设计的小干扰RNA(small interfering RNA,siRNA)可以序列特异的方式识别并干扰目标基因的表达[14]。并且化学修饰能提高siRNA在体内的稳定性、细胞摄取效率及基因干扰效率[15]。随着Onpattro及Leqvio等药物的获批上市,siRNA疗法逐渐成为新药开发的潜在和热门领域。然而,靶向SMO的化学修饰siRNA药物是否能通过抑制Hedgehog信号通路活性并治疗RA及其具体分子机制尚不明确。
该研究采用RNA干扰及化学修饰技术,通过序列设计及优化改性,筛选出靶向SMO、高效抑制Hedgehog信号通路活性的siRNA药物si-S1A3-Chol,利用RA-FLS细胞模型揭示siRNA干扰SMO抑制GLI1核转位而阻滞细胞增殖与迁移侵袭的具体分子机制,并利用胶原诱导关节炎动物模型评估其对关节破坏和运动功能的改善作用,为寡核苷酸药物的开发和临床应用提供理论指导和技术支撑。

研究人员从活动性RA患者关节滑膜组织分离的原代FLS细胞作为体外实验研究模型。针对人源SMO mRNA及小鼠源Smo mRNA不同位点,分别进行siRNA设计(图1A)。转染后通过qPCR及Western Blot实验发现,所设计的所有siRNA均能高效抑制RA-FLS的SMO表达,并呈现浓度梯度依赖性(图1B-D)。对优选序列si-h/m-2的双链分别进行不同程度、不同化学基团的修饰以进行性能优化(图1E)。人血清稳定性实验显示,与未经化学修饰的裸siRNA相比,化学修饰显著增强siRNA对血清核酸酶的抵抗能力,siRNA的血清稳定性可按实验需求进行相应调整(图1F)。与此同时,随着反义链化学修饰水平的增加,siRNA的干扰效率显著升高,在更低的IC50浓度下以浓度梯度依赖性方式干扰SMO mRNA的表达(图1G-I)。对优选修饰组合si-S1A3及si-S1A4正义链进行胆固醇分子缀合以改善其细胞摄取效率。结果发现综合化学修饰后的siRNA可在无需转染试剂的情况下,以浓度梯度依赖性方式实现高效干扰SMO mRNA表达,并且显著改善其在人血清或RA患者炎性关节液中的稳定性(图1J-L)。基于干扰效率及稳定性的考虑,研究采用si-S1A3-Chol(800nM)进行后续研究实验。筛选实验结果表明,精确的序列设计及合理的化学修饰后的si-S1A3-Chol,可高效且稳定地干扰RA-FLS中SMO的表达。

图1 化学修饰siRNA高效抑制SMO表达
(图源:Lin L, et al., Mol Ther-Nucl Acids, 2023)
通过进一步实验探讨si-S1A3-Chol调控RA-FLS细胞异常增殖的侵袭性细胞表型的分子作用机制。RNA-Seq结果表明,si-S1A3-Chol通过干扰SMO表达,有效抑制Hedgehog信号通路下游相关分子表达;下调的差异基因主要富集于细胞周期调控、DNA复制、同源染色体分离、细胞有丝分裂等细胞功能通路上(图2A-D)。Western Blot结果表明,si-S1A3-Chol显著干扰SMO表达,通过阻滞转录因子GLI1的核转位,降低相关靶基因的表达,有效抑制RA-FLS中Hedgehog信号通路的活化(图2E-G)。与此同时,si-S1A3-Chol通过抑制周期蛋白(Cyclin D1、Cyclin E1)的表达并上调细胞周期依赖性激酶抑制剂(p21、p27)的表达,从而有效地负向调控细胞周期(图2H)。ELISA结果表明,si-S1A3-Chol显著降低炎性细胞因子(IL-6、IL-8)及基质金属蛋白酶(MMP-1、MMP-3、MMP-9、MMP-13)的分泌表达(图2I)。细胞功能实验表明,si-S1A3-Chol阻滞细胞周期于G0/G1期,降低S+G2/M期细胞百分比,影响细胞周期分布,显著减少DNA复制,抑制RA-FLS细胞增殖(图2J-L)。通过划痕实验及Transwell小室实验表明,si-S1A3-Chol有效抑制RA-FLS细胞的迁移及侵袭能力(图2M-O)。体外细胞实验结果表明,si-S1A3-Chol通过干扰SMO表达,减少GLI1核转位而抑制Hedgehog信号通路的异常活化,阻滞细胞周期停顿于G0/G1期,影响DNA复制,从而抑制RA-FLS的增殖,并通过减少炎性因子释放及干扰细胞迁移侵袭能力,从而实现逆转RA-FLS的侵袭性细胞表型。

图2 化学修饰siRNA逆转RA-FLS侵袭性细胞表型
(图源:Lin L, et al., Mol Ther-Nucl Acids, 2023)
为评估si-S1A3-Chol的药物代谢特征,研究人员通过HIT qRT-PCR分别检测单剂量si-S1A3-Chol在静脉注射及关节腔内注射后,血浆中各时间点siRNA分子双链的浓度水平(图3A)。结果表明,由于关节囊解剖结构的相对封闭性及滑膜内衬层FLS的可及性,关节腔内注射可显著减少siRNA进入血液循环造成的系统性毒副作用,从而有效提高炎性关节局部药物作用浓度(图3B)。为评估si-S1A3-Chol的治疗效果,研究人员使用DBA/1小鼠建立了胶原诱导关节炎(collagen-induced arthritis,CIA)小鼠动物模型,随机分组后分别每周给予生理盐水、si-Scr-Chol或si-S1A3-Chol(250nmol/kg)进行双侧踝关节腔内注射治疗(图3C)。定期进行关节炎评分,结果表明si-S1A3-Chol有效延缓关节炎的发生发展,显著减轻关节炎的严重程度,并明显减轻踝关节的骨质侵蚀与关节破坏(图3D-G)。与此同时,除了常规的症状学、影像学及病理学评估手段,本研究还通过步态成像系统对CIA小鼠的运动功能进行客观性定量评价。结果表明,与si-Scr-Chol对照组相比,si-S1A3-Chol治疗可显著减小后爪面积,减轻关节肿胀程度;增大足爪角度,改善后爪关节强直程度;延长步幅时长、降低步幅频率、增加步幅长度与步幅各时相时长,从而整体改善CIA小鼠运动功能(图3H-J)。踝关节组织切片免疫组化结果显示,CIA小鼠踝关节滑膜组织存在Hedgehog信号通路异常活化,si-S1A3-Chol治疗显著降低SMO及GLI1的表达水平(图3K)。病理切片染色结果表明,si-S1A3-Chol组小鼠踝关节滑膜炎症和骨侵蚀程度减轻,软骨破坏程度降低,滑膜组织内破骨细胞成熟受到抑制(图3K)。通过主要脏器切片染色进行体内生物安全性评价,发现si-S1A3-Chol对CIA小鼠主要脏器无明显病理损害的副作用表现,si-S1A3-Chol在CIA小鼠体内治疗是相对安全的(图3L)。体内动物实验结果表明,si-S1A3-Chol通过抑制Hedgehog信号通路的异常活化,有效减轻CIA小鼠关节炎症,减少关节破坏程度,并显著改善小鼠的步态及运动功能。

图3 化学修饰siRNA减轻CIA小鼠关节炎进展并改善运动功能
(图源:Lin L, et al., Mol Ther-Nucl Acids, 2023)
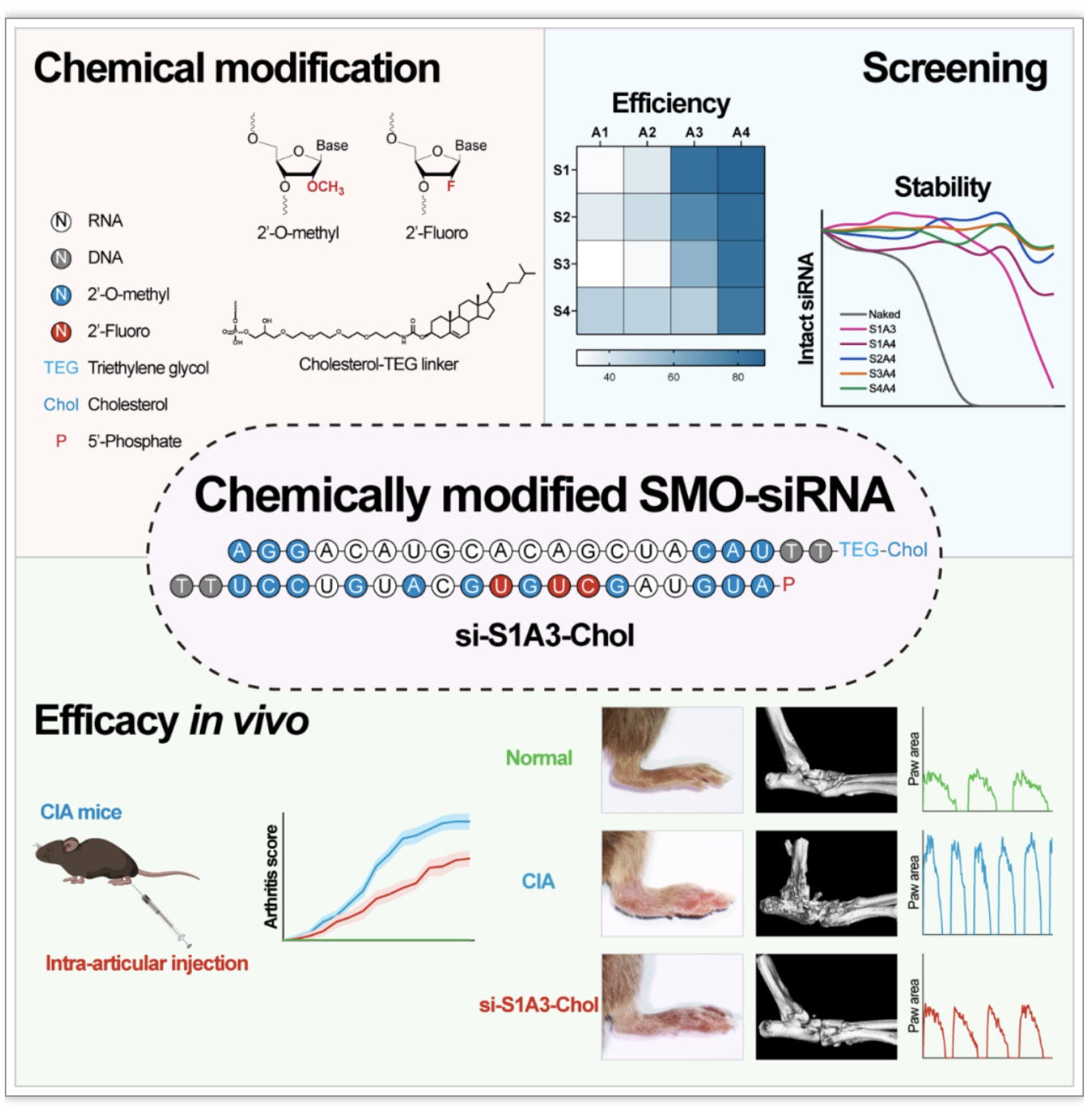
图4 模式图:化学修饰siRNA靶向Hedgehog信号通路治疗RA
(图源:Lin L, et al., Mol Ther-Nucl Acids, 2023)

