
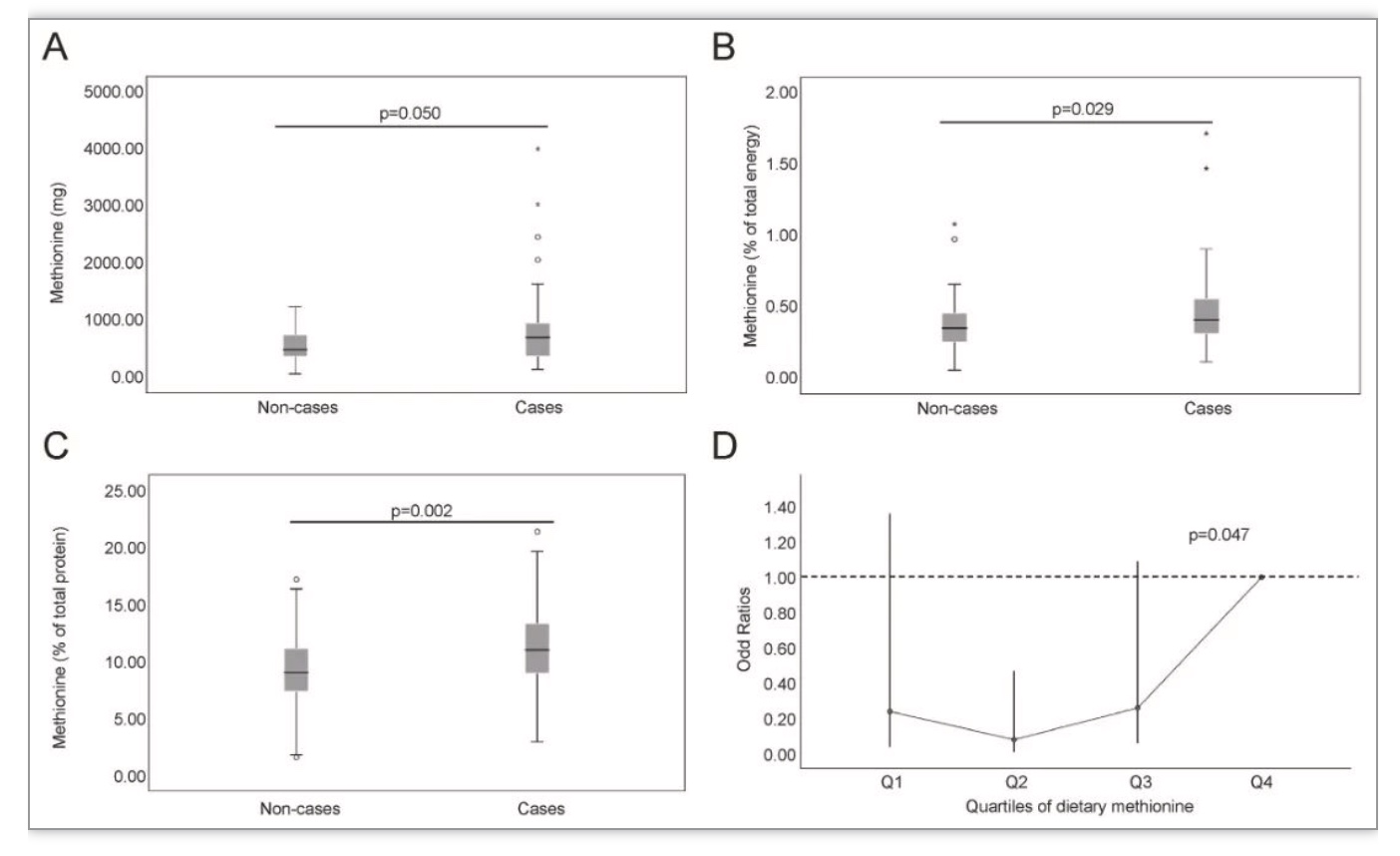
图1 MCI组比对照组饮食蛋氨酸摄入量更少
(图源:Xi, et al., Redox Biology, 2022)
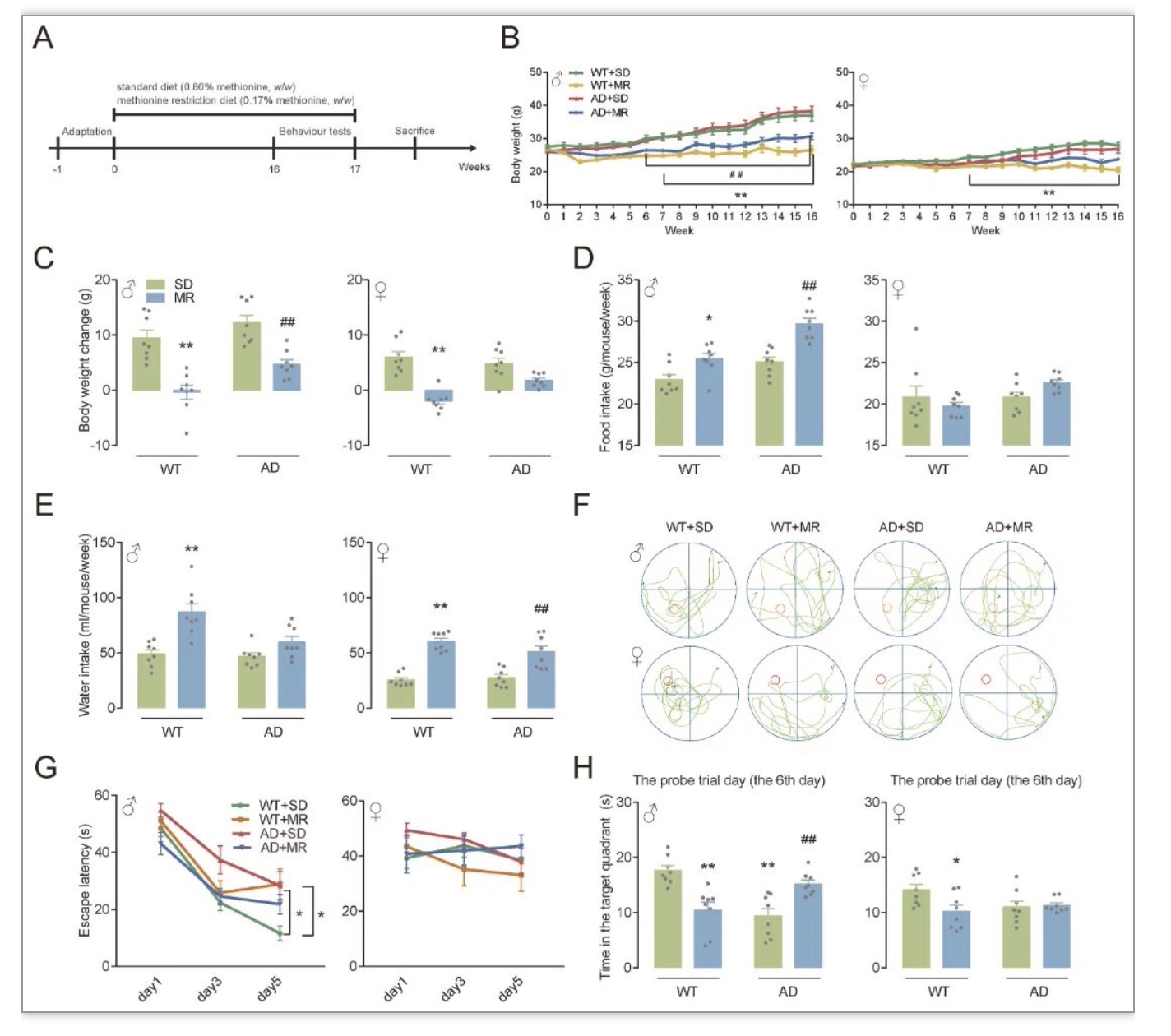

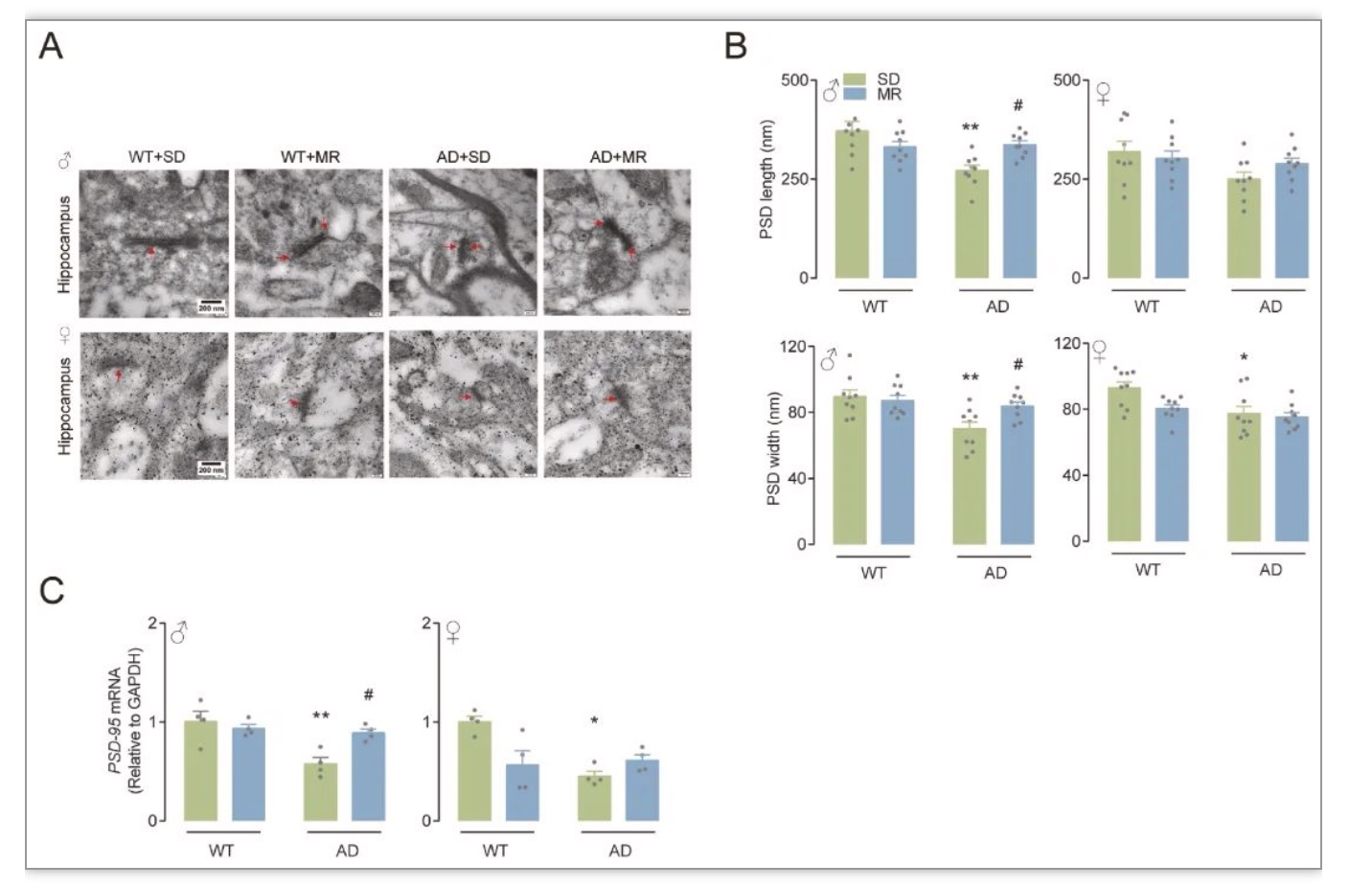
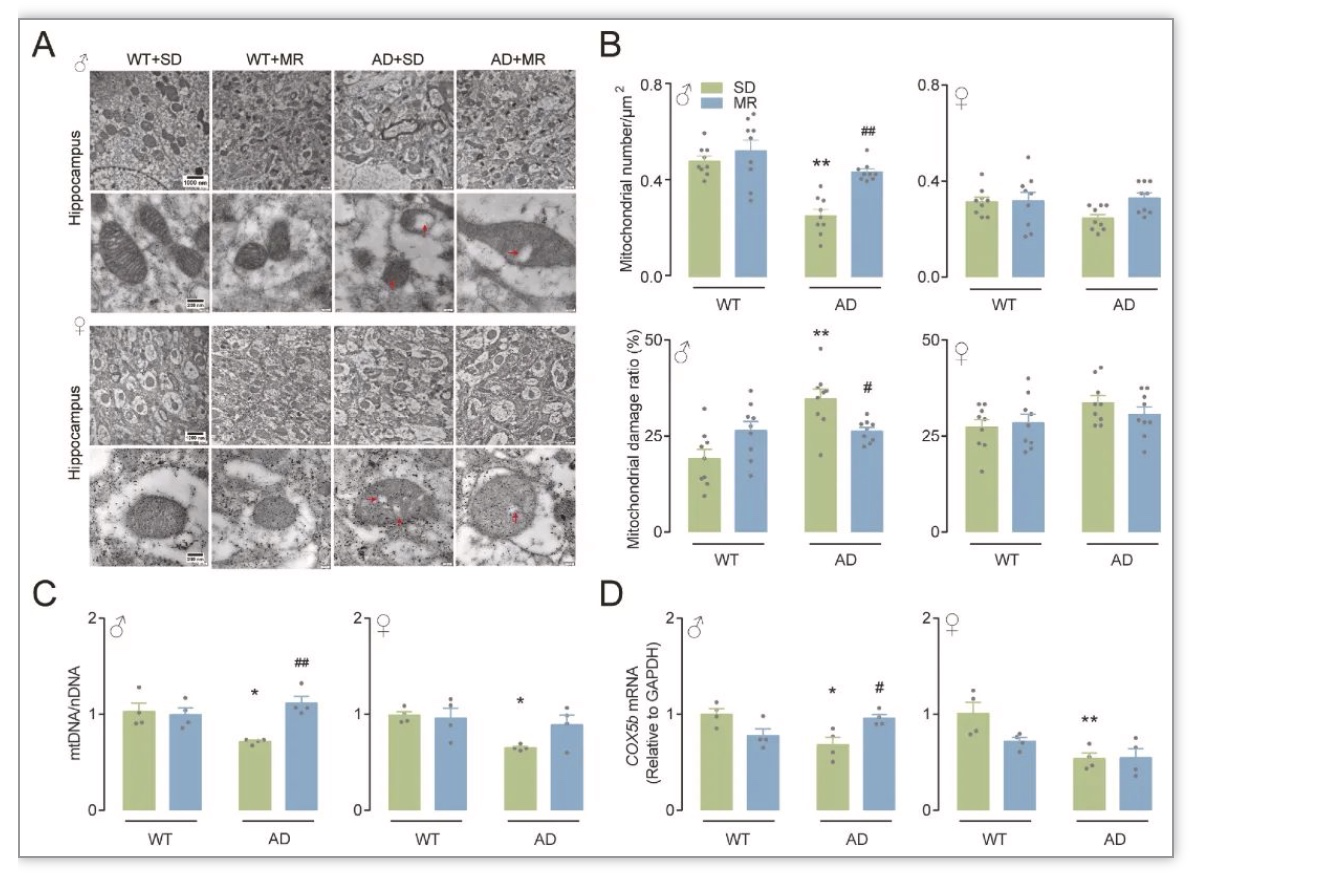
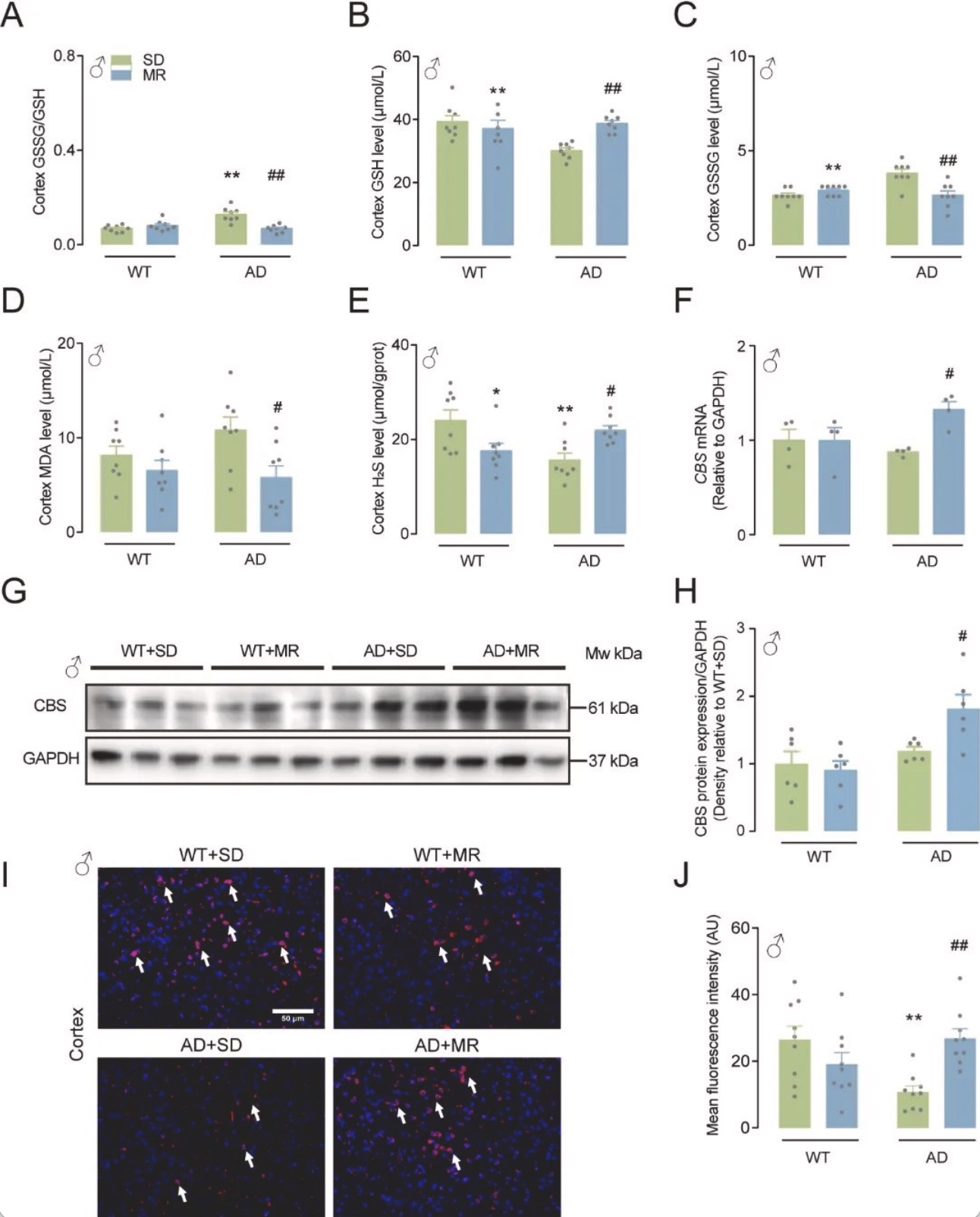
综上所述,该研究在对人群的研究中发现,较低的膳食蛋氨酸摄入量与改善认知功能有关。虽然在人群研究中,饮食蛋氨酸摄入量与MCI风险没有观察到性别差异,但MR可以性别特异性地减轻AD小鼠的认知能力下降和氧化应激,这可以部分解释为激活的CBS/H2S途径。作者的研究结果表明,MR可能是认知能力下降的有效营养干预,并且跨物种一致。应进一步研究AD患者的饮食蛋氨酸摄入量与认知功能之间的关系,在无蛋白质营养不良的情况下,可适当进行MR对AD患者的临床前试验。由于老年人蛋白质摄入量低可能会造成肌肉质量损失和心力衰竭[14-15],因此维持甚至增加老年人的蛋白质摄入量以及保持低蛋氨酸摄入量可能更合适。这可以通过使用植物蛋白来源来实现,与动物蛋白相比,植物蛋白的蛋氨酸含量通常较低,因此可能具有有益的效果[16]。

