G蛋白偶联受体(GPCRs)是重要的药物靶点,通过激活G蛋白和结合β-arrestin蛋白来介导各种信号通路。作者深入研究了二聚体和寡聚体影响血小板激活因子受体(PAFR)的信号模式,为GPCR寡聚与下游信号之间的关系提供了重要的见解。
01
PAFR在细胞膜上的寡聚
作者首先用单分子成像的方法检测了PAFR二聚体或低聚体的形成,这些受体用不同密度的非细胞-穿透荧光团共价标记(图1a)。通过TIRF显微镜和光漂白步骤分析获得单个PAFRs的图像(图1b-d)。结果表明PAFR在细胞膜上的寡聚是密度依赖性的,即随着密度的增加,PAFRs更多的处于低聚体状态。
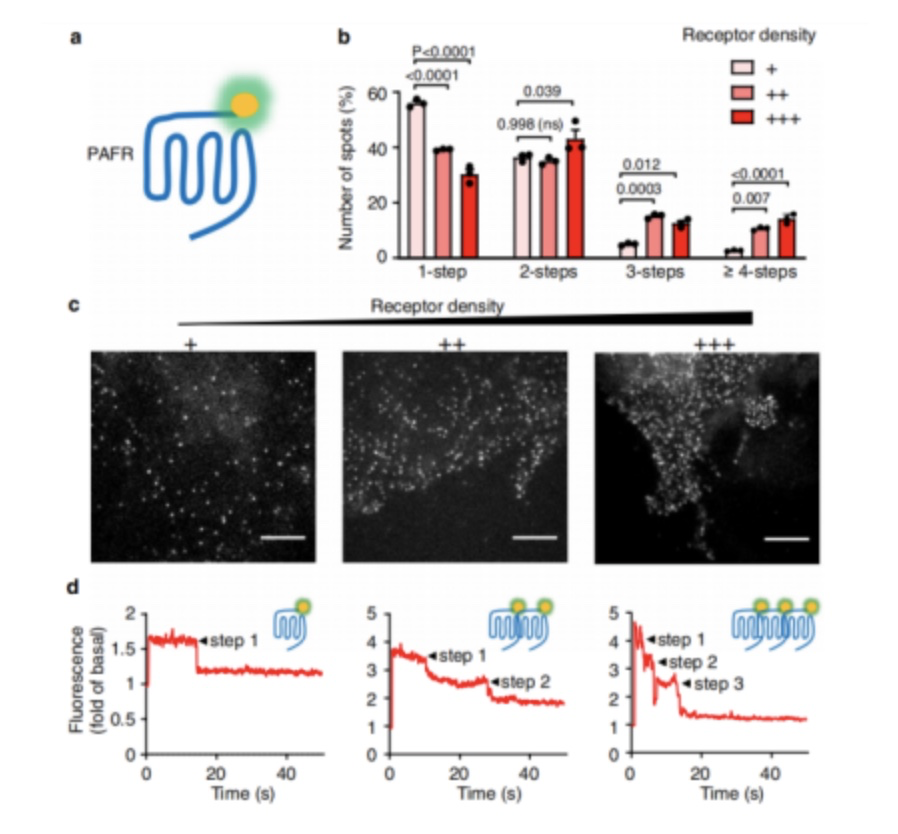
图1
02
PAFR二聚体跨膜结构域界面的表征
为了确定PAFR的7TM(七次跨膜螺旋)上可能的二聚体界面,作者采用BRET试验和Cys交联的方法。数据表明有两种可能的PAFR二聚体界面:一种涉及TM1,另一种涉及TM4和TM5(图2)。
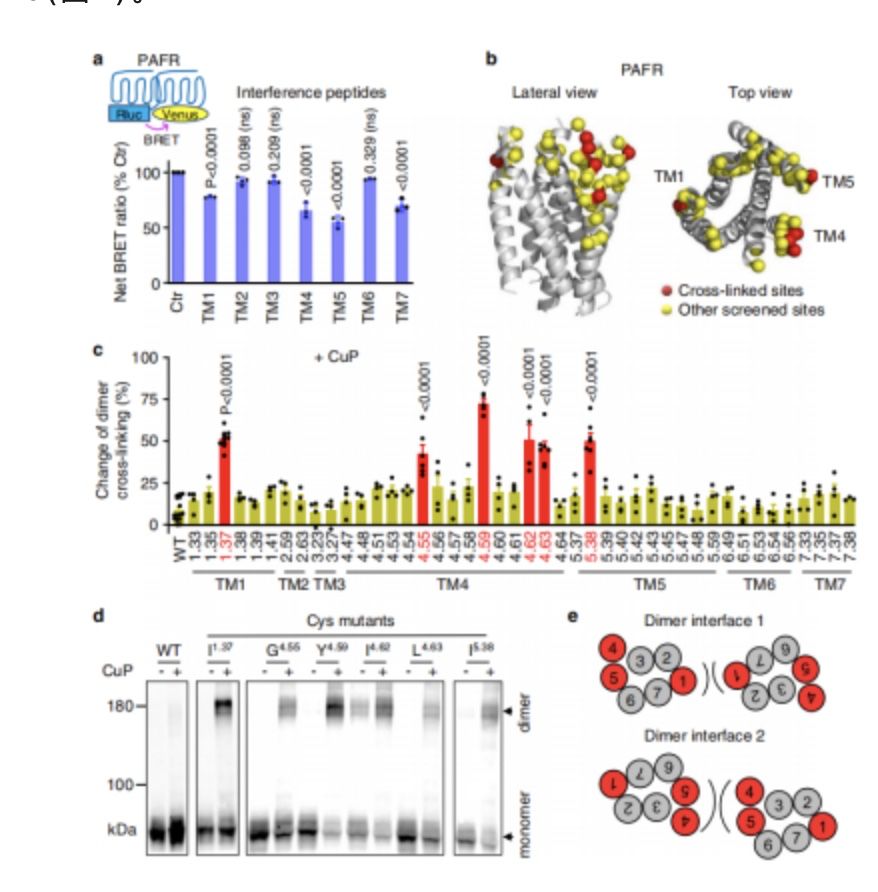
图2
03
半胱氨酸交联稳定PAFR低聚体
接下来作者通过TM1和TM4/5二聚体界面的Cys交联稳定了PAFR低聚体,随后将这些在二聚体界面上交联良好的半胱氨酸结合在受体的同一原聚体中,通过检测双半胱氨酸突变,发现单体或二聚体通过双半胱氨酸交联形成低聚体。也可能存在由两个对称界面组成的PAFR低聚体(图3)。
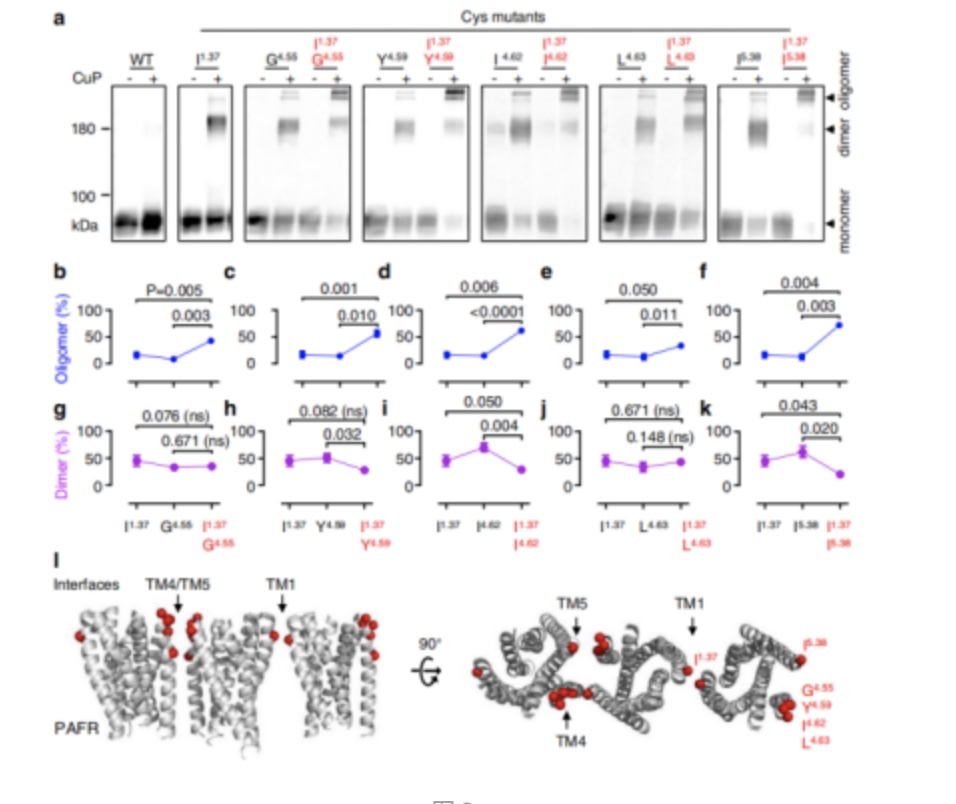
图3
04
PAFR寡聚体调节G蛋白活化和β-arrestin募集
作者通过检测Gq激活水平、βarr1募集水平和受体内化水平( PerkinElmer),探究PAFR寡聚对信号传导的影响,结果表明PAFR寡聚增强了Gq信号(图4a,b)。接着,作者使用BRET试验检测βarr1招募到的PAFR突变体,结果发现PAFR的二聚/寡聚减少了βarr1的募集(图4c,d)。
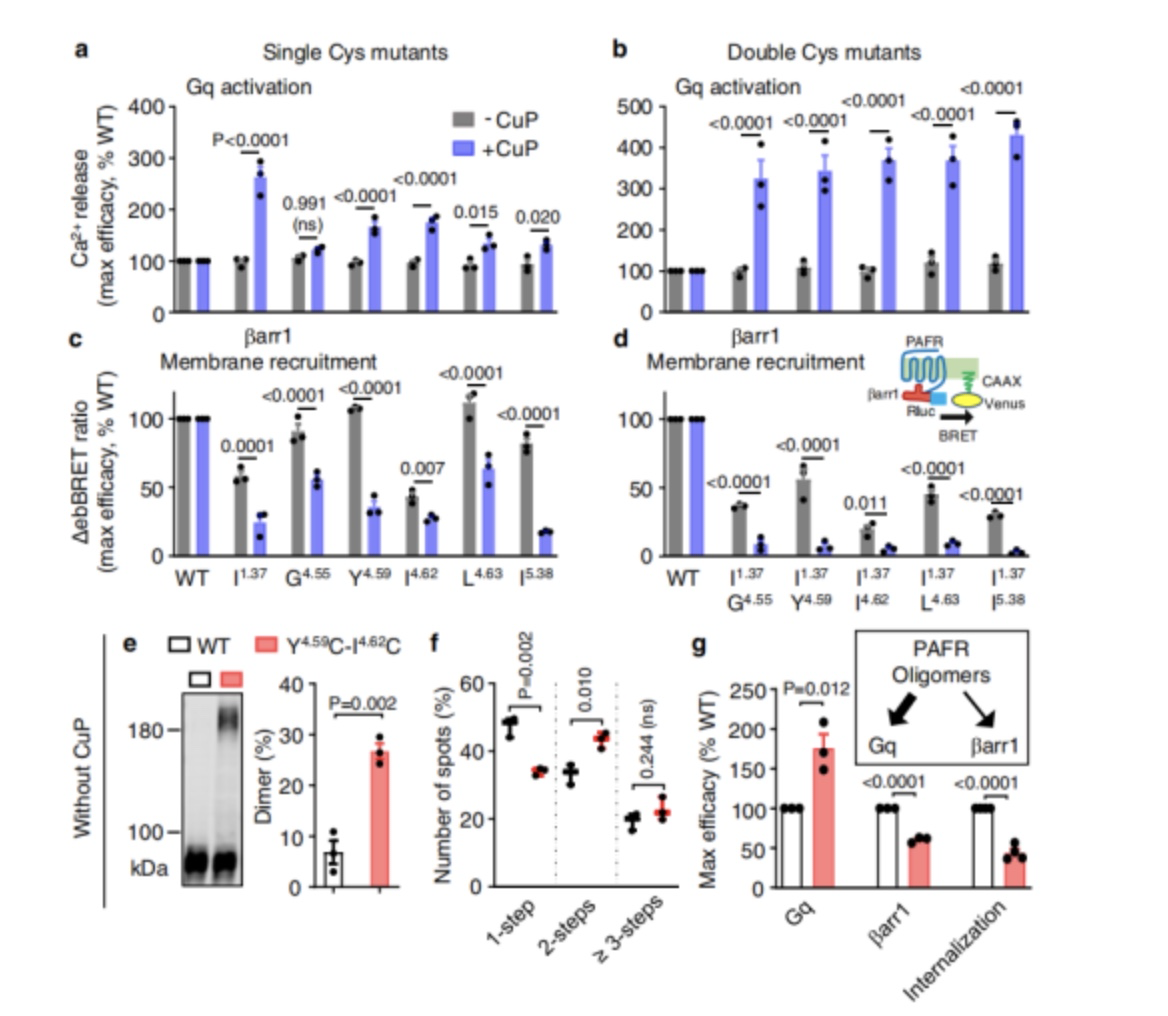
图4
交联试验需要铜处理,以诱导细胞毒性并破坏PAFR信号,作者发现TM4中的双突变体Y151C4.59-变体I154C4.62可以在没有CuP处理的情况下交联(图4e)。这与该双突变体在光漂白分析中观察到的形成高比例二聚体和低聚体的倾向相一致(图4f)。并且该突变体也表现出更高的Gq信号和更低的βarr1募集。作者通过扩散增强共振能量转移内化试验(Tag-lite, PerkinElmer)证明,这种双突变体显著削弱了PAFR的内化(图4g)。
05
PAFR的自然遗传变异与二聚体和Gq
为了验证自然遗传变异是否也会影响PAFR的寡聚化。作者将残基替换引入产生二聚体的单半胱氨酸突变体,以确定形成有利于PAFR二聚体的突变。结果发现位于细胞外环2 (ECL2)的E178K变体在没有CuP的情况下I186C5.38二聚体的比例更大,因此二聚体形成的概率更高。并且表现出更高的Gq信号和更少的βarr1募集(图5)。
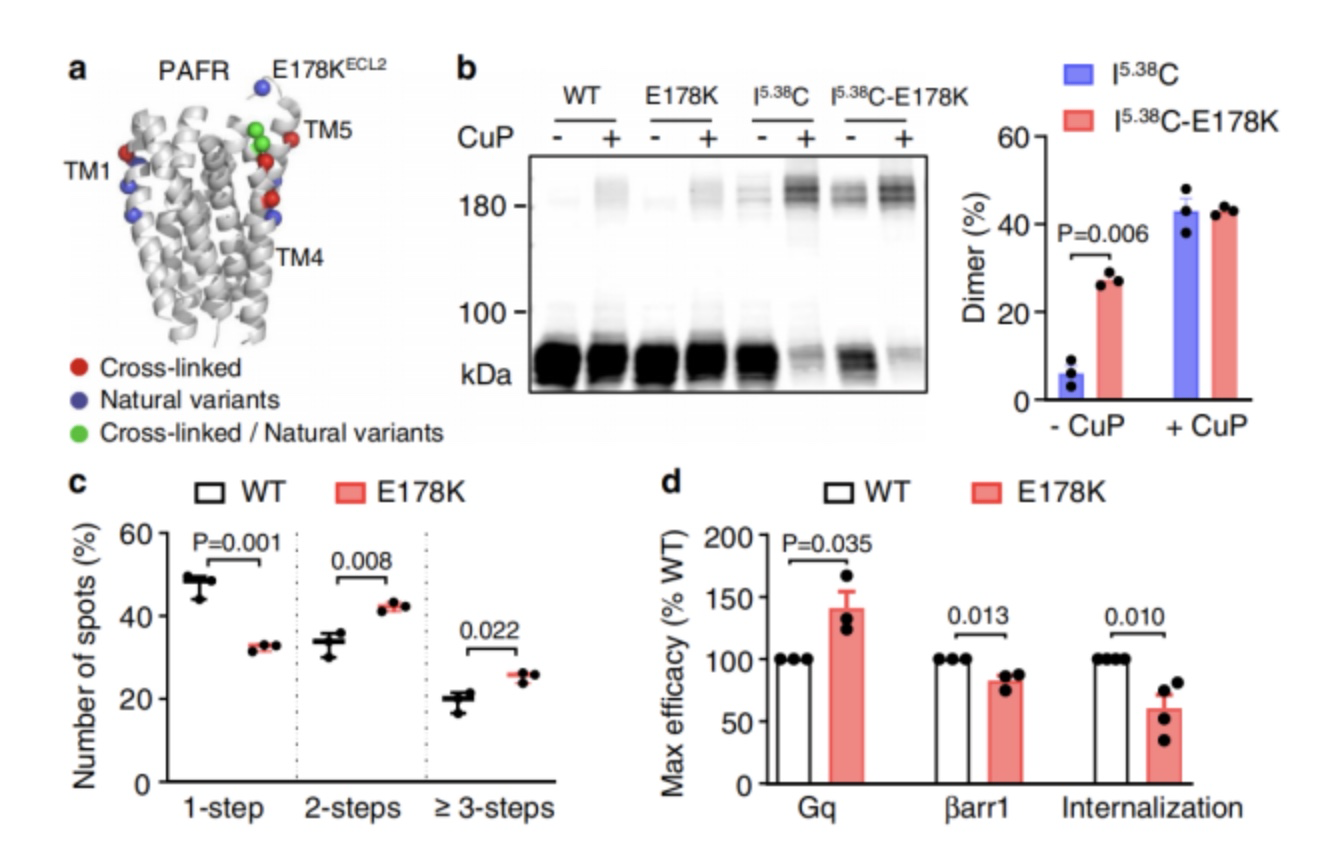
图5
06
PAFR二聚体的Gq与βarr
作者进一步研究了上述受体二聚体/寡聚体G蛋白偏置信号的分子机制。作者首先确认了PLC介导的细胞内钙释放是通过Gq激活而不是Gi激活的。其次通过BRET方法发现,βarr募集不足并非是PAFR二聚体募集GRKs不足引起的。接下来,作者研究了Gq信号的增加是否可能来自于没有βarr与激活受体上的G蛋白结合位点的竞争(PerkinElmer),结果发现Gq介导的Ca2+信号,在受体激活后的几秒钟内发生,远早于βarr招募(图6)。

图6
最后,作者验证了G蛋白偏倚对其他G蛋白和βarr2也是正确的。基于这些发现,作者提出了PAFR寡聚调节G蛋白活化和βarr接合的模型(图7e)。在该模型中,受体寡聚增加了G蛋白信号,同时减少βarr募集和激动剂诱导的受体内化。
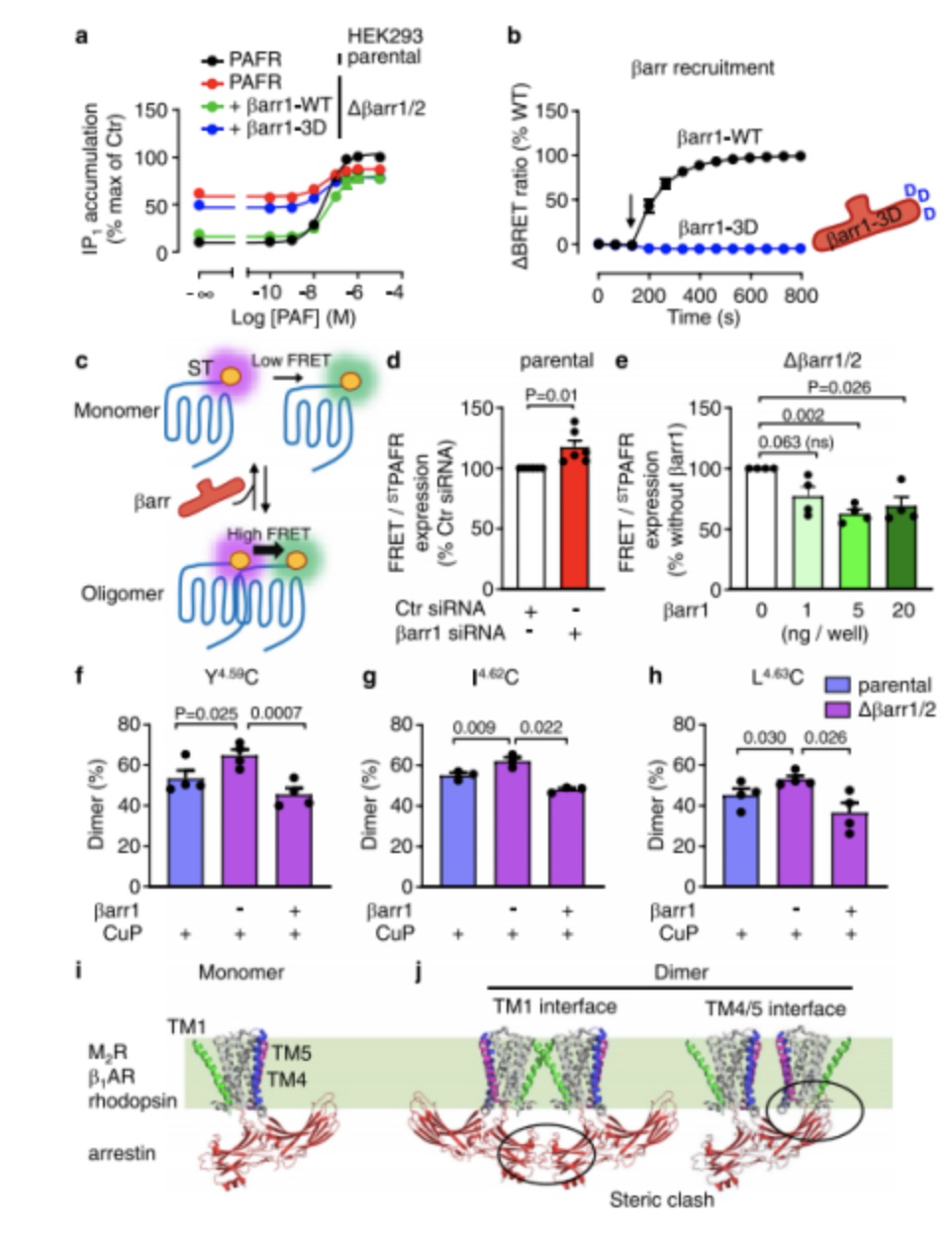
图7
07
β-arrestin与受体低聚体
作者利用βarr1 /2敲除(KO) HEK-293细胞进一步研究了βarr对G蛋白激活的影响。通过检测PAFR低聚体的数量(Tag-lite, PerkinElmer)并利用siRNA技术发现,βarr影响PAFR低聚体的数量,且在βarr的下调的同时,低聚体占比增加,说明了低聚化对βarr的募集不利(图8)。
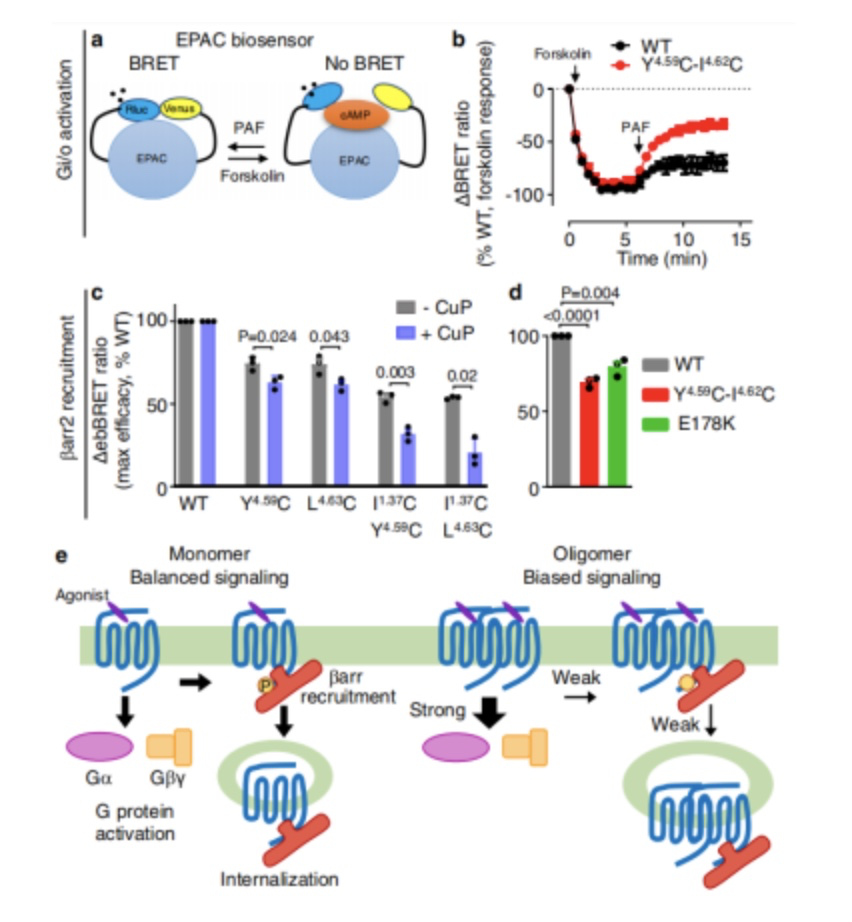
图8
参考文献:
Liu J, Tang H, Xu C, et al. Biased signaling due to oligomerization of the G protein-coupled platelet-activating factor receptor. Nat Commun. 2022 Oct 26;13(1):6365. doi: 10.1038/s41467-022-34056-4.

