
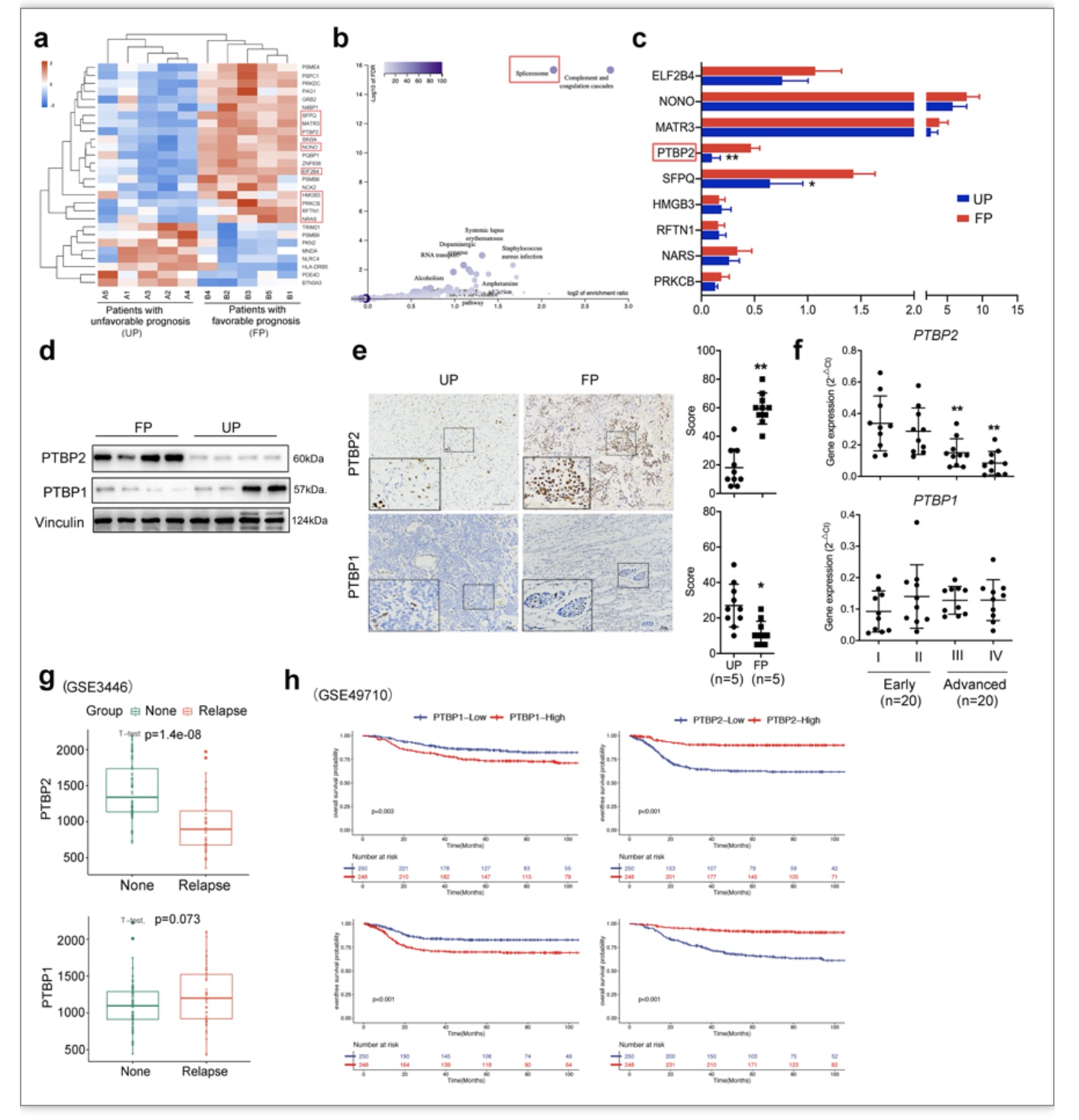
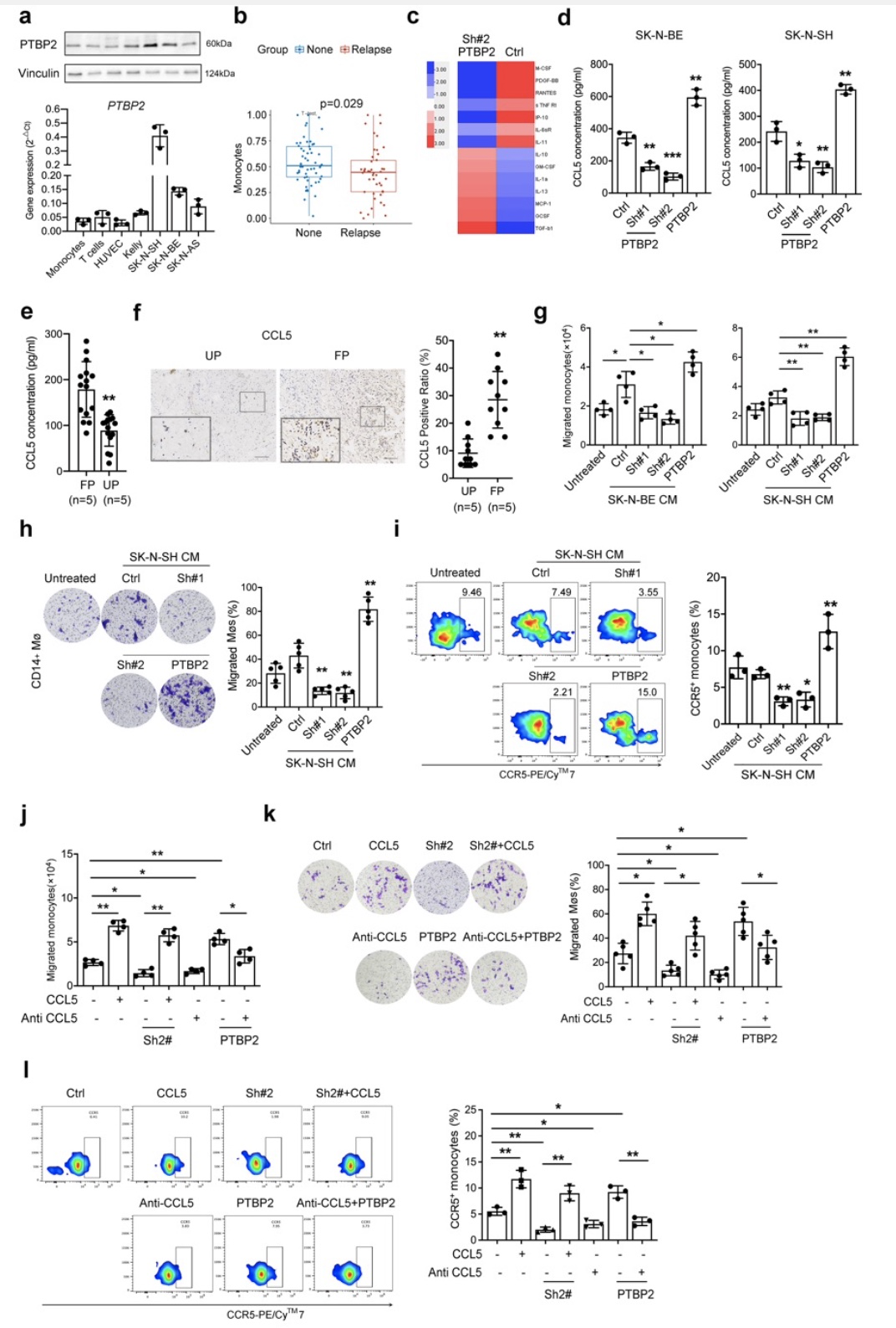
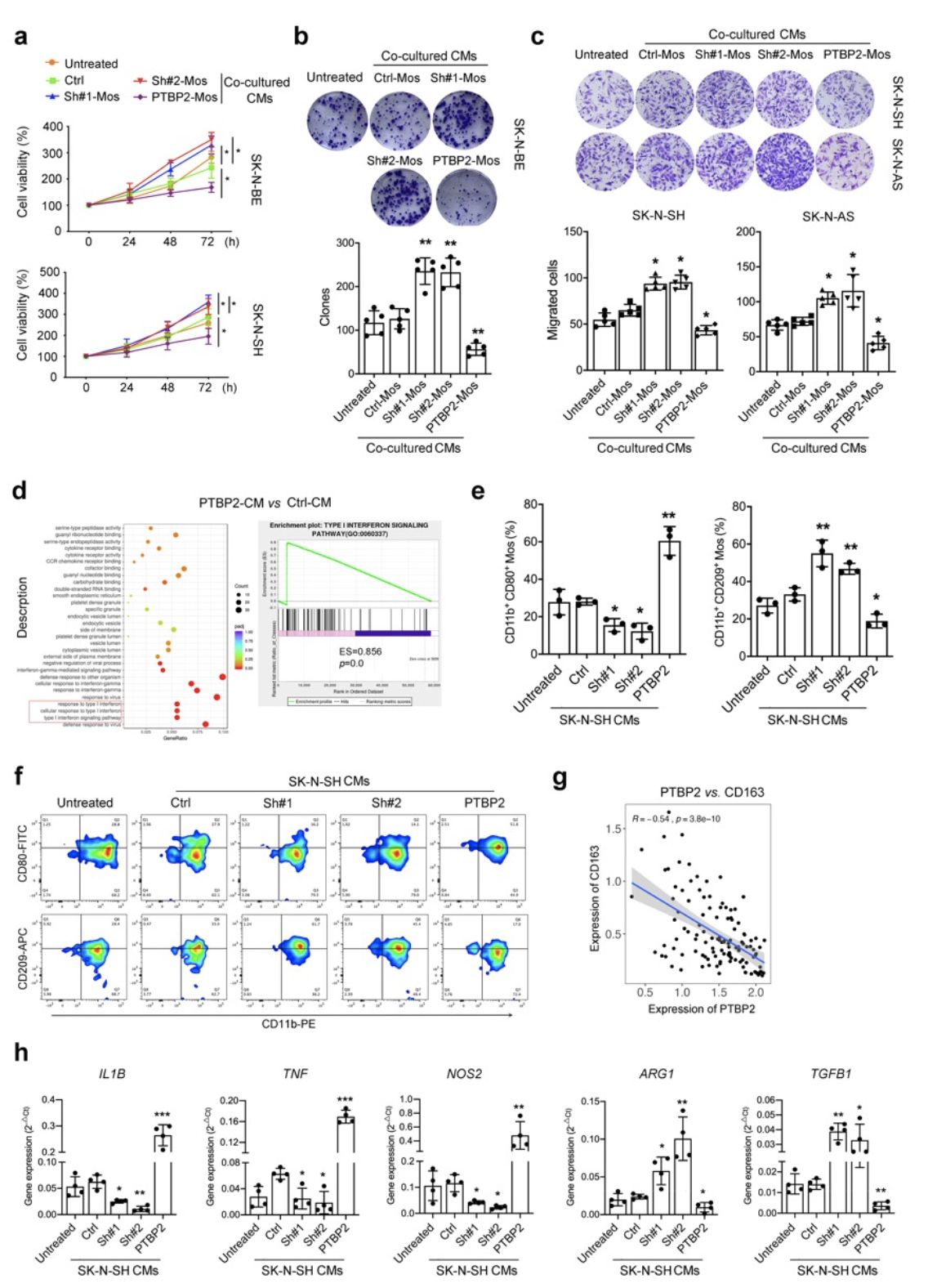
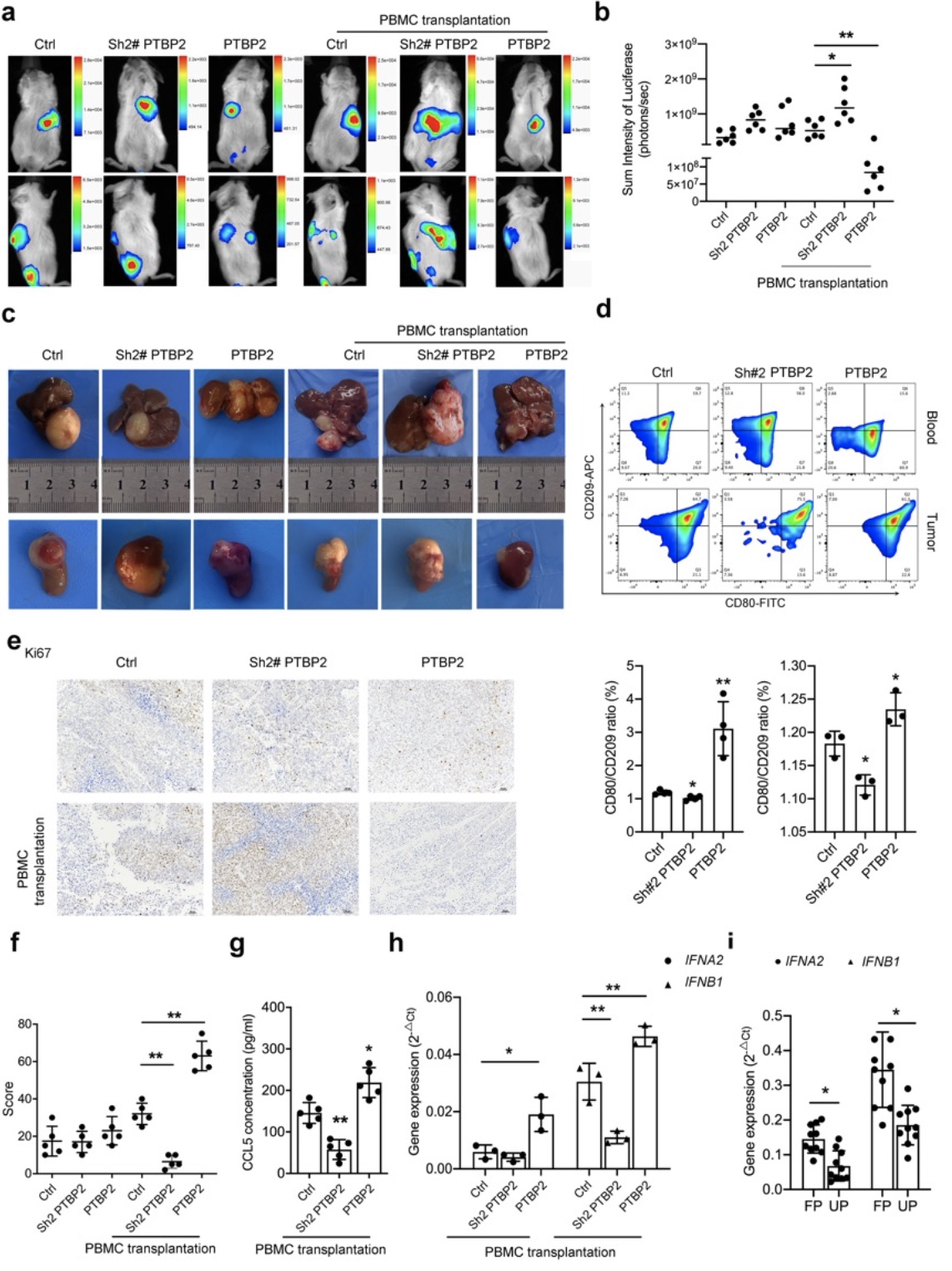
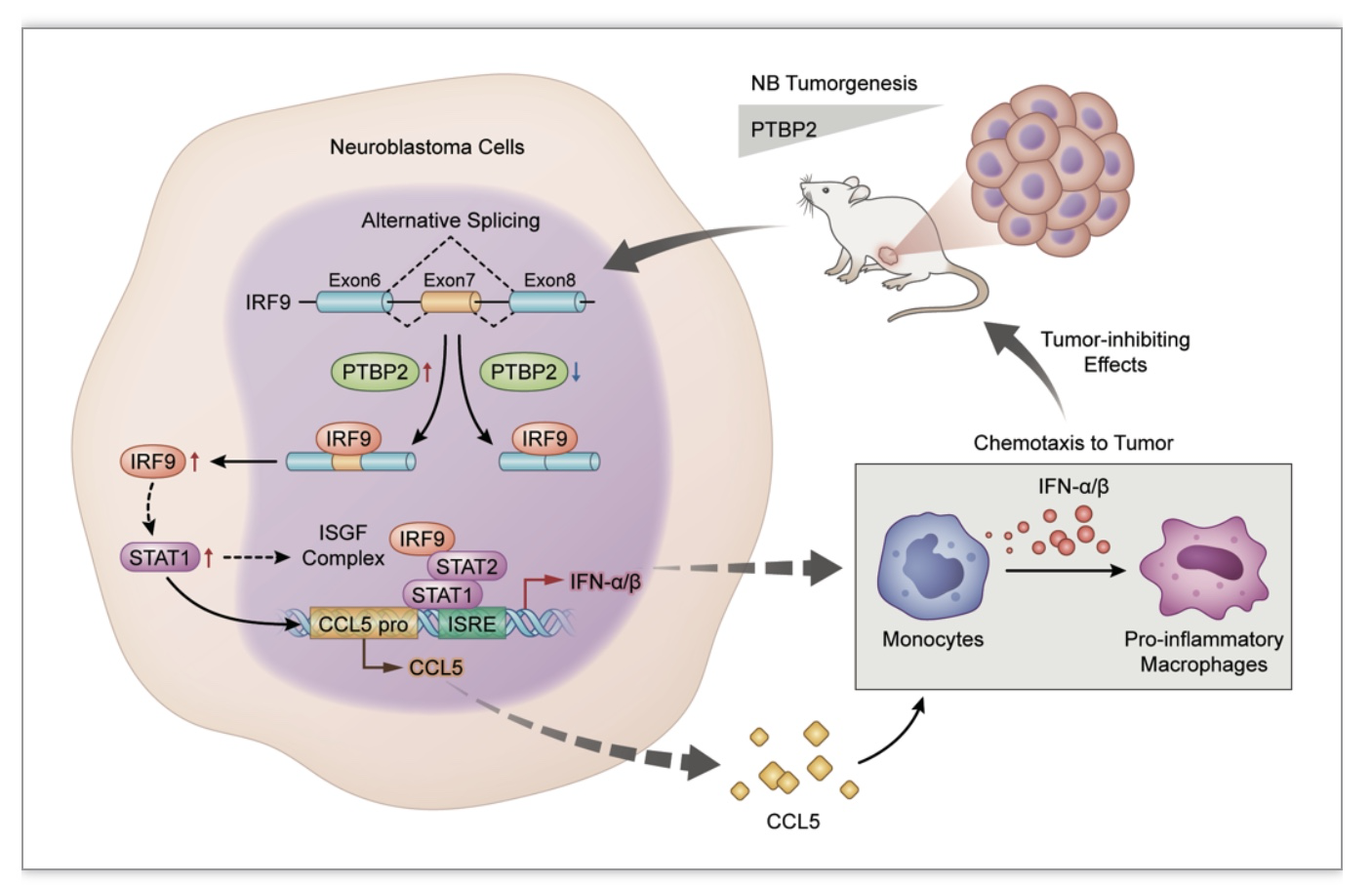
综上所述,该研究以神经母细胞瘤免疫微环境为研究重点,基于神母细胞瘤的预后差异性从术后不同预后组织标本进行蛋白组学测序并筛选出差异蛋白PTBP2,并进一步通过体内外实验模拟神经母细胞瘤微环境,阐述PTBP2通过促进单核细胞趋化和炎性表型转换发挥的抗肿瘤作用;机制研究表明PTBP2通过抑制IRF9发生可变剪切而失活,促进下游STAT1调控的ISGF复合物形成,最终促进CCL-5和IFNα/β的分泌发挥下游对单核细胞的调控作用。本项目的开展将是首次揭示神经母细胞瘤中PTBP2对单核细胞功能的调控作用及临床意义,为寻找新的神经母细胞瘤分子标记物及治疗靶点提供实验依据及理论基础,有一定的临床转化及应用价值。

