小细胞肺癌(small cell lung cancer, SCLC)的发生和长期吸烟有着紧密相关性,约占新发肺癌的15%,是肺癌中恶性程度最高的类型。它具有发展迅速,转移早,以及容易复发等特性[1]。其至今为止,针对小细胞肺癌的临床治疗仍局限于使用传统的化疗方式,不可避免地导致病人的耐药和癌症的复发。因此,针对小细胞肺癌的靶向治疗具有十分重要的临床意义。
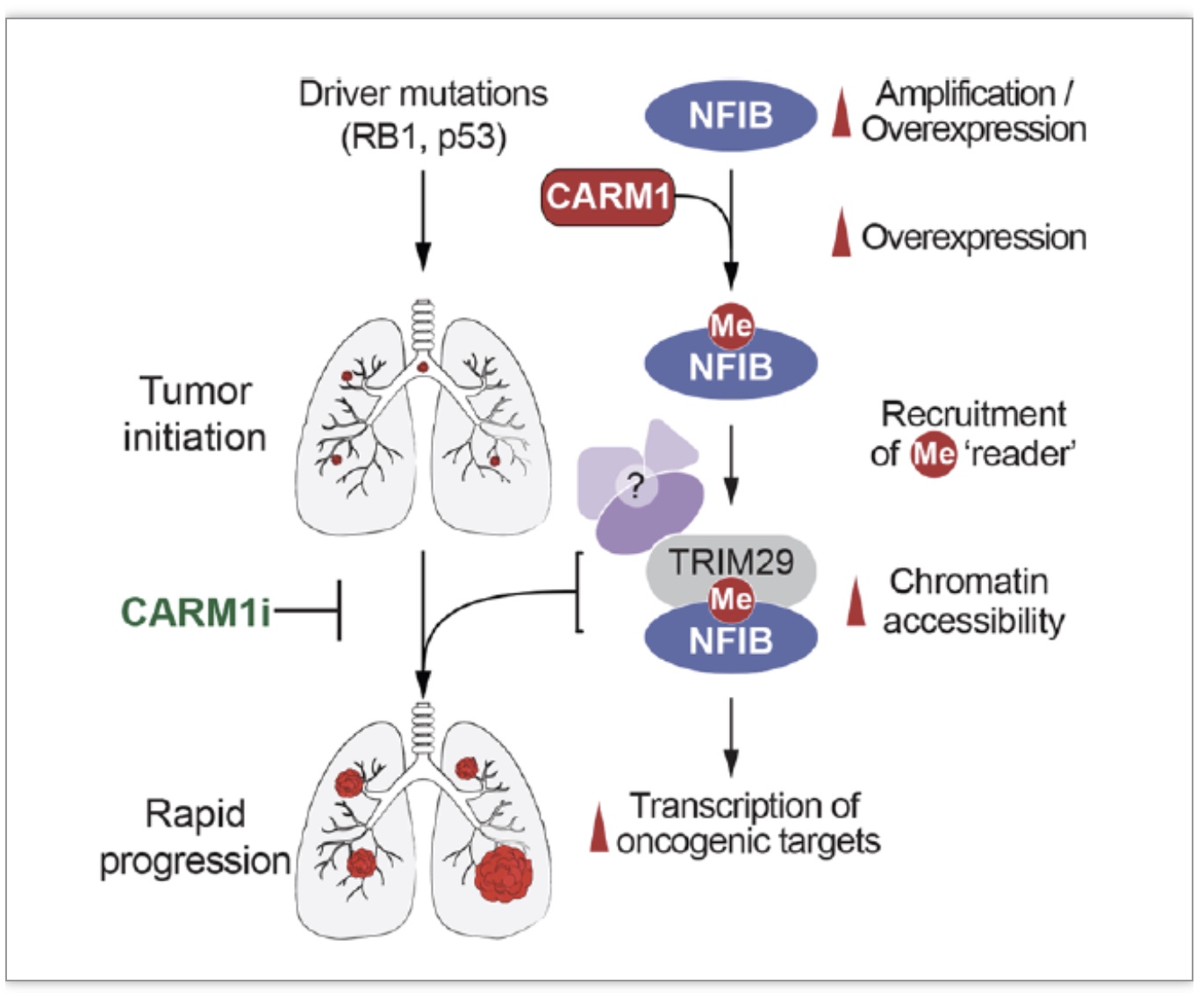
该研究发现调控小细胞肺癌肺癌的转录因子NFIB可以被甲基化修饰;单独敲除甲基转移酶或者对NFIB甲基化位点进行突变可以大幅提高小细胞肺癌小鼠模型的生存期;而使用CARM1的酶活性抑制剂可以显著抑制小细胞肺癌病人来源肿瘤异种移植(Patient-derived tumor xenograft, PDX)模型的生长。该研究为靶向治疗小细胞肺癌提供了可靠的理论依据与初步证据。
近期的研究发现NFIB基因在一部分小细胞肺癌中有特异性扩增,而该基因的扩增伴随着更为恶性的癌细胞转移[2-4]。由于NFIB基因属于转录因子,而转录因子作为治疗靶点有着天然的局限性,很难针对其研发有效的小分子药物。相对而言,针对活性酶类化学反应特点的小分子药物更容易被用来作为靶向性药物进行开发。蛋白质甲基化修饰属于表观遗传学的一个重要分支,包括精氨酸甲基化和赖氨酸甲基化。其中精氨酸甲基化主要通过包括CARM1(也称作PRMT4)在内的9个甲基转移酶(protein arginine methyltransferases,PRMTs)来发生反应[5]。
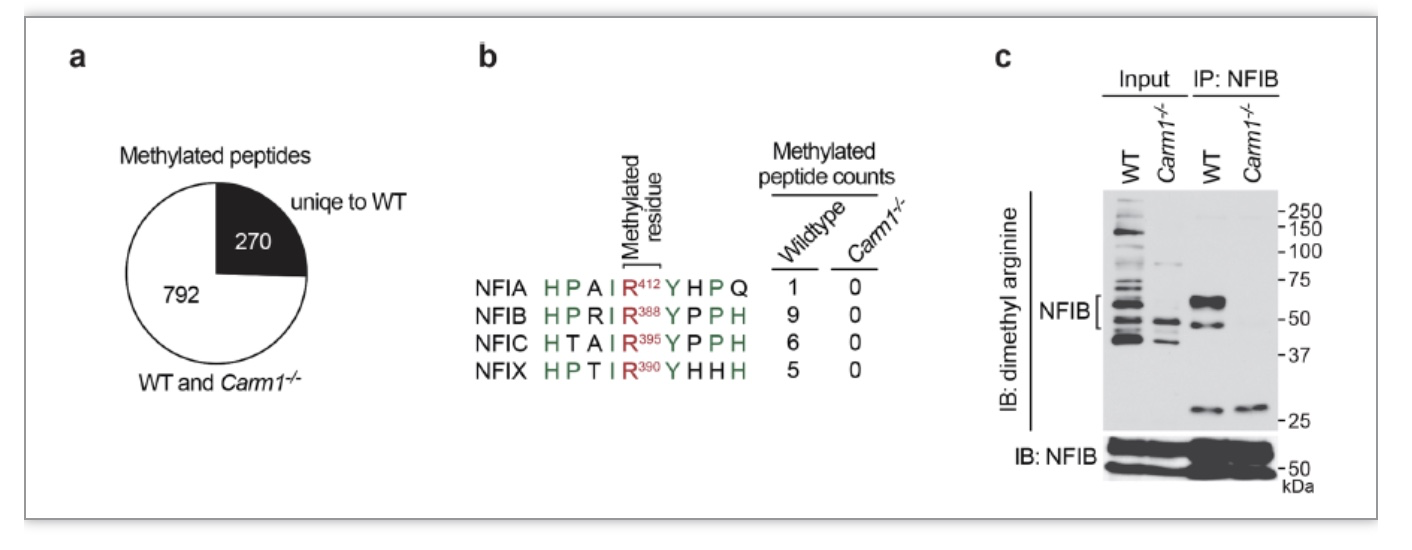
本研究的作者们通过对CARM1野生型和CARM1缺失型细胞进行质谱分析,发现了包括了NFIB在内的整个nuclear factor I家族的蛋白都可以被CARM1甲基化(图1)。由于NFIB基因敲除小鼠和CARM1基因敲除小鼠具有高度相似的表型(即小鼠出生不久便会因为肺功能不全而死亡)[6-7],作者们认为CARM1与NFIB的功能在肺部有着非常高的相关性(图1)。由于NFIB在小细胞肺癌中扮演着促癌基因的角色,作者们决定研究CARM1以及NFIB甲基化在小细胞肺癌中的作用。
(图源 Gao et al., Nature Communications, 2023)
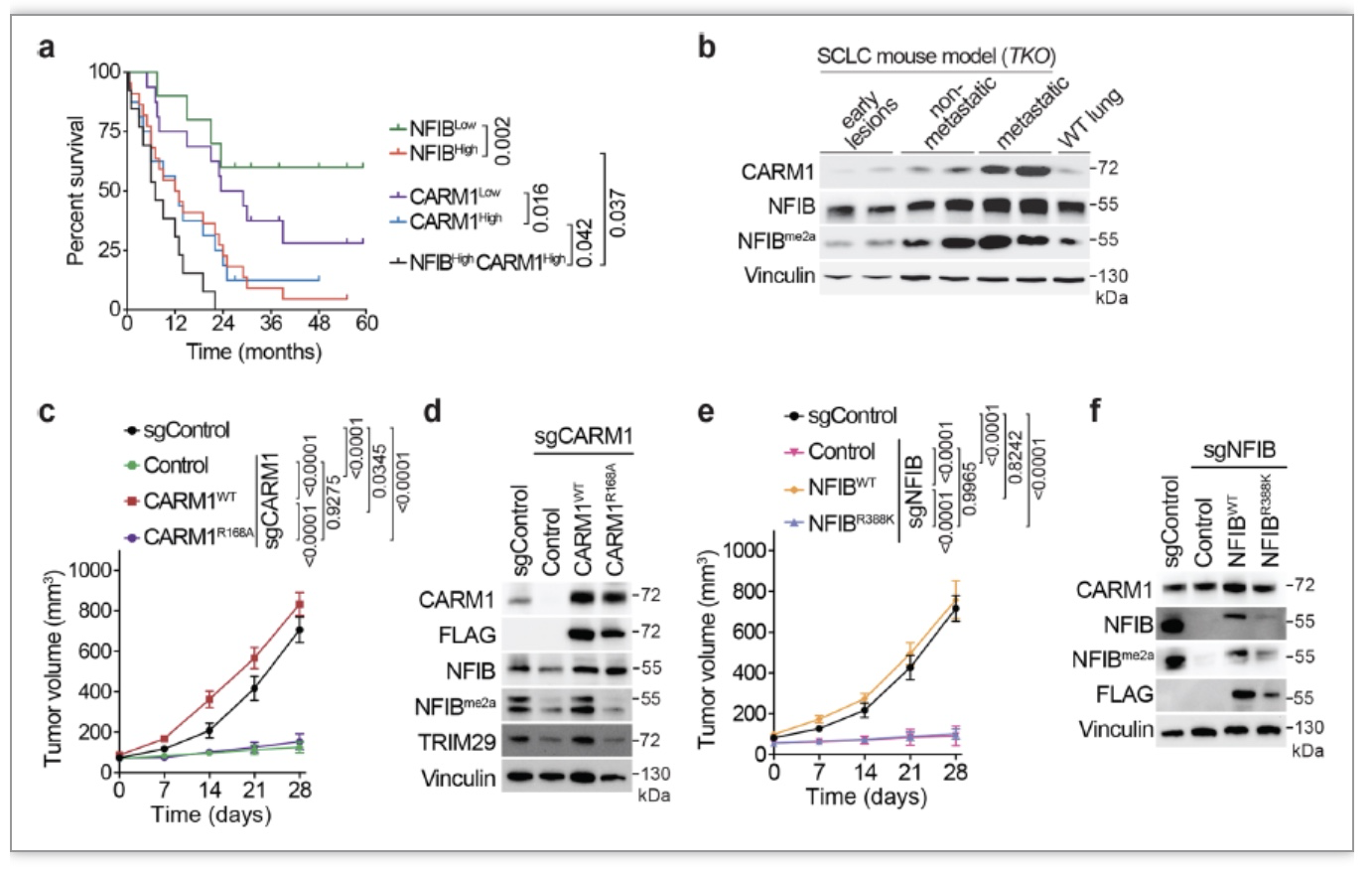
通过免疫组化结果分析,作者们发现NFIB和CARM1表达水平高的小细胞肺癌病人有着明显较短的生存期(图2a-b)。当使用异种移植小鼠模型(Xenograft)时,不管是利用CRISPR/Cas9技术敲除CARM1还是NFIB,小鼠体内的肿瘤生长都得到了显著的抑制。并且,这种肿瘤抑制作用十分依赖于CARM1的酶活性(CARM1R168A为酶活性缺失型),以及正确的NFIB甲基化位点(R388)(图2c-f)。
图2 SCLC异种移植小鼠模型的生长依赖于NFIB的甲基化
(图源 Gao et al., Nature Communications, 2023)
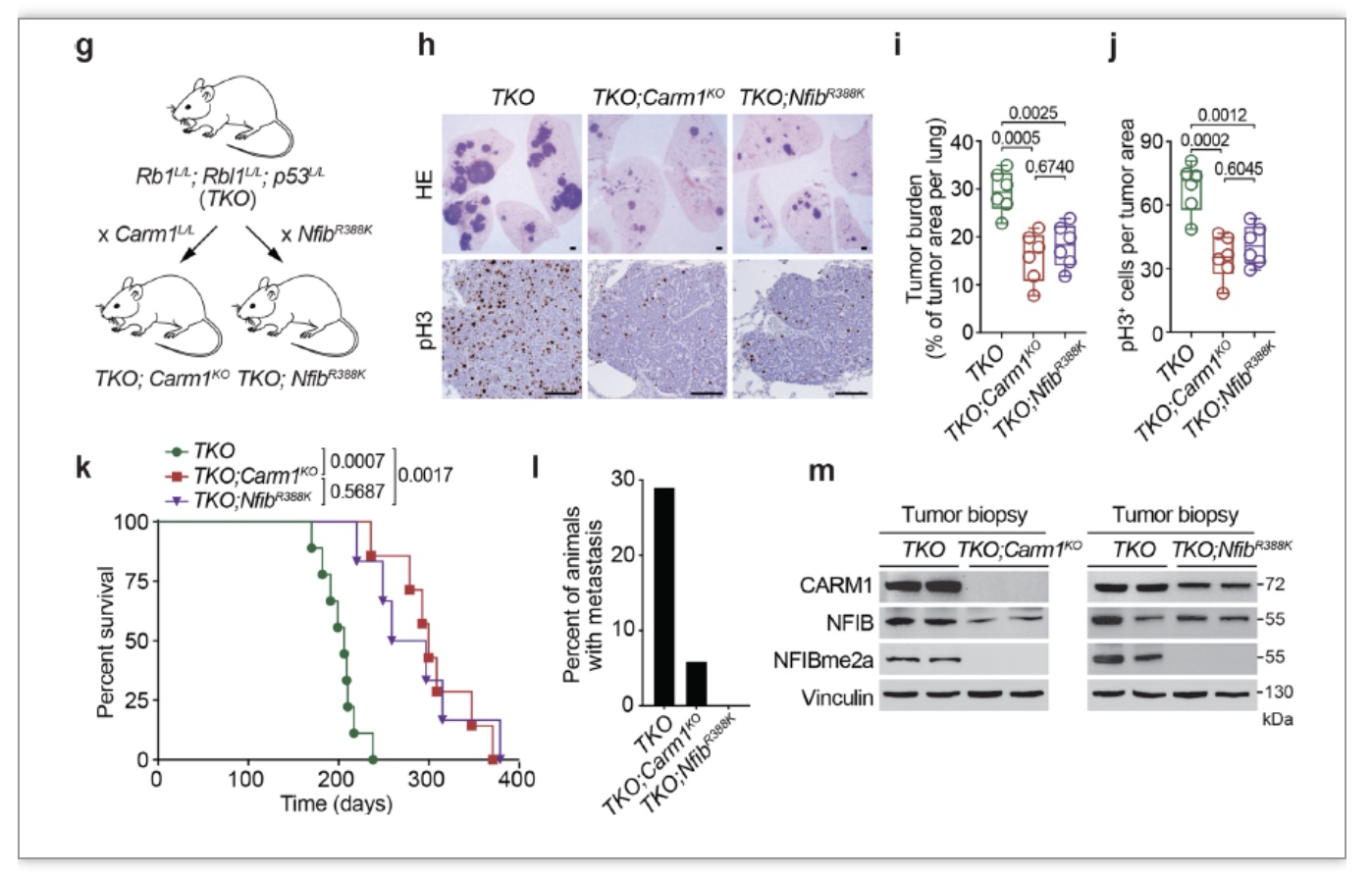
作者们除了使用异种移植小鼠模型,还使用了更有说服力的基因改造小鼠模型(genetically engineered mouse models,GEMMs)。在小细胞肺癌基因改造小鼠模型中敲除CARM1,或是将NFIB甲基化位点进行突变,都能明显降低小鼠体肺部的肿瘤大小(图3g-j),并大幅提高这些小鼠的生存期(图3k)。同时,癌细胞的转移也得到了显著的抑制(图3l)。
图3 去除NFIB甲基化可降低SCLC癌细胞生长扩散速度并延长基因改造小鼠生存期
(图源 Gao et al., Nature Communications, 2023)
为了阐述CARM1/NFIB调控小细胞肺癌的机制,作者们对小鼠癌症样本进行了染色质开放性测序(transposase-accessible chromatin with sequencing,ATAC-Seq),发现 CARM1敲除小鼠和NFIB突变小鼠有着极为相似的开放性染色质(图4a-e)。同时,RNA测序结果也显示被CARM1调控的基因和被NFIB甲基化调控的基因有着很明显的重叠(图4f)。而这些被调控的基因则很多都能被原癌基因Myc调控,还有一些则与神经元功能相关(图4g-h)。Myc作为原癌基因在各种癌症包括小细胞肺癌中的作用广为人知,而小细胞肺癌本身又有着神经元的特性[8],因此测序结果能较好地解释CARM1/NFIB调控小细胞肺癌的机制。
图4 基因测序揭示CARM1/NFIB调控SCLC的机制
(图源 Gao et al., Nature Communications, 2023)
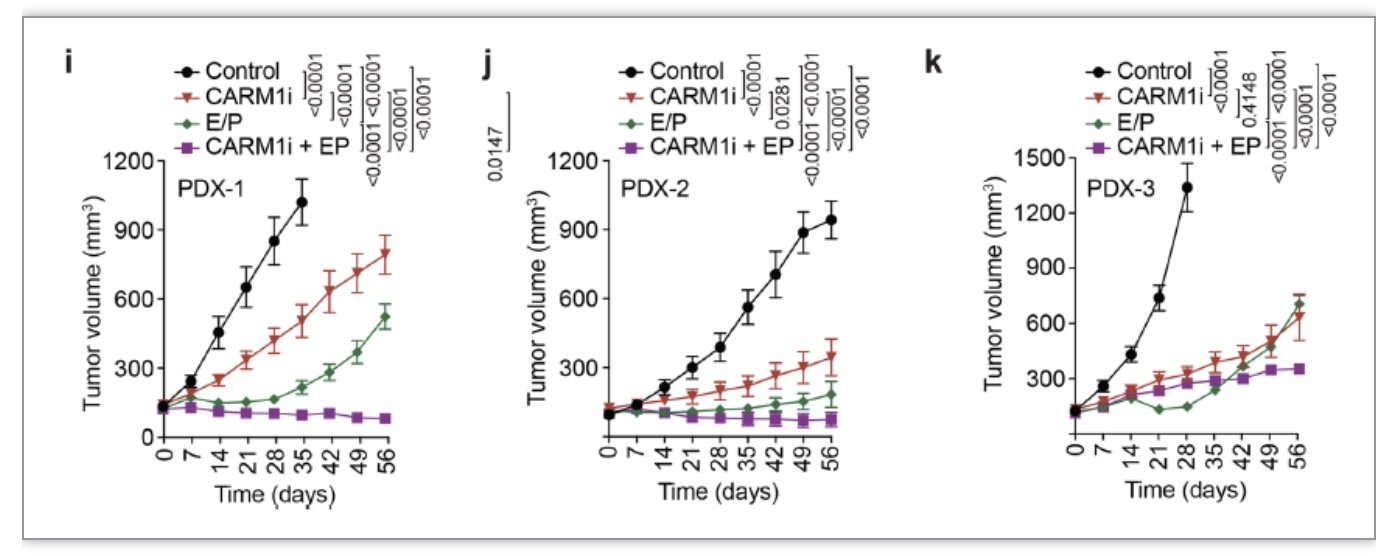
更为重要的是,使用针对CARM1活性的抑制剂可以明显抑制小细胞肺癌病人来源肿瘤异种移植模型(PDX)内的肿瘤形成。当与传统化疗药物联合使用时,CARM1抑制剂在不同的PDX模型中表现出了一致且明显的抗肿瘤效果(图5)。以上结果表明,以NFIB甲基化作为治疗小细胞肺癌的靶点有着相当不错的前景。
图5 CARM1抑制剂对于SCLC PDX的抑制效果明显
(图源 Gao et al., Nature Communications, 2023)
(图源 Gao et al., Nature Communications, 2023)
综上所述,该研究发现并系统性地验证了NFIB的甲基化,首次揭示了单一蛋白质的甲基化修饰在癌症发展中的重要调控作用(图6)。该研究利用了多个不同的癌症研究系统,以及不同的基因测序技术,系统性地探讨了NFIB甲基化调控小细胞肺癌的机制,并初步验证了CARM1抑制剂作为特异性小分子类药物对小细胞肺癌的抑制作用。
蛋白质甲基化调控体系除了主要的反应酶(enzyme)和底物(substrate)之外,还有效应分子(effector)。本研究还揭示了一个全新的精氨酸甲基化效应分子,名为TRIM29。敲除TRIM29也可以抑制小细胞肺癌的生长。然而TRIM29对于小细胞肺癌的调控,是否特异性依赖于它与NFIB甲基化的相互作用仍不清楚。
目前针对表观遗传调控的小分子药物开发,要么是直接针对反应酶的酶功能区,要么是针对底物与效应分子之间的相互作用。前者成果较多,但由于一个酶(例如CARM1)可能对应多个底物以及细胞通路,此类药物可能有潜在的脱靶效应;后者理论上可以更精准的靶向对应的表观修饰,只不过目前领域内研究比较缓慢。如果TRIM29是唯一有效的调控NFIB甲基化在小细胞肺癌中作用的效应分子,那么针对TRIM29与NFIB甲基化相互作用的药物比起CARM1抑制剂将更有前景。