疼痛是一种有意识的主观体验,通常由痛觉刺激引起,涉及感官和情感两方面的因素。前扣带皮层(Anterior Cingulate Cortex, ACC)负责接收来自丘脑、海马体和杏仁核等边缘区域的输入,对控制选择性注意和工作记忆至关重要。ACC作为调节内脏疼痛的感觉和情感方面的关键大脑区域的发现,是慢性疼痛的中枢神经领域的一个重要进展。星形胶质细胞是一种神经胶质细胞,可以通过释放活性物质来感知和改变周围突触的突触活动,并参与调节神经环路。其中,L-乳酸是糖酵解的代谢产物,由星形胶质细胞糖原无氧酵解产生,经星形胶质细胞-神经元乳酸穿梭(astrocyte neuron lactate shuttle,ANLS) 为神经元细胞提供能量,是记忆的建立巩固过程中不可或缺的因素[1]。然而,星形胶质细胞及ANLS在疼痛厌恶记忆中扮演何种角色,目前仍鲜见报道。报道了ACC星形胶质细胞通过L-乳酸信号调节大鼠内脏疼痛厌恶记忆。他们建立了大鼠疼痛相关厌恶记忆行为学范式,通过糖原磷酸酶抑制剂DAB微量注射、星形胶质细胞化学遗传调控、L-乳酸微透析测量等方法深入研究这一课题。
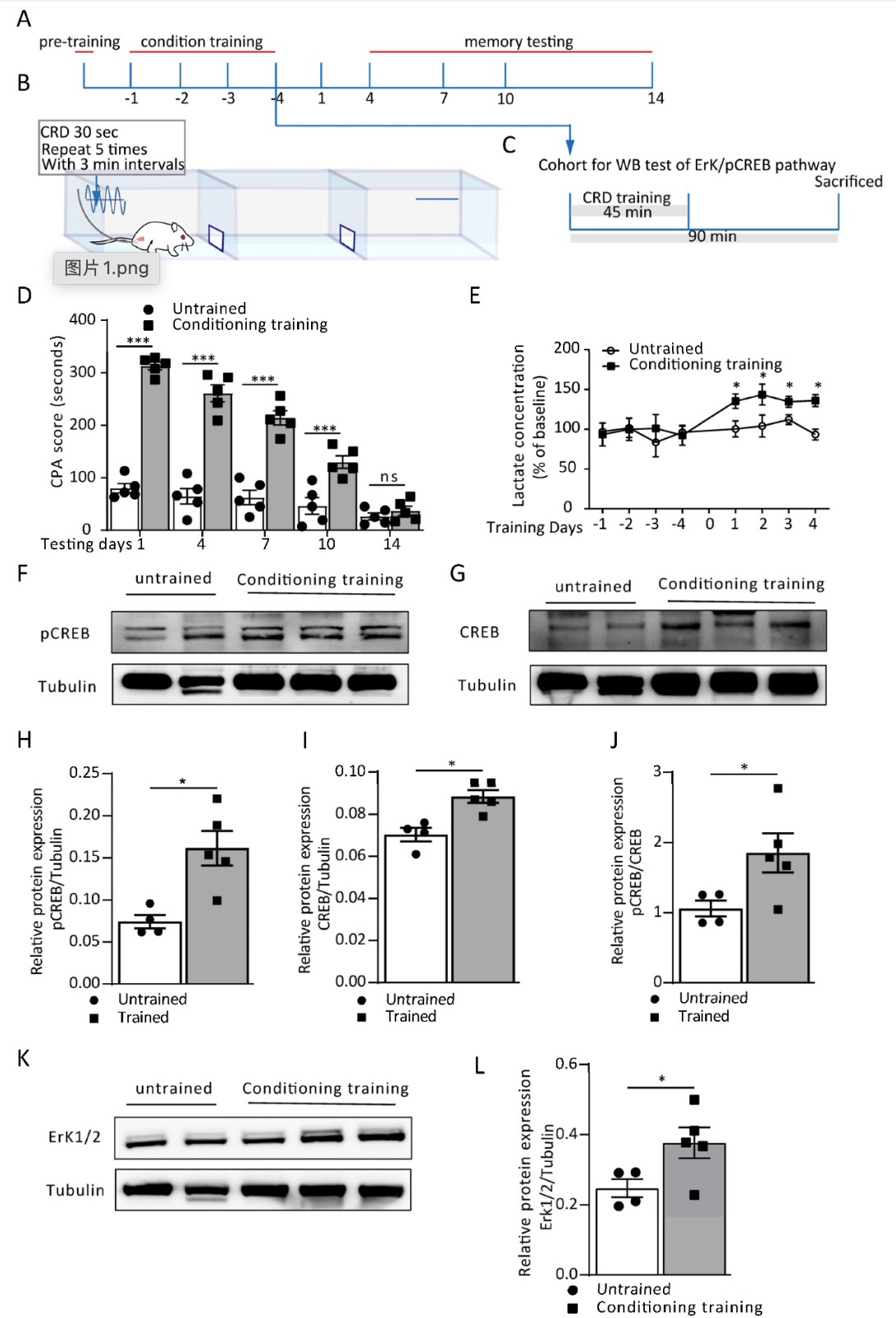
首先,李婴教授团队使用了大鼠疼痛厌恶记忆行为学范式。即将结直肠扩张(Colorectal Distention, CRD)所诱发的内脏疼痛与条件位置回避(Conditioning Place Avoidance, CPA)行为相结合。训练大鼠习得内脏疼痛与特定位置的记忆联系,对接受CRD的场所产生厌恶并回避。结果显示,大鼠CPA训练时,其ACC内L-乳酸水平显著上升,与此同时,突触可塑性相关即刻基因(Plasticity-related immediate early genes,Plasticity-related IEG)蛋白表达亦明显升高。显示疼痛厌恶记忆形成时ACC L-乳酸大量释放,提示星形胶质细胞糖原酵解与之密切相关。
图1. 疼痛厌恶记忆训练诱导ACC内星形胶质细胞释放L-乳酸
(图源:Iqbal Z et al., Cells, 2022)
接下来,作者团队于ACC内微量注射糖原磷酸酶抑制剂DAB,其仅阻断糖原酵解,而对葡萄糖水解过程无任何影响。结果显示,DAB微量注射大鼠疼痛厌恶记忆明显降低,同时其ACC内L-乳酸水平显著下降,突触可塑性相关IEG表达蛋白亦合成减少。而外源性注射微量L-乳酸可完全纠正DAB导致的疼痛厌恶性记忆障碍。以上结果表明,ACC星形胶质细胞糖原无氧酵解产生的L-乳酸,是疼痛厌恶记忆形成不可或缺的因素。
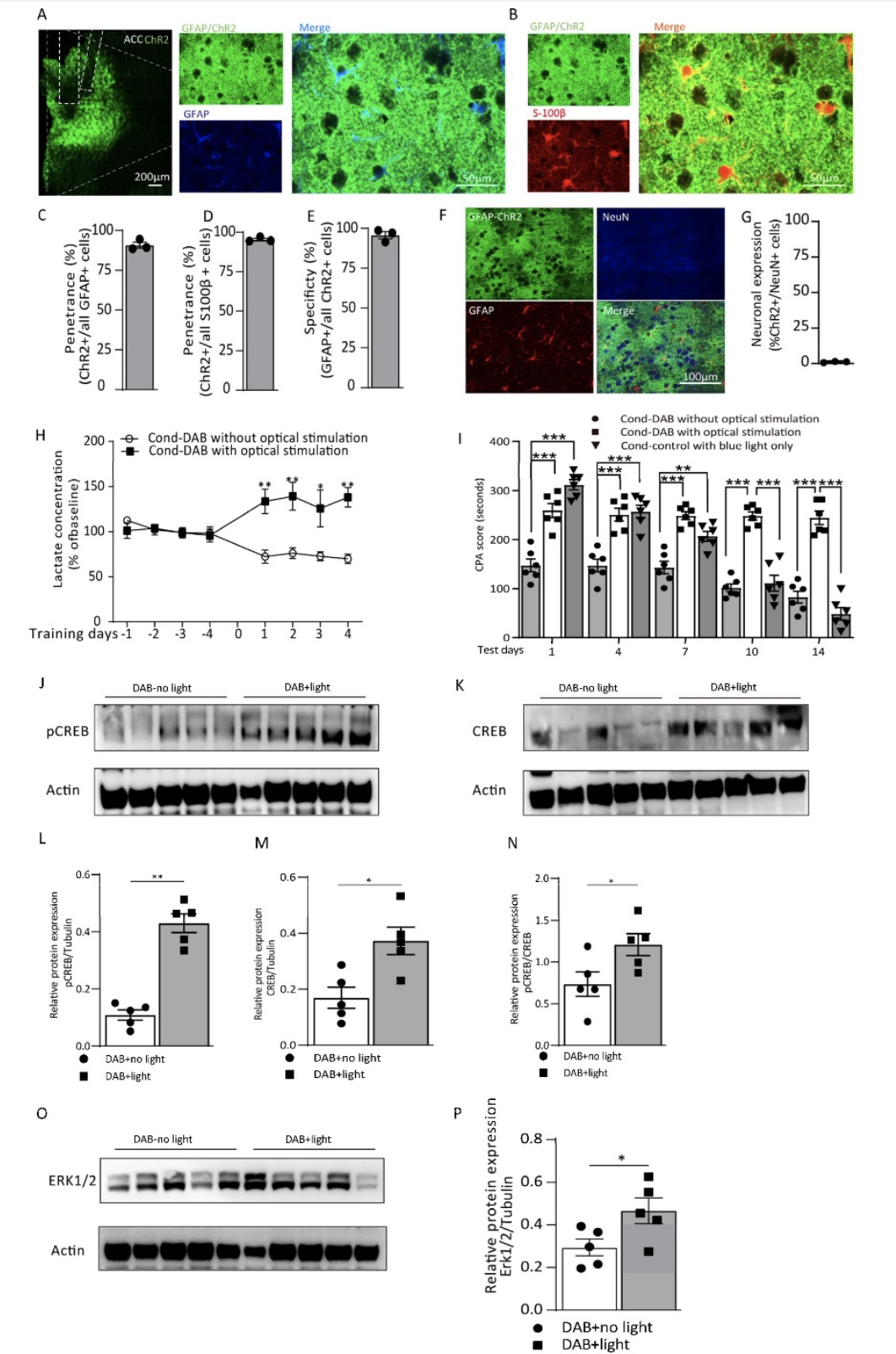
为了进一步探讨星形胶质细胞在疼痛厌恶记忆形成中的作用机制,作者于ACC内注射AAV8-gfaABC1D-hChR2(H134R)-eGFP病毒,与同一位点留置光遗传光纤及微量注射套管,使用光遗传方法激活ACC星形胶质细胞。结果显示,星形胶质细胞光遗传激活可显著增强疼痛厌恶记忆,上调突触可塑性相关IEG蛋白表达,并升高ACC细胞外L-乳酸水平。而由光遗传激活所增强的疼痛厌恶记忆可被DAB微量注射明显抑制。上述结果提示,光遗传激活可促进星形胶质细胞糖原酵解和L-乳酸释放,从而增强疼痛厌恶记忆的形成。
图2. ACC中星形胶质细胞的光遗传学激活通过增加L-乳酸水平逆转糖原分解阻断引起的疼痛厌恶记忆损伤
(图源:Iqbal Z et al., Cells, 2022)
综上所述, ACC星形胶质细胞糖原酵解产生的L-乳酸信号在疼痛厌恶记忆中起到了不可或缺的作用。星形胶质细胞是中枢神经系统中储存糖原的胶质细胞,其通过ANLS释放并转运乳酸为神经元细胞提供快速高效的能量供给,而星形胶质细胞光遗传刺激亦可促进这一代谢过程。星形胶质细胞包含两类功能,即能量代谢与胶质递质释放,其两者之间绝非孤立无关,而通过EAAT转运体[2],谷氨酸-谷氨酰胺循环等存在着大量交互作用(Cross talking),其中的机制有待我们深入研究。