PET(polyehylene terephthalate)塑料被广泛应用于人类生活的各个方面,极大的方便了日常生活,但是也带来了严重的环境问题[1]。2005年,Muller等人首次报道角质酶可以降解PET塑料[2],随后多个PET塑料水解酶被发现,PET塑料的生物降解成为研究热点。2019年,Yoshida等人从 Ideonella sakaiensis 201-F6中鉴定出一种PET塑料降解酶(IsPETase)[3]。该酶是人类发现的第一个自然进化过程产生的真正意义上的PET降解酶,但是该酶的热稳定性差,在37℃孵育24小时后丧失绝大部分活性,所以对于需要在高温下进行分解的PET塑料并没有实际应用价值。多个课题组进行了该酶的理性改造,获得了一系列突变体,如ThermoPETase, DuraPETase,Fast-PETase等[4,5,6],特别是2022年报道的突变体Fast-PETase,能够在50℃的条件下降解PET塑料,在24 h内将之前需要几个世纪才能降解的PET塑料完全分解为单体TPA,为PET塑料的绿色循环利用提供了广阔的前景。但是如何大规模、低成本制备IsPETase及其突变体,以应用于工业化生产还未见报道。该研究利用毕赤酵母分泌表达系统成功实现了IsPETase及其突变体的高效表达,更重要的是发现通过毕赤酵母重组系统和Endo H去糖基化酶联用可以显著提高IsPETase的比活性和热稳定性。

IsPETase的编码序列经过密码子优化后送公司合成,并连接到毕赤酵母表达载体pHBM905BDM中,获得pHBM905BDM-IsPETase重组载体,随后通过生物砖的方法构建带有4个串联表达盒式结构的重组表达载体pHBM905BDM-IsPETase-4c,通过基因剂量效应提高目的蛋白的表达量。重组载体转化毕赤酵母GS115宿主菌株,随后进行5-L罐高密度发酵,结果显示IsPETase成功表达,并且被糖基化(图1a, b),通过Endo H去糖基化后可以看到明显的目的条带,对目的条带进行MS分析,进一步证实IsPETase成功表达(图1c,d),重组蛋白命名为IsPETase-Pp,发酵表达水平约1.2g/L,高于目前其他报道。采用MS/MS的方法对重组表达的IsPETase进行N、O-糖基化修饰分析,结果显示IsPETase中的8个潜在N-糖基化位点都有糖基化修饰信号,并且有19个位点检测到O-糖基化修饰,通过GLYCAM-Web (www.glycam.org)软件模拟糖蛋白的3D结构,结果表明糖基化修饰分布不均一,活性中心附近的糖基化修饰较少(图2)。
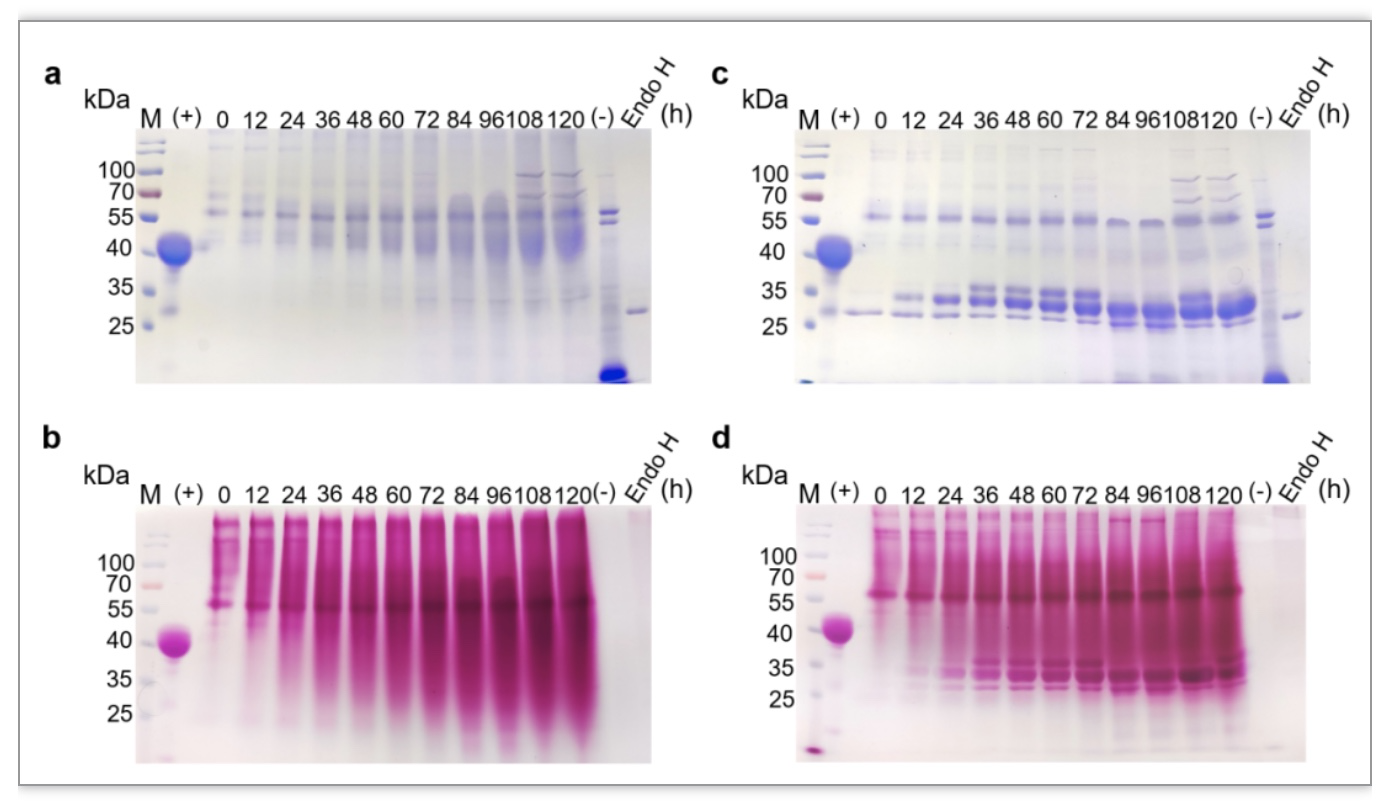
图1 IsPETase在毕赤酵母GS115中的重组表达。
(图源:Deng BY, et al., Communication Biology, 2023)

图2 通过GLYCAM-Web软件模拟的IsPETase-Pp糖蛋白的3D结构
(图源:Deng BY, et al., Communication Biology, 2023)
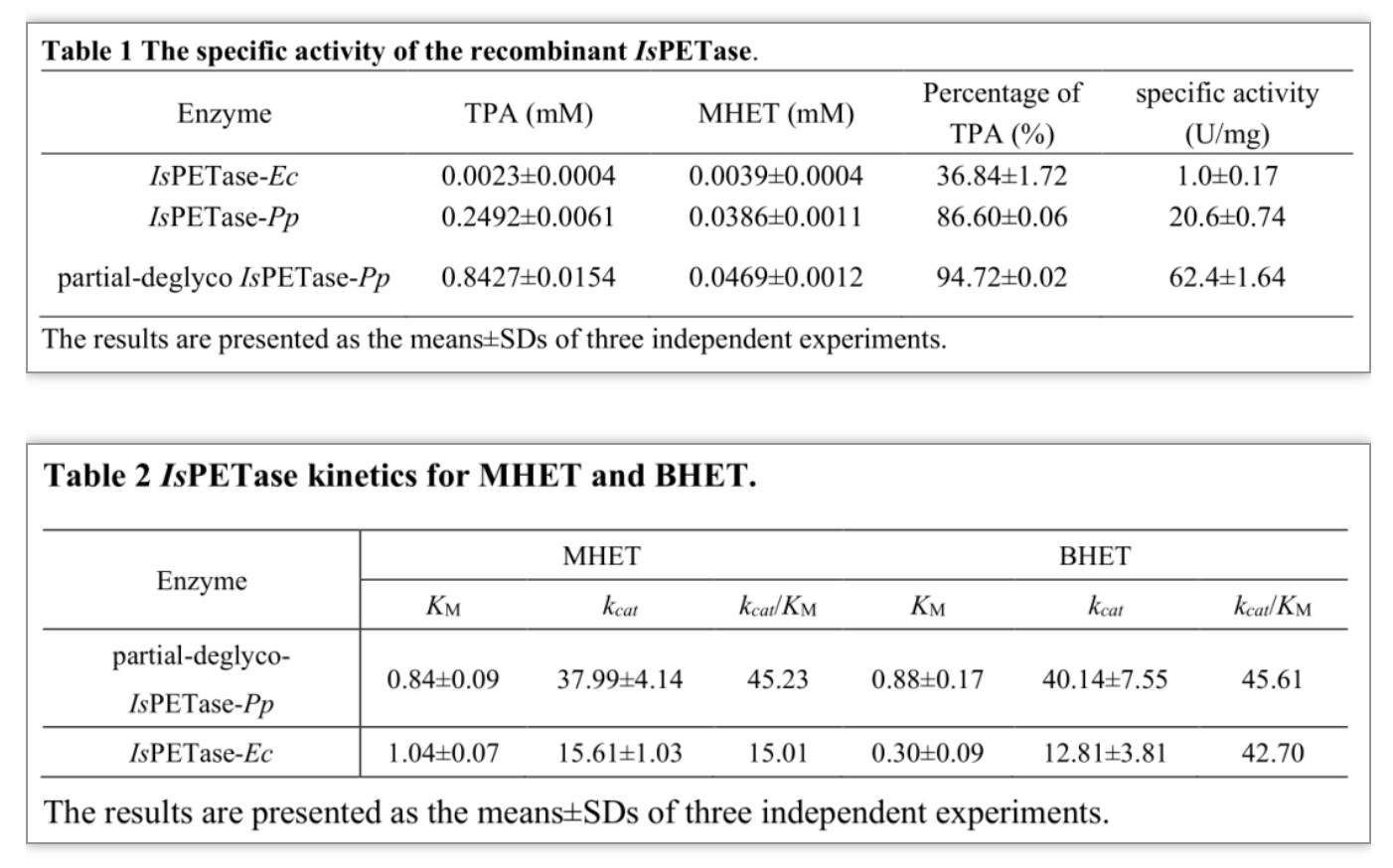
随后通过毕赤酵母分泌表达Endo H,利用发酵上清中的重组Endo H处理重组蛋白,去除N-糖基化修饰,然后进行酶学性质研究,结果表明去糖基化处理后的IsPETase-Pp与大肠杆菌重组表达的IsPETase(IsPETase-Ec)相比,具有更高的热稳定性,在40℃孵育12 h基本没有酶活力的丧失,在45℃和50℃孵育12 h也分别保留60%和20%左右的活性(图3a,b)。同时,该研究发现与IsPETase-Ec相比,IsPETase-Pp的比活力提高了20多倍,Endo H部分去糖基化后比活力提高60多倍(表1)。此外,以BHET和MHET为底物进行酶促动力学分析,结果表明Endo H处理后的IsPETase-Pp对MHET的kcat/KM值较IsPETase-Ec提高3倍(表2),所以其水解产物主要是单体TPA,这一特点更加有利于PET塑料的循环使用。
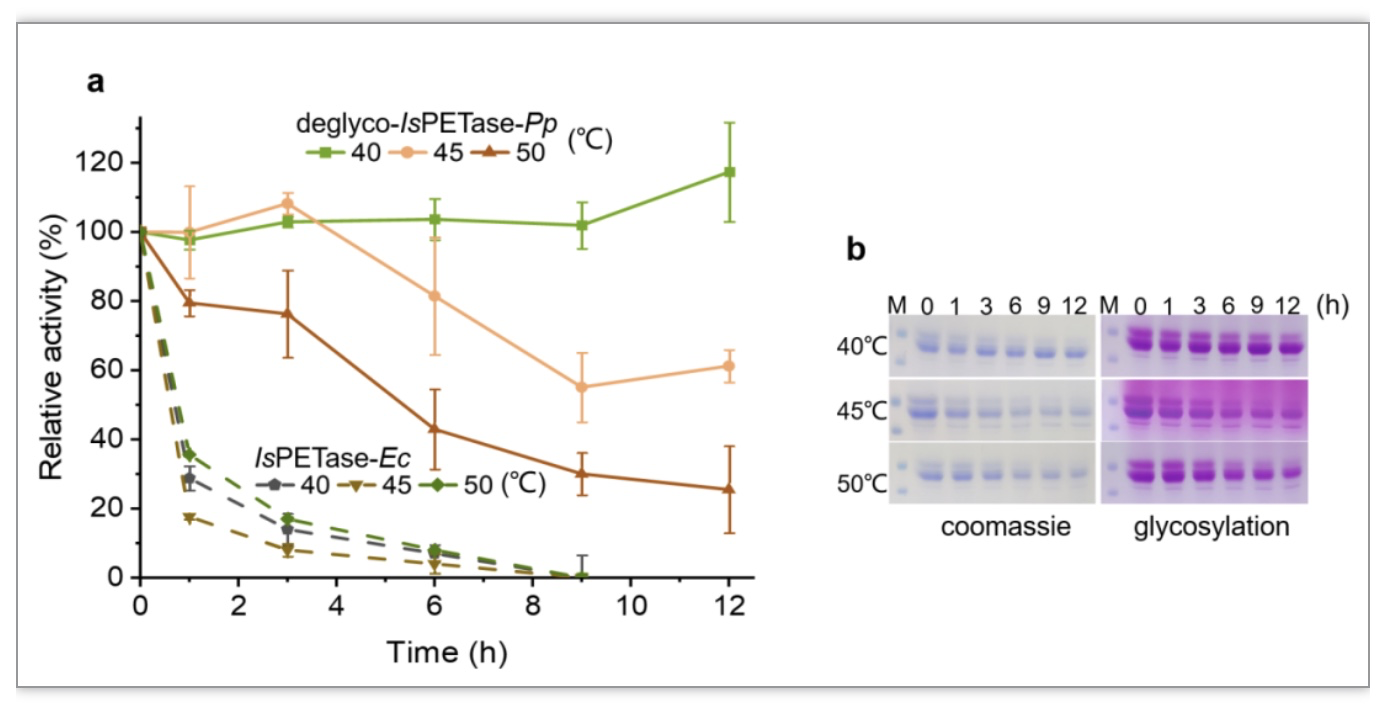
图3 部分去糖基化后的IsPETase-Pp的热稳定性分析
(图源:Deng BY, et al., Communication Biology, 2023)
在随后的实验中,采用毕赤酵母表达系统与Endo H联用的方法制备了重组Fast-PETase,结果与IsPETase一致。Fast-PETase获得成功表达,并且Endo H处理后的重组Fast-PETase的热稳定也获得了提高,在55和60℃均具有高热稳定性(图4)。
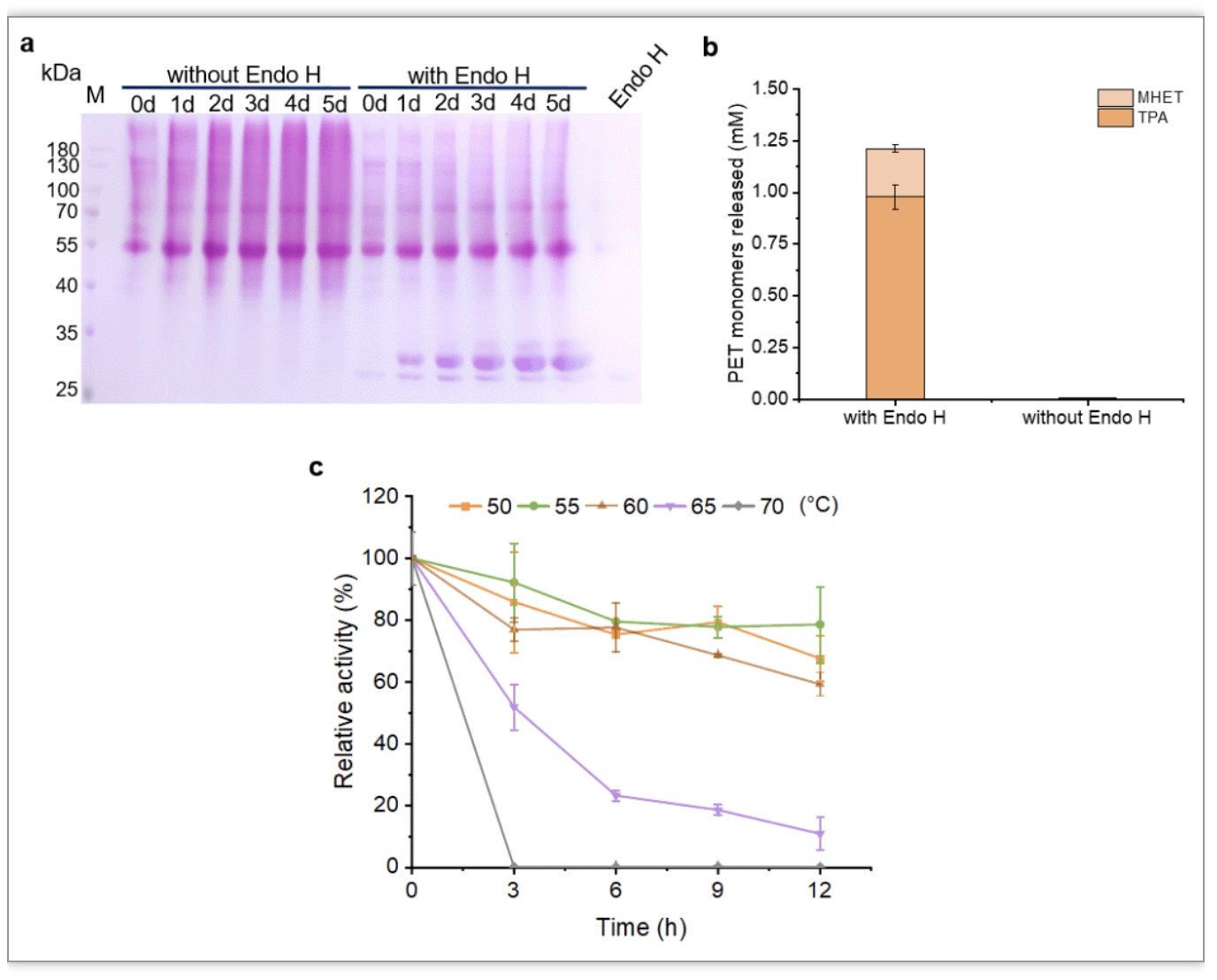
图4 Fast-PETase在毕赤酵母GS115中的重组表达及热稳定性分析
(图源:Deng BY, et al., Communication Biology, 2023)
为了研究糖基化修饰的IsPETase及其突变体对于PET塑料产品的降解能力,该研究从淘宝网站上随机购买了一次性黑色和白色PET托盘进行测试。首先,用打孔器在一次性PET托盘上切下6 mm直径的小圆片(约7 mg),加入重组IsPETase或其突变体进行降解,结果显示糖基化修饰的IsPETase在72 h能完全降解样品,突变体在48 h完全降解样品(图5 a,b)。随后将整个托盘(约5 g) 折叠后放入到蓝盖瓶中,加入15 mg糖基化修饰的Fast-PETase进行浸泡,每24 h更换酶液,结果显示,72 h后托盘几乎完全分解(图5 c)。与热稳定性实验结果一致,糖基化修饰的Fast-PETase在55℃条件下能够更快降解塑料托盘,比报道的温度提高5℃(图6)。
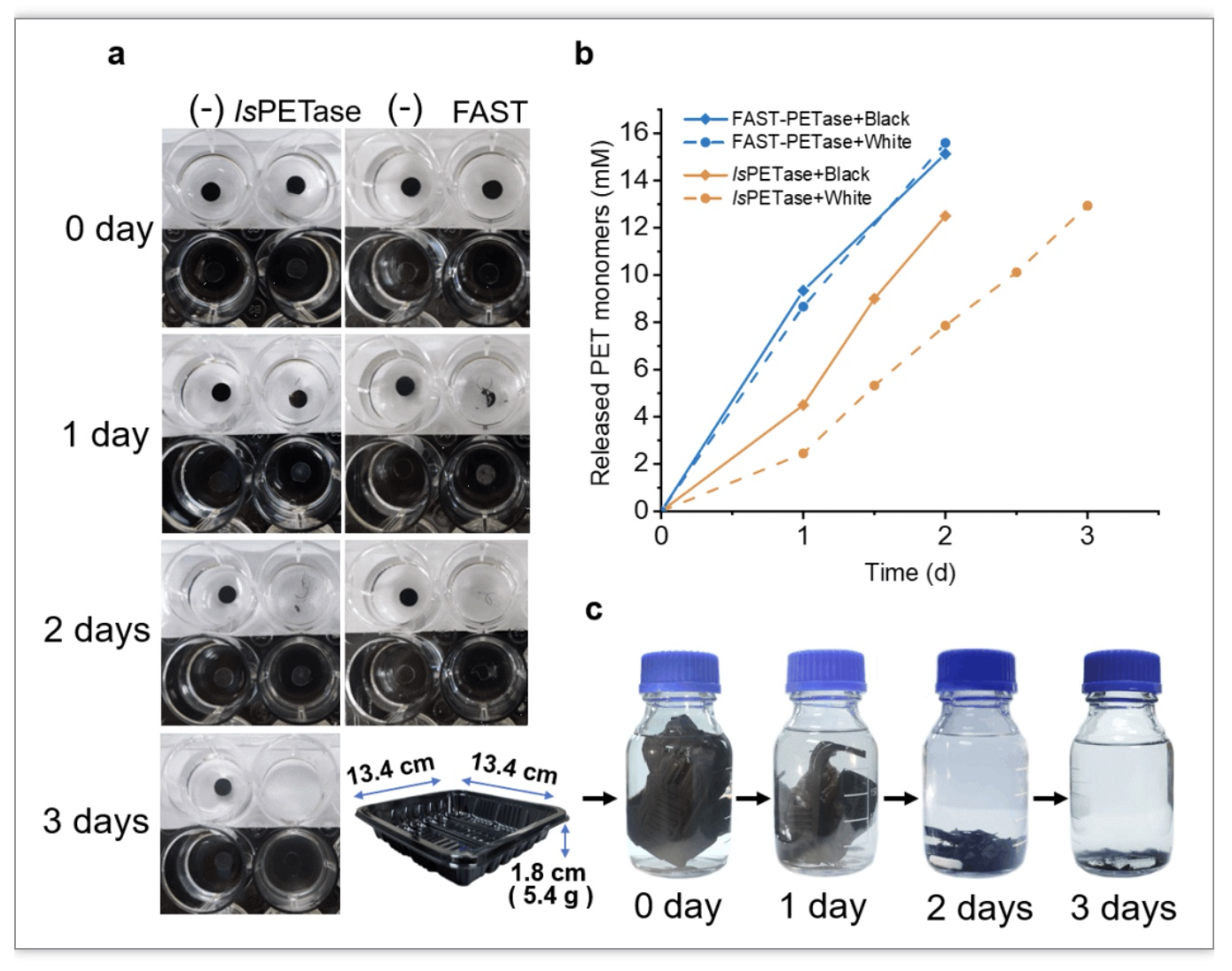
图5 部分糖基化修饰的IsPETase及其突变体对于PET塑料产品的降解能力分析
(图源:Deng BY, et al., Communication Biology, 2023)

图6 部分糖基化修饰的Fast-PETase在50℃和55℃对于PET塑料产品的降解能力比较
(图源:Deng BY, et al., Communication Biology, 2023)
综上所述,IsPETase上特殊的N-糖基化位点分布使得毕赤酵母分泌表达系统成为该蛋白的理想表达系统。该异源表达系统对目的蛋白的糖基化修饰不但能够防止蛋白酶对重组IsPETase的降解,实现目的蛋白的高水平表达,而且可促进目的蛋白的折叠,显著提高重组酶的比活性和热稳定性。同时,采用毕赤酵母重组表达Endo H,从而去除目的蛋白上过长的N-糖链的操作简便,能有效解决过度糖基化对于IsPETase活性的抑制作用。该研究解决了PET塑料降解从实验室研究到大规模工业化应用中如何低成本、高效率制备酶的难题,为PET塑料的绿色循环利用铺平了道路。

