前列腺癌是男性群体中发病率第二、致死率第五的恶性肿瘤[1],近年来,前列腺癌在中国的发病率呈上升趋势。对于恶性程度较高的去势抵抗前列腺癌(Castration-resistant prostate cancer, CRPC),尽管靶向雄激素受体(Androgen receptor, AR)信号通路的第二代抗雄激素药物(Second generation antiandrogens, SGAs)显著延长了患者总生存期,增加了无进展生存期,然而原发性耐药及获得性耐药等问题严重制约着SGAs药物的临床应用。AR扩增、AR点突变和AR截短体生成是导致SGAs耐药的主要原因,开发能够克服现有耐药问题的新一代抗雄激素药物具有重要意义[2]。
该研究通过计算机辅助药物设计结合生物活性评价,在750万个化合物分子中寻找到了选择性AR降解小分子化合物Z15,该分子能够克服AR扩增、AR点突变及AR截短体造成的CRPC耐药问题,研究团队同时阐明了Z15的作用机制。

AR信号通路在前列腺癌的发生发展中发挥着关键作用。为了开发新一代AR靶向抗雄激素药物,作者根据既往报道的多种AR靶向活性分子的化学结构构建了药效团模型,同时利用分子动力学模拟方法构建了拮抗态AR蛋白结构。随后利用分子对接软件筛选了约750万个化合物分子,根据对接结果最终确定了80个分子,利用双荧光素酶报告系统评价其AR转录抑制活性,结果发现化合物Z15具有很强的AR抑制活性。
相比目前已上市的SGAs药物,Z15具有新颖的化学结构(图1A)。接下来,作者利用构建的多种双荧光素酶报告系统分别评价了Z15对于不同类型的AR转录活性的影响。结果显示,Z15能够剂量依赖性抑制外源和内源野生型AR的转录活性(图1B-C)。值得注意的是,Z15在两种SGAs耐药细胞系(AR过表达的VCaP细胞系与表达AR截短体ARV7的22Rv1细胞系)中仍可以抑制AR转录活性(图1D-E);同时Z15对于点突变的AR-T877A和AR-F876L也显示出剂量依赖性抑制活性(图1H-I),表明Z15能够克服AR过表达与ARV7生成造成的SGAs耐药问题。进一步检测结果表明,Z15的AR转录抑制活性与SGAs药物恩杂鲁胺相当(图1F)。虽然Z15具有很强的AR转录抑制活性,但对于同为核受体家族成员的糖皮质激素受体、盐皮质激素受体与孕激素受体,Z15几乎无抑制活性,表明该化合物对于AR的抑制具有选择性。
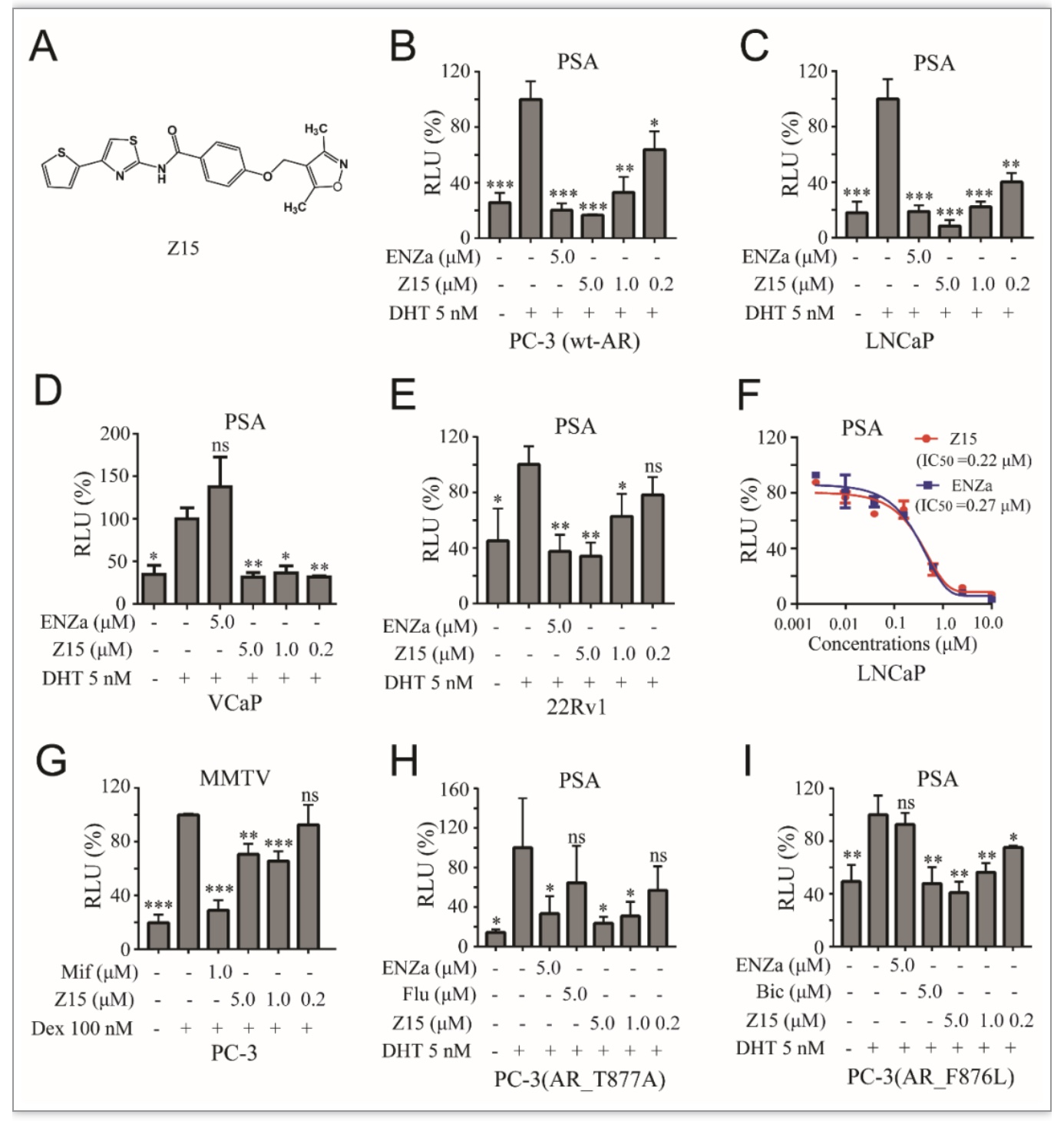
图1 Z15选择性抑制AR及其耐药变种的转录活性
(图源:Wu M, et al., eLife, 2023)
接下来,作者分析了Z15对于AR信号通路主要基因的mRNA与蛋白表达水平的影响,发现Z15可以显著抑制雄激素激活的AR下游靶基因表达水平。有趣的是,与恩杂鲁胺相比,Z15可以下调AR蛋白水平,但不影响其mRNA水平。进一步研究显示,Z15可以通过蛋白酶体途径促进AR泛素化降解。利用蛋白质组学检测方法,作者证实Z15促进前列腺癌细胞中蛋白降解的种类与另一种AR靶向PROTAC药物ARV-110类似,表明两种给药策略具有相似的AR蛋白降解活性(图2A-D)。不过相比于ARV-110仅能降解全长AR,Z15可以促进AR截短体的降解,这是Z15的重要优势。
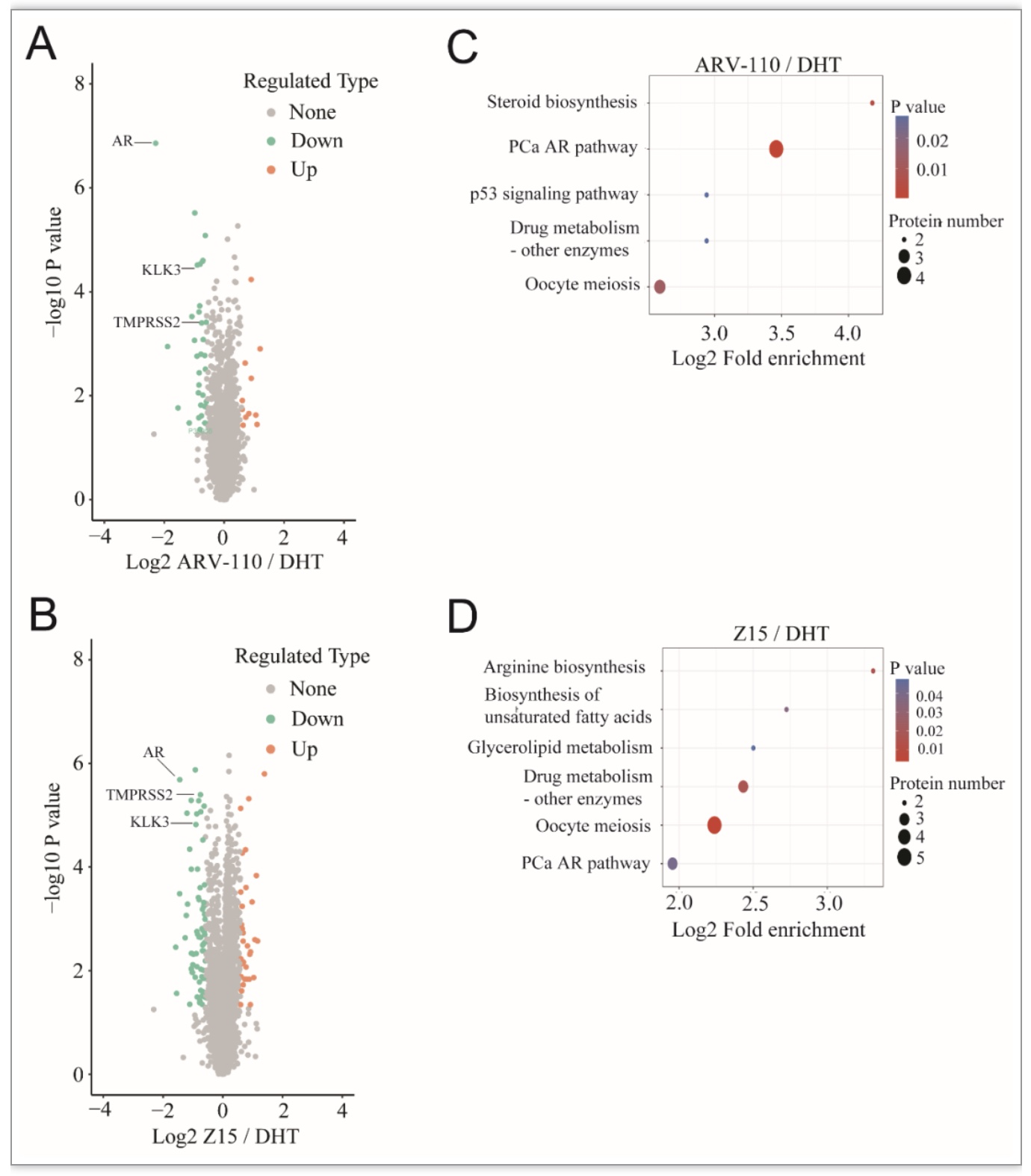
图2 Z15与ARV-110对前列腺癌细胞蛋白质组的影响对比
(图源:Wu M, et al., eLife, 2023)
为了探究Z15发挥AR降解活性的作用基础,作者首先利用放射性同位素标记的雄激素竞争结合实验,分析Z15是否与AR配体结合区(Ligand binding domain, LBD)结合,结果显示,Z15可与雄激素竞争结合于AR LBD区,结合活性略优于恩杂鲁胺(图3A)。生物膜层干涉实验同样证实了这种AR LBD-Z15蛋白小分子相互作用(图3B)。鉴于Z15能够抑制AR截短体的活性,作者推测Z15的作用位点可能不仅仅局限于LBD区。AF1区是AR蛋白N端结构域的重要活性位点,AR截短体保留了AF1区。因此,作者利用表面等离子共振实验分析了Z15与AR-AF1的结合活性,结果显示两者具有较强的亲和力(图3C),而恩杂鲁胺与AR-AF1没有结合活性,这解释了为何Z15能够抑制AR截短体活性。
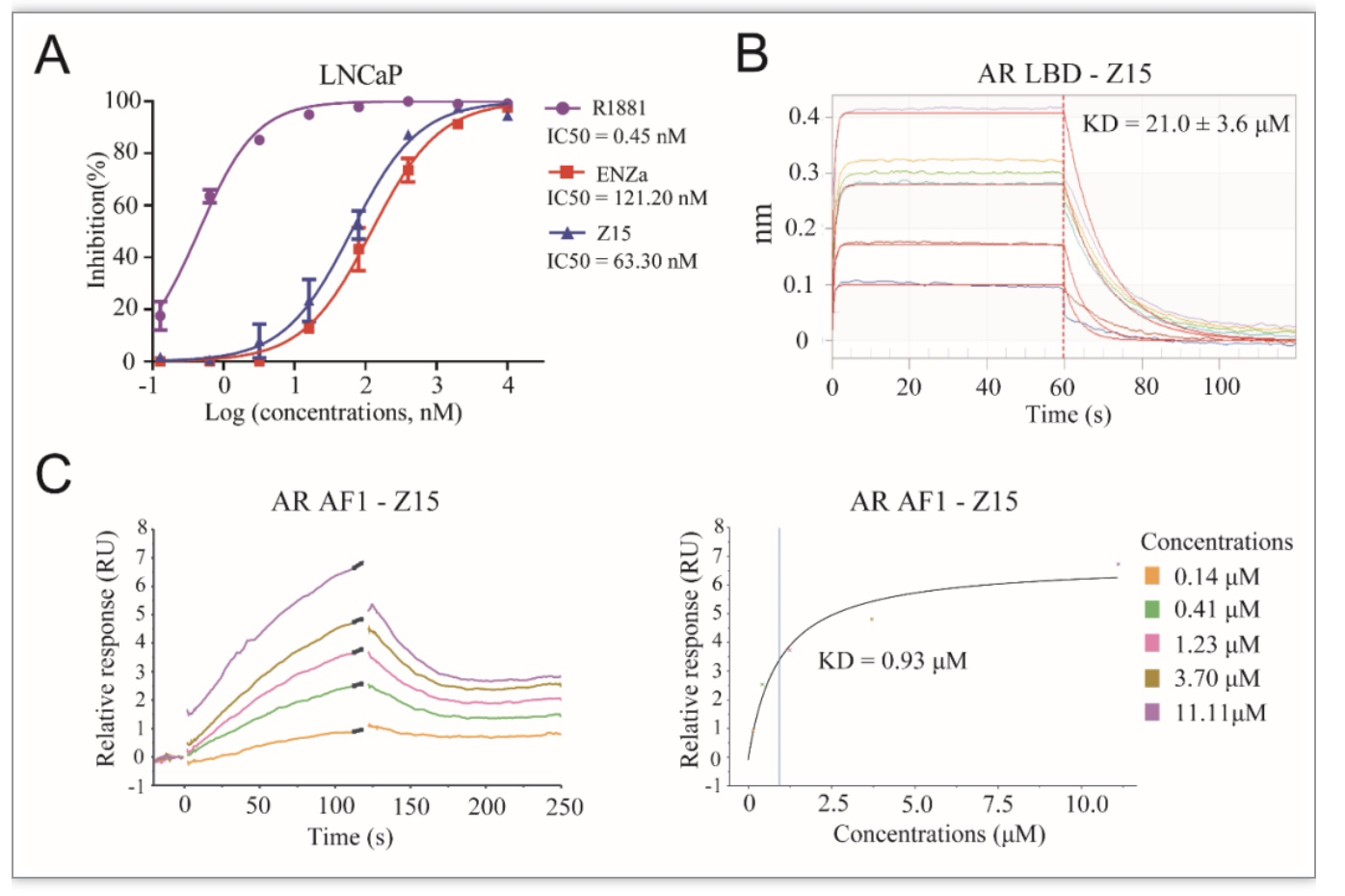
图3 Z15与AR蛋白结合活性分析
(图源:Wu M, et al., eLife, 2023)
随后,作者分析了Z15对不同类型CRPC细胞增殖活性的影响。结果显示,Z15对AR过表达的VCaP细胞与表达ARV7的22Rv1细胞均具有较强增殖抑制活性(图4A-B)。而对AR阴性的CRPC细胞系DU145与PC-3,Z15活性较差(图4A),进一步表明Z15是通过选择性抑制AR通路发挥抗CRPC活性。Z15对CRPC病人来源的3D培养细胞同样具有很强抑制活性,提示该化合物对CRPC病人可能具有治疗作用(图4C)。值得注意的是,Z15促进CRPC细胞凋亡活性优于同浓度下的对照药物ARV-110(图4D-E)。
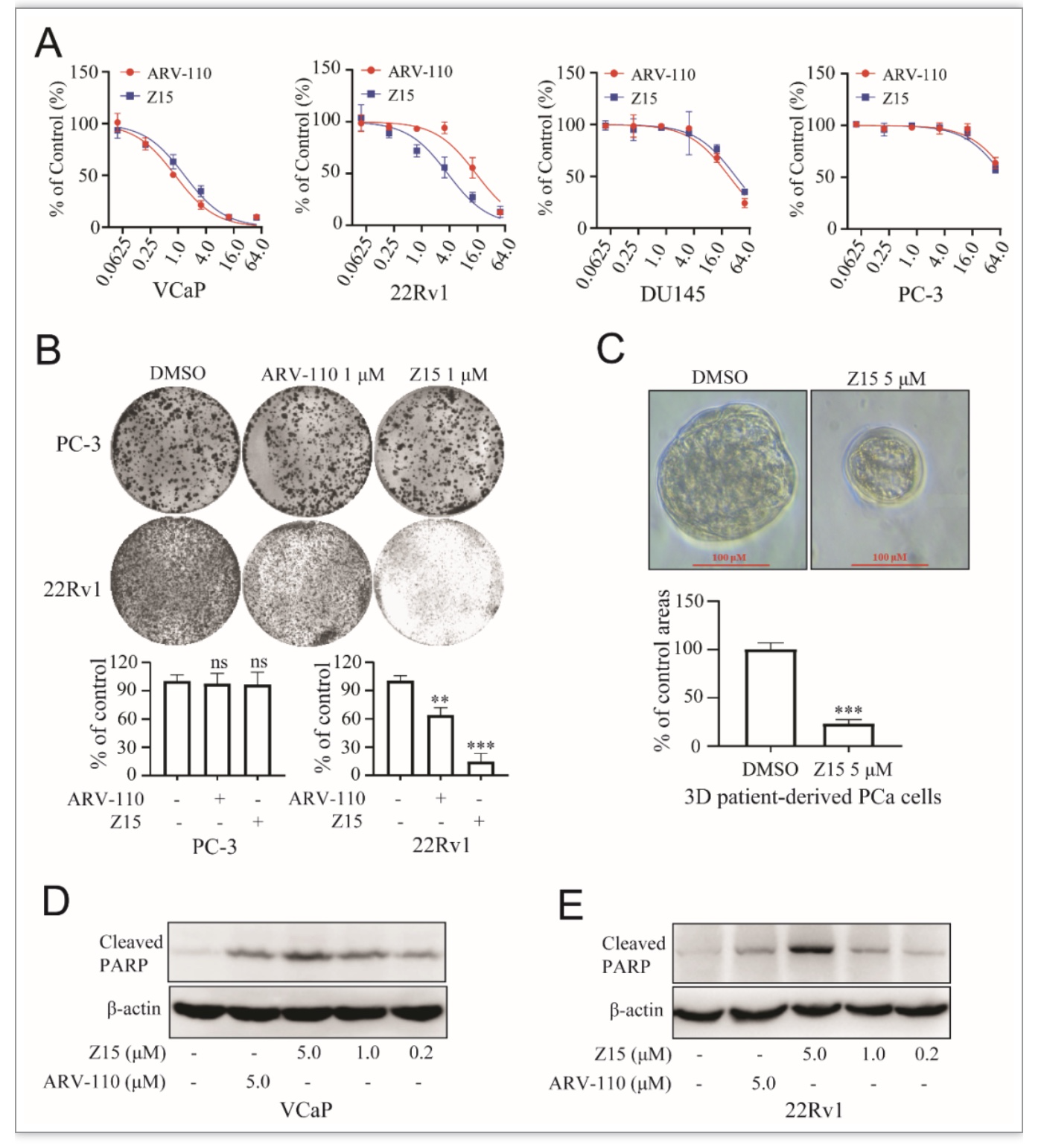
图4 Z15抑制CRPC细胞体外活性
(图源:Wu M, et al., eLife, 2023)
为了分析Z15的体内抗CRPC活性,作者利用恩杂鲁胺耐药的22Rv1细胞构建了异种移植肿瘤模型,通过灌胃给药方式给予模型小鼠不同浓度的Z15治疗,观察小鼠肿瘤生长情况。结果表明,Z15具有良好的体内抗CRPC肿瘤活性,且对小鼠体重几乎无影响(图5A-E)。初步表明该化合物是一种安全有效的口服选择性雄激素受体降解剂。
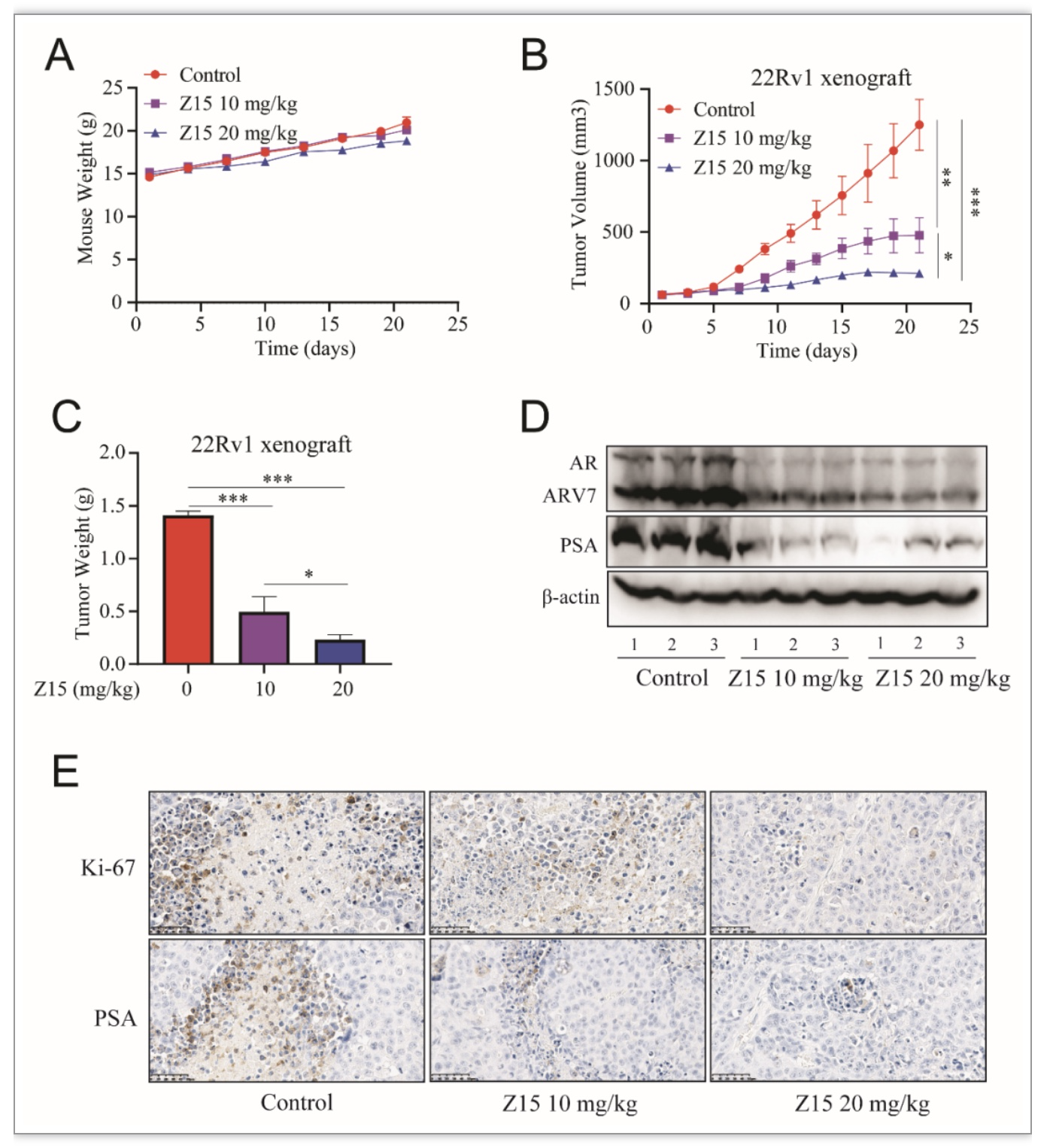
图5 Z15抑制CRPC细胞体内活性
(图源:Wu M, et al., eLife, 2023)
最后,作者在ZINC与SciFinder化合物库中搜索了Z15的化学结构类似物,最终选择7个与Z15结构相似度大于80%的化合物,分析其AR抑制活性。结果显示,有6个化合物具有良好的AR转录抑制活性与AR降解活性,部分化合物活性优于Z15(图6A-C)。该部分结果提示Z15可作为一种先导物,对其进行结构优化与构效关系研究将会有助于开发活性更优、类药性更好的选择性雄激素受体降解剂(SARD)。
图6 Z15类似物同样具有AR降解活性
(图源:Wu M, et al., eLife, 2023)
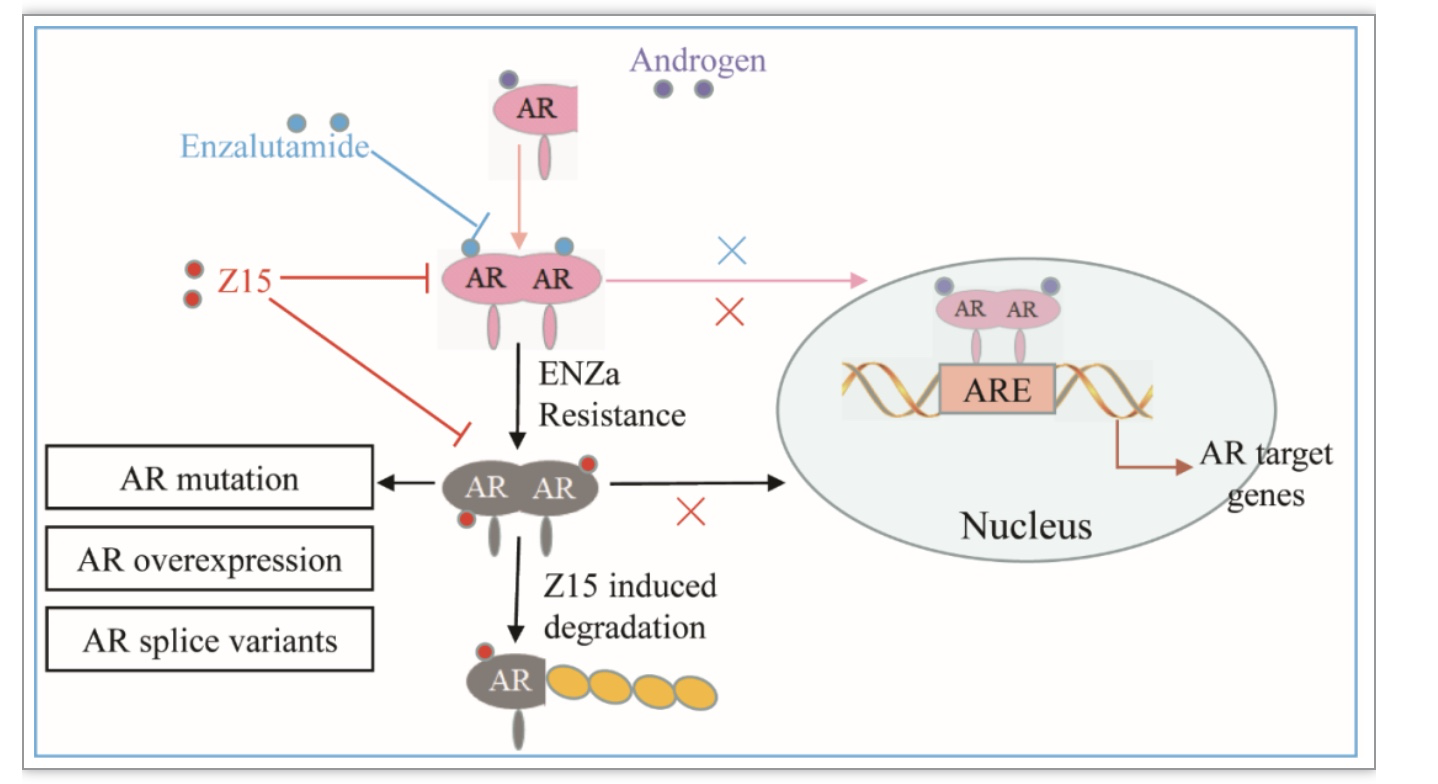
图7 Z15通过促进AR降解克服SGAs耐药
(图源:Wu M, et al., eLife, 2023)

