骨肉瘤(osteosarcoma, OS)是儿童和青少年最常见的原发恶性骨肿瘤(占35%),致残和致死率高,严重威胁青少年健康和社会稳定[1]。虽然自上世纪七十年代引入新辅助化疗(阿霉素、顺铂、大剂量甲氨蝶呤和/或异环磷酰胺联合化疗),结合肿瘤的广泛切除,患者的五年生存率由不足20%提高到50-60%,但肺转移仍是患者死亡的主要原因,是影响患者生存率进一步提高的“瓶颈”,就诊时出现肺转移或化疗后出现肺转移的患者的五年生存率仍低于20%[2]。化疗耐药是导致肺转移的重要机制,也是造成近40年来骨肉瘤治疗处于“平台期”的一个重要原因!因此,探索OS化疗耐药的潜在机制至关重要,克服化疗耐药及发现新的有效药物成为解决骨肉瘤肺转移这一临床难题的关键!

作者十余年来一直专注骨肉瘤肺转移机制的研究,在Cancer杂志(2007年)上首次报道了癌基因COPS3扩增与肺转移显著相关[3],之后陆续在Cancer Gene Ther(2011)和J Exp Clin Cancer Res(2018)发表文章,证实了COPS3高表达促进骨肉瘤细胞肺转移[4,5]。肺转移的发生与骨肉瘤细胞对化疗抵抗密切相关,因此在本课题中作者先是检测了COPS3在化疗敏感和化疗耐药标本中的表达,发现COPS3在化疗耐药标本中高表达。后续通过构建敲减或过表达的细胞模型证实抑制COPS3表达增强了骨肉瘤细胞对顺铂的敏感性,这一结论同样在动物实验得到验证(图1),由此表明COPS3的高表达介导了骨肉瘤细胞对顺铂的抵抗。
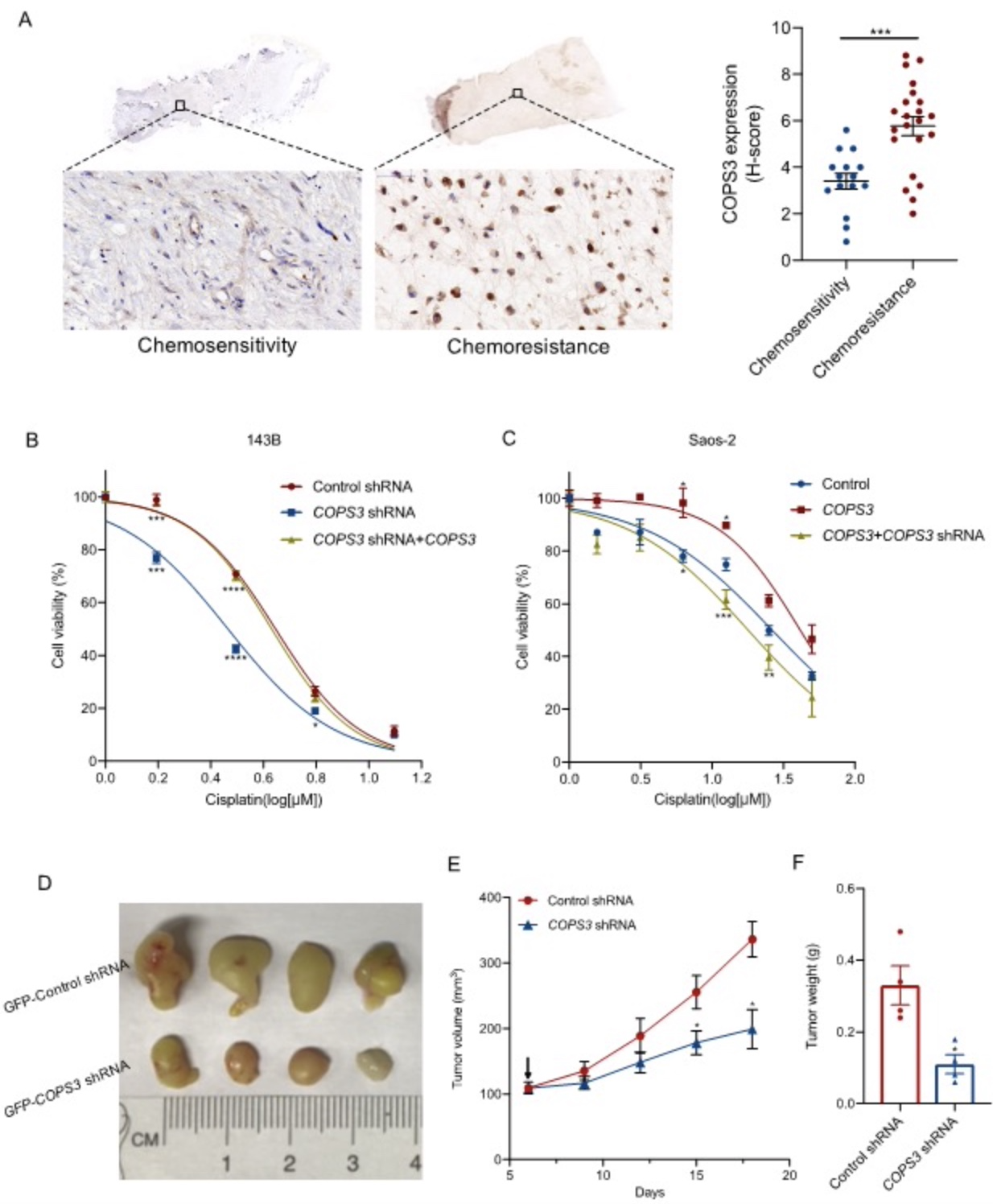
图1 COPS3介导骨肉瘤细胞对顺铂的抵抗
(图源:Niu JF, et al., Autophagy, 2022)
自噬作为肿瘤细胞面对外来压力的一种生存机制,被报道在多种肿瘤中介导化疗耐药的产生[6,7]。作者在前期研究中初步证明了COPS3与自噬的调节关系[5],因此作者推测自噬可能参与了COPS3介导的顺铂耐药。基于此,作者通过多种研究手段检测了有无顺铂处理下COPS3高表达和低表达时骨肉瘤细胞的自噬活性。作者发现在无顺铂处理下,骨肉瘤细胞有一种基于COPS3表达的低水平的自噬活性,因为抑制COPS3表达后基础自噬受到抑制。在顺铂治疗后,COPS3介导的基础自噬被放大,由此说明骨肉瘤细胞经顺铂处理后自噬被激活,而这种自噬水平是依赖于COPS3高表达的(图2)。
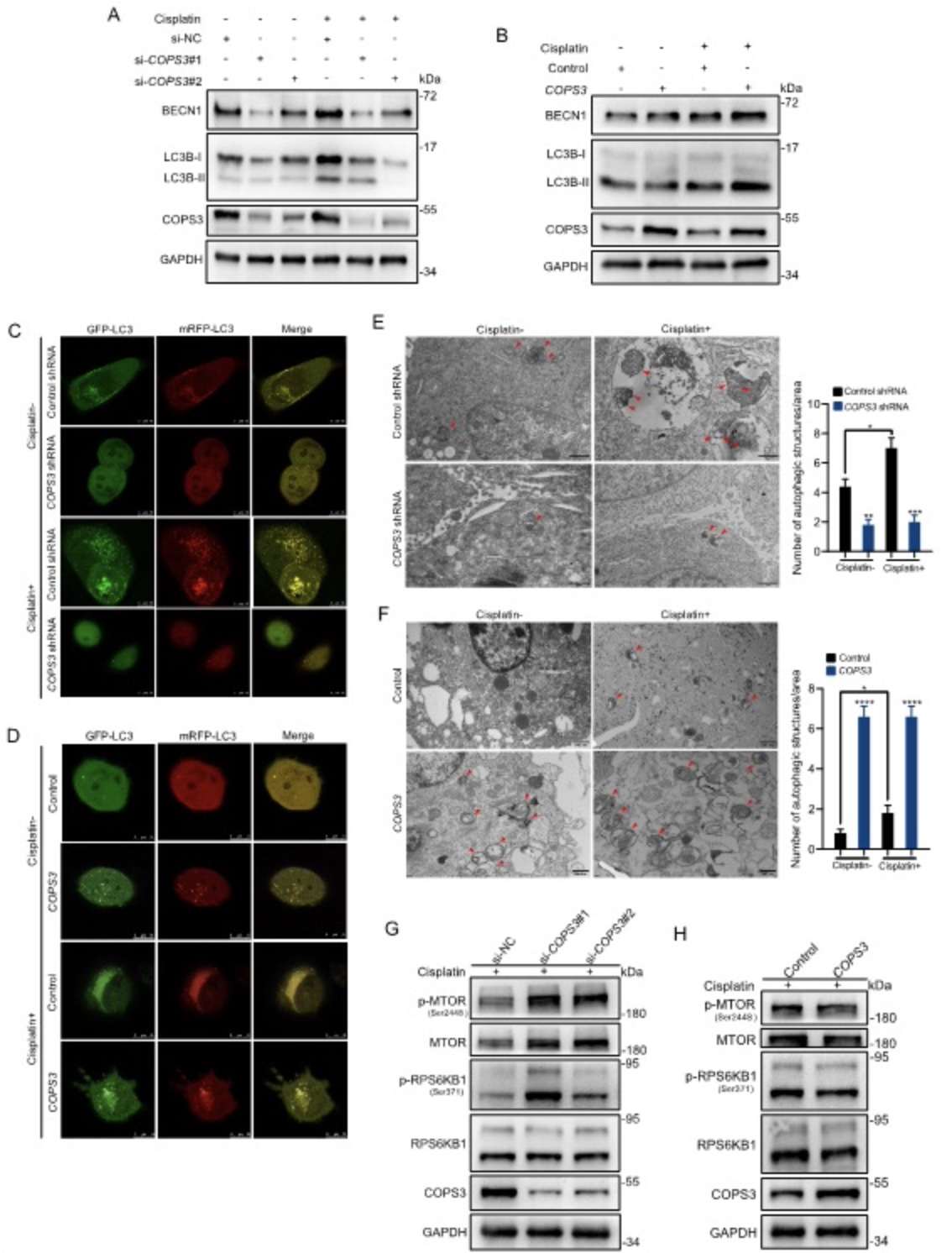
图2 依赖于COPS3的基础自噬活性在顺铂处理下被放大
(图源:Niu JF, et al., Autophagy, 2022)
随后,作者检测了自噬标志分子LC3和RAB7在化疗敏感和化疗耐药标本中的表达,发现自噬水平在化疗耐药标本中增强。相关性分析表明在化疗耐药标本中COPS3分别与LC3和RAB7呈正相关关系,说明在有COPS3扩增的化疗耐药标本中自噬是被诱导的。作者随后在细胞和动物模型中证实抑制自噬能克服由过表达COPS3介导的顺铂耐药,以上数据表明COPS3通过激活自噬介导了骨肉瘤细胞对顺铂的耐药(图3)。
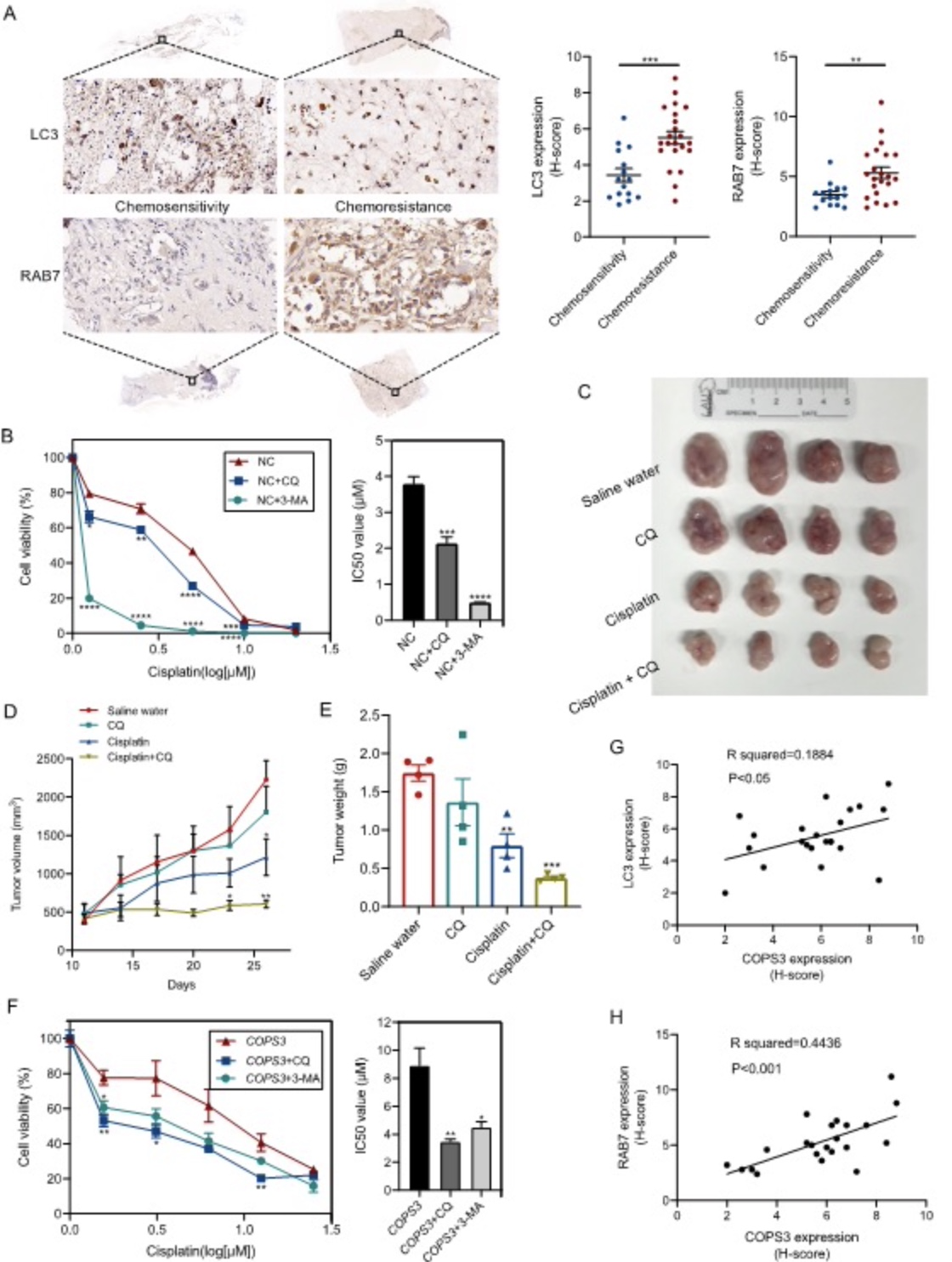
图3 COPS3通过激活自噬介导骨肉瘤细胞对顺铂的抵抗
(图源:Niu JF, et al., Autophagy, 2022)
机制研究上,作者通过转录组测序和细胞实验发现转录因子FOXO3的表达和转录活性受COPS3的调节,并进一步证明COPS3通过影响FOXO3的转录活性促进了靶基因LC3和RAB7的表达,进而促进了自噬体和自噬溶酶体的形成。除此之外,COPS3对MTOR通路的抑制也确保了自噬的快速起始。在后续的研究中,作者也发现FOXO3反过来参与了COPS3表达水平的调节。FOXO3一方面通过抑制泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)介导的COPS3降解,另一方面通过抑制SKP2介导的对COPS3的抑制共同维持了细胞中高COPS3表达水平。最终,高表达的COPS3通过激活细胞保护性自噬介导了骨肉瘤顺铂耐药(图4)。
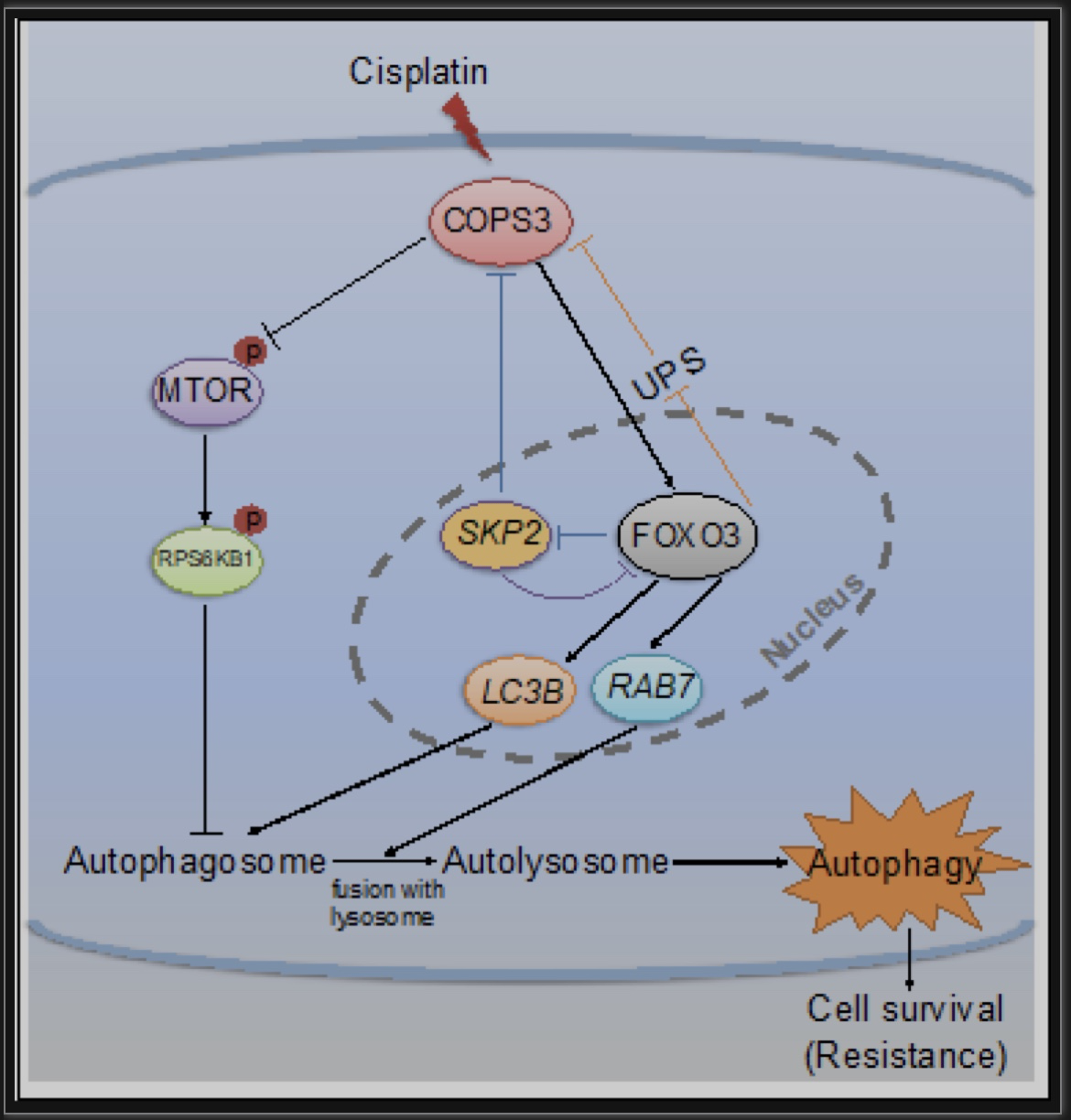
图4 COPS3在骨肉瘤顺铂耐药中诱导自噬的作用机制图
(图源:Niu JF, et al., Autophagy, 2022)

