m6A是多种人类肿瘤进展中一个重要的RNA甲基化,是指RNA中出现腺嘌呤。m6A修饰通过与不同的结合蛋白“阅读器”相互作用,控制修饰后的RNA的命运,如激活mRNA的翻译或降解,加速mRNA从细胞核核的输出[1,2](图1)。近年来,有研究发现,m6A调控的基因与各种癌症、神经系统疾病、心血管疾病、感染等免疫系统疾病等多种疾病密切相关[3, 4, 5, 6, 7]。m6A结合蛋白通常包含YT521-B同源(YTH)结构域,YTH蛋白是研究最深入的m6a结合蛋白,而大量研究发现YT521-B同源结构域家族蛋白1(YTHDF1)作为一种m6A结合蛋白,YTHDF1通过结合mRNA3‘-UTR区域的m6A修饰位点,招募真核启动因子eIF3家族成员,并直接启动G-cap独立翻译[8]。可以加速m6A修饰的mRNAs在细胞质中的翻译,并有助于癌症的进展和转移,在肿瘤发生中起着关键作用[9]。所以,明确YTHDF1在肿瘤发生和转移中的作用机制,有望找到新的诊断和治疗方法,并可作为临床诊断和预后评价的指标之一。
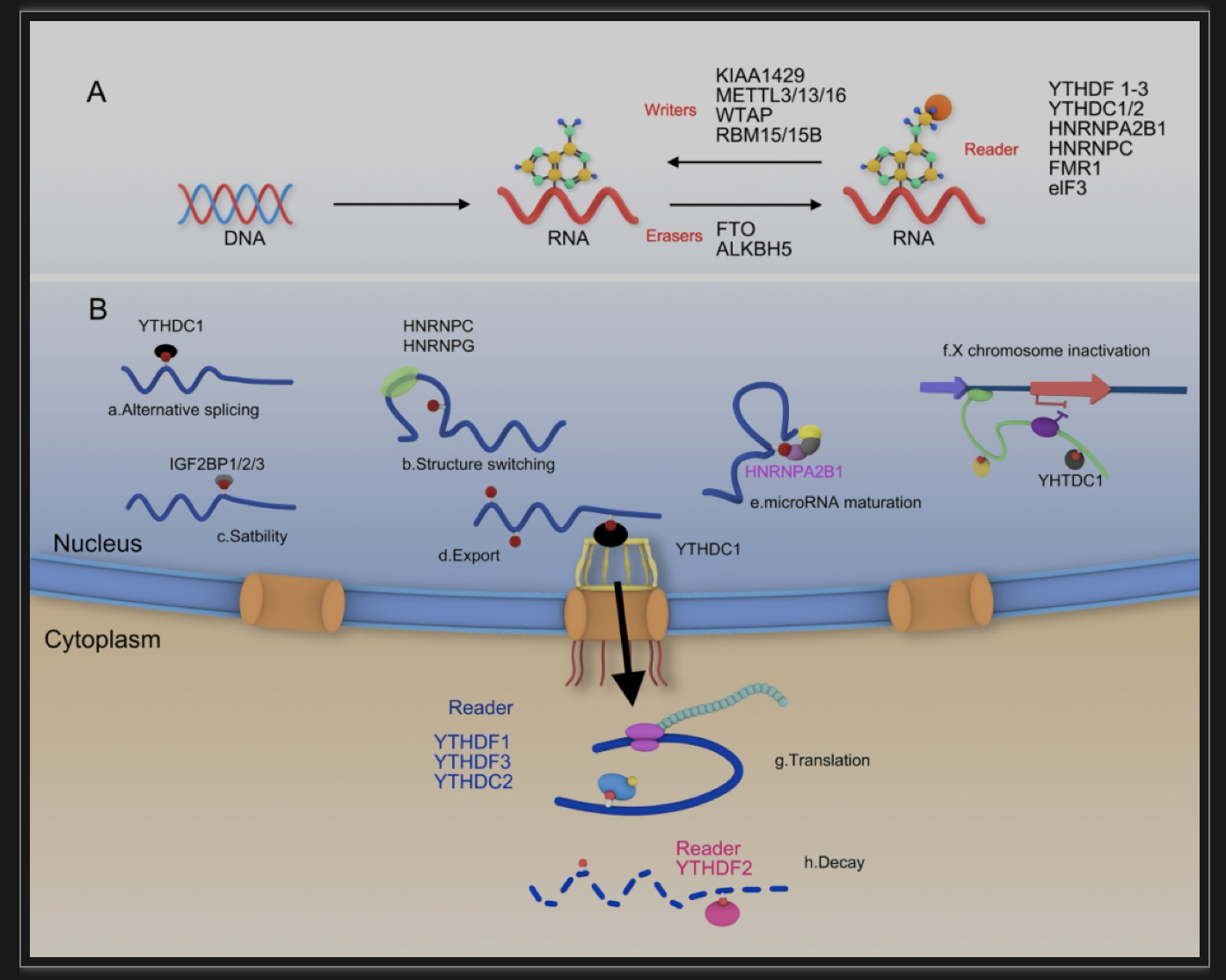
图1. m6A甲基化修饰。
(图源:Zhu YN, et al., Cell Death Discov,2023)
该研究回顾了YTHDF1在各种癌症中可能的诊断及预后价值,揭示了了YTHDF1是否可作为临床诊断或治疗的分子标记物,及其在肿瘤发生中的作用机制。

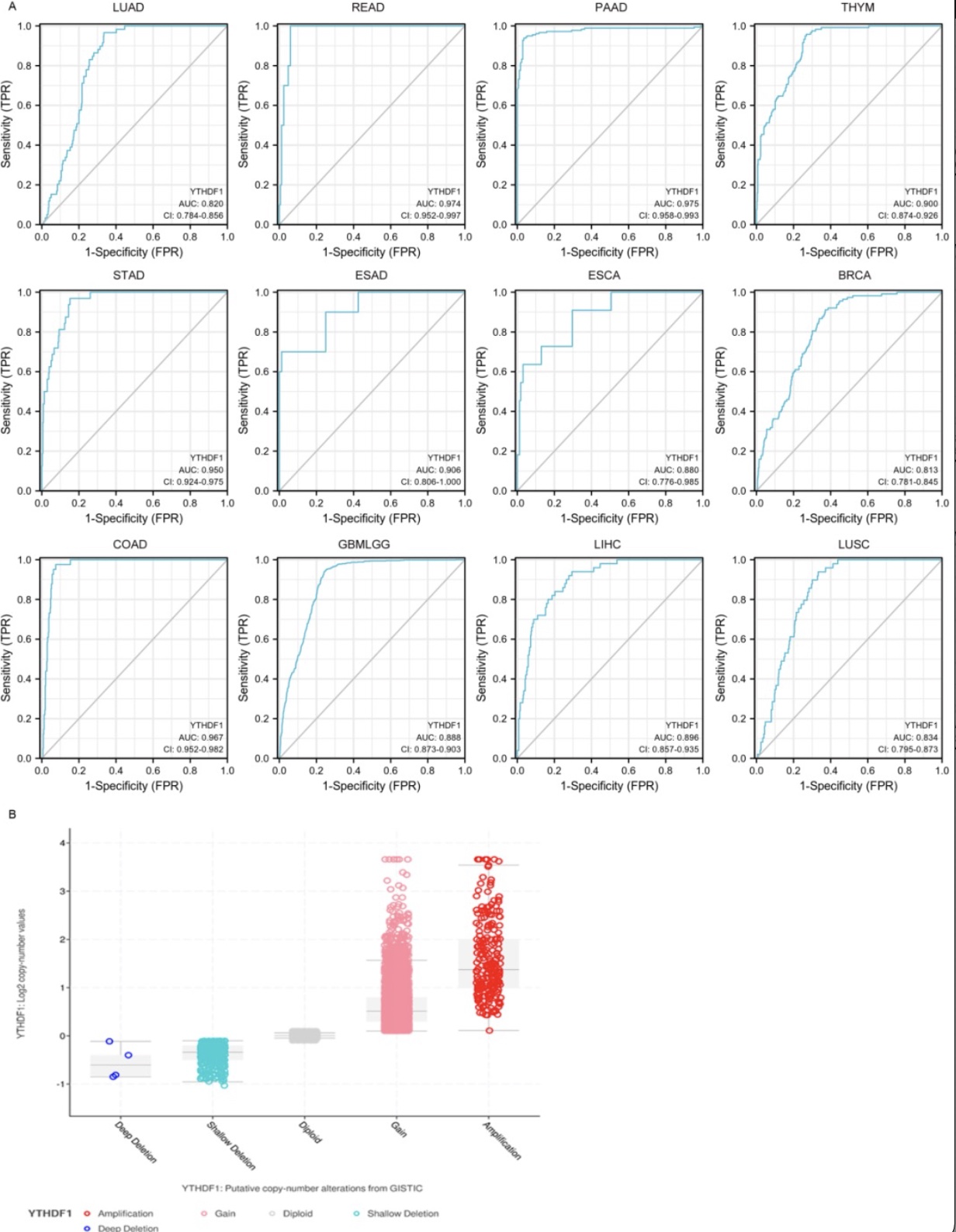
图2.YTHDF1在人类癌症中的诊断价值
(图源:Zhu YN, et al., Cell Death Discov, 2023)
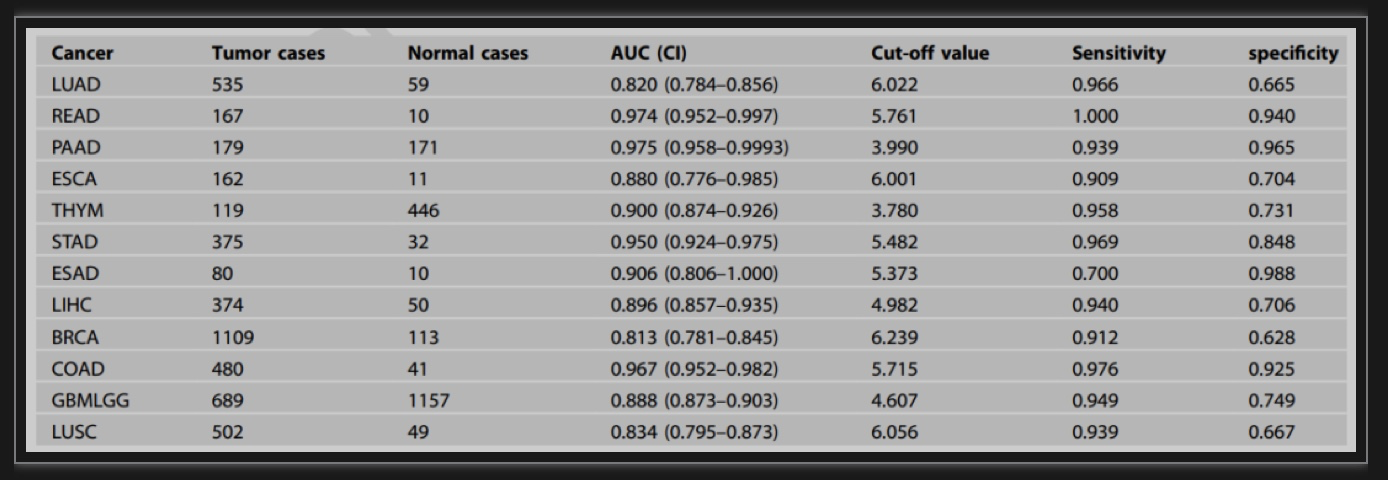
表1.YTHDF1在泛癌肿瘤中的诊断价值
(图源:Zhu YN, et al., Cell Death Discov, 2023)
有研究者的实验表明,敲低YTHDF1抑制了体外和体内的HCC[19]。高水平的YTHDF1与HCC的低生存率密切相关。YTHDF1与体外缺氧诱导的自噬密切相关,YTHDF1水平的升高与HCC患者的不良预后密切相关。HIF-1ɑ诱导的YTHDF1表达通过诱导ATG2A和ATG14依赖的方式参与自噬相关的HCC肿瘤发生[20]。YTHDF1作为致癌基因,通过激活PI3K/AKT/mTOR通路以及EMT,与HCC的分级相关[21]。YTHDF1促进了HCC的进展,并与HCC患者的预后相关。研究还发现YTHDF1的表达受到USF1和c-MYC的调控,它们以显著地加速FZD5以m6A依赖的方式进行的翻译,激活Wnt/β-catenin信号通路[22]。YTHDF1与病理分期呈正相关,YTHDF1敲低有助于HCC患者获得更好的生存[23]。因此,YTHDF1可能是一种新的癌症治疗和预后靶点。
YTHDF1的升高以m6A依赖的方式增加了细胞周期蛋白B1(cyclin B1)的mRNA,以促进KRAS/TP53共突变LUAD患者的肿瘤进展和不良预后[24]。YTHDF1被发现在体内外头颈部鳞状细胞癌(HNSCCs)的发展中调节铁代谢,与TRFC mRNA的3‘UTR和5’UTR相互作用,并以m6A的方式正向调控TFRC mRNA的翻译[25]。YTHDF1被证实在胃癌(GC)中高表达,通过促进USP14的翻译来促进胃癌的肿瘤进展和转移[26]。YTHDF1在肝内胆管癌(ICC)中过表达,通过以m6A依赖的方式增加EGFR的翻译,与ICC患者较短的生存期密切相关[27]。YTHDF1在梅克尔细胞癌中高表达,它通过促进翻译起始因子eIF3发挥致癌作用[28]。YTHDF1通过增加TRIM44 mRNA的翻译来促进PCa的进展[29]。YTHDF1在宫颈癌中过表达,YTHDF1以m6A依赖的方式调控RANBP2的翻译[12],YTHDF1通过m6A修饰增加HK2的稳定性,促进宫颈癌进展和Warburg效应[30]。
YTHDF1在人类癌症中的调控机制已在以下几种肿瘤中得到证实。发现Hsa_circ_0007456(circ- MAP2K4)/miR-139-5p/YTHDF1轴是与YTHDF1相关的circRNA调控网络,促进HCC增殖[31]。在口腔鳞状细胞癌患者中,YTHDF1调控m6A修饰,促进了METTL3催化的c-Myc mRNA的稳定性[32],与其不良预后相关。YTHDF1在NSCLC细胞中表达高表达,miR-376c负调控YTHDF1的表达,抑制NSCLC细胞的恶性表型[33]。
化疗耐药性仍然是癌症临床治疗的主要障碍。YTHDF1通过METTL14依赖的方式调节其靶分子E2F8的mRNA稳定性和DNA损伤修复的机制以促进化疗耐药性[11]。YTHDF1在顺铂耐药的结直肠癌细胞中明显增加,该细胞在GLS1的3‘UTR处相互作用,促进GLS1的翻译,诱导顺铂耐药[34]。YTHDF1敲低增强了对阿霉素、顺铂和奥拉帕尼的化学敏感性。
YTHDF1突变通常影响人类癌症基因的扩增,并与人类各种肿瘤发生有关。在近7%的胃癌患者中发现YTHDF1发生突变,YTHDF1以m6A依赖的方式增加了卷曲蛋白7(FZD7)的翻译,导致Wnt/β-catenin信号通路的过度激活[35]。YTHDF1突变通过调节p53的信号通路,有助于黑色素瘤的扩增[18]。在结肠癌(CRC)中YTHDF1的DNA拷贝数增加,YTHDF1可以诱导结直肠癌中ARHGEF2的翻译[14]。因此,YTHDF1作为m6A修饰的核心因子,在人类癌症发展中具有靶向和调控多个基因的全局作用。
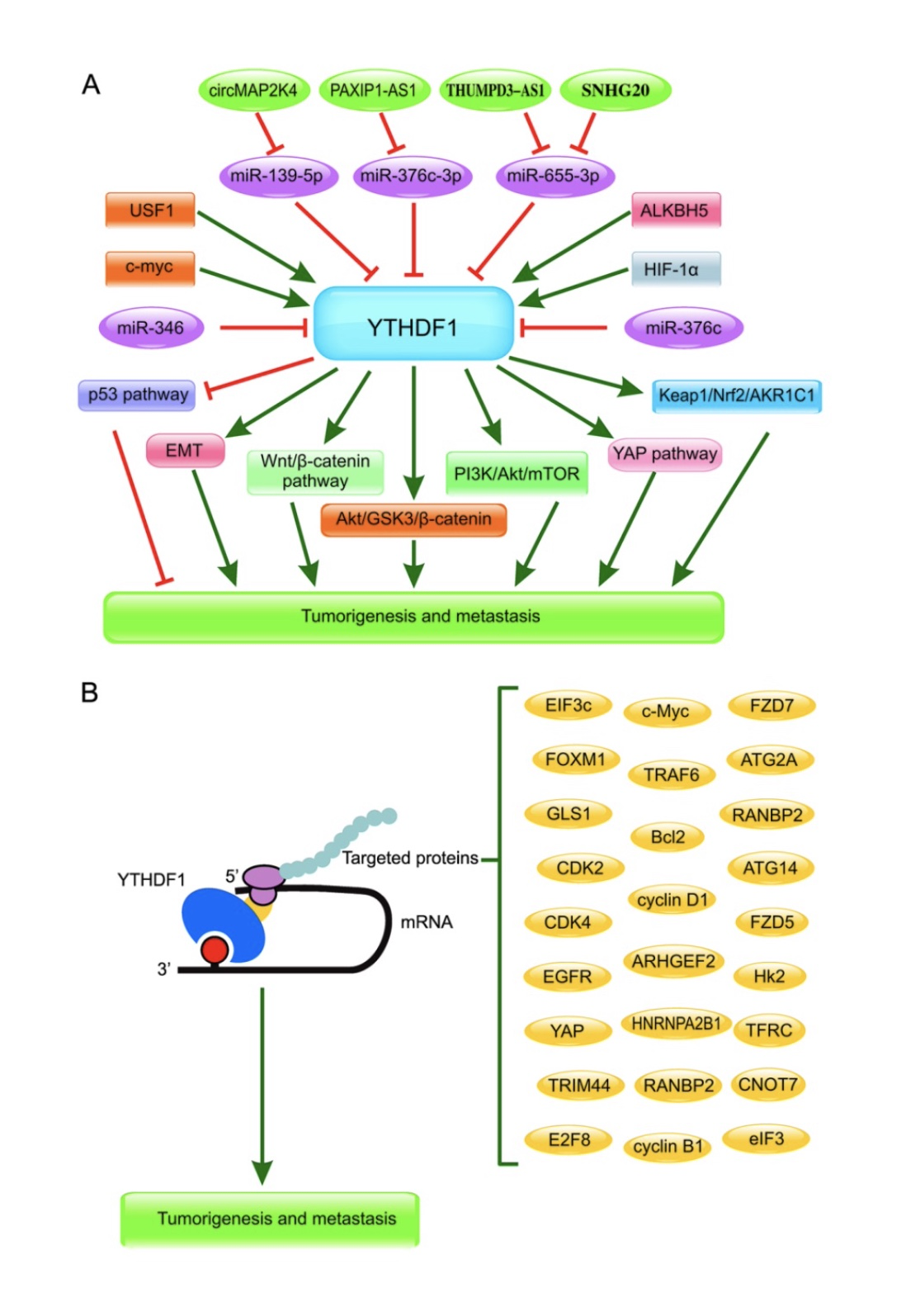
图3.YTHDF1在多种癌症的肿瘤发生和转移中的相关信号通路
(图源:Zhu YN, et al., Cell Death Discov, 2023)
肿瘤干细胞通常促进人类癌症的发生和转移。YTHDF1被发现可以调节肿瘤干细胞(CSC)样特征。例如,在结直肠癌中,下调YTHDF1可以通过抑制Wnt/β-catenin信号通路的活性来抑制肿瘤干细胞细胞的致瘤性[15]。有研究表明:YTHDF1激活了Wnt/β-catenin信号通路,该通路依赖于肿瘤进展过程中ISCs的维持[36]。YTHDF1在维持肠道干细胞(ISCs)中具有重要作用,而TEAD1也是m6A-YTHDF1维持肠道干性的功能靶点[37]。
据报道,CSCs对常用的化疗药物具有高度耐药性,并导致肿瘤的复发和转移。TRIM29增强了顺铂耐药卵巢癌细胞的CSC样特征。TRIM29可通过以m6A-YTHDF1依赖的方式表现出癌细胞的CSC样特征,从而促进肿瘤进展[38]。m6A还被发现可以调节干细胞的分化。ZNF839,JAK2均是YTHDF1的靶点[39,40]。
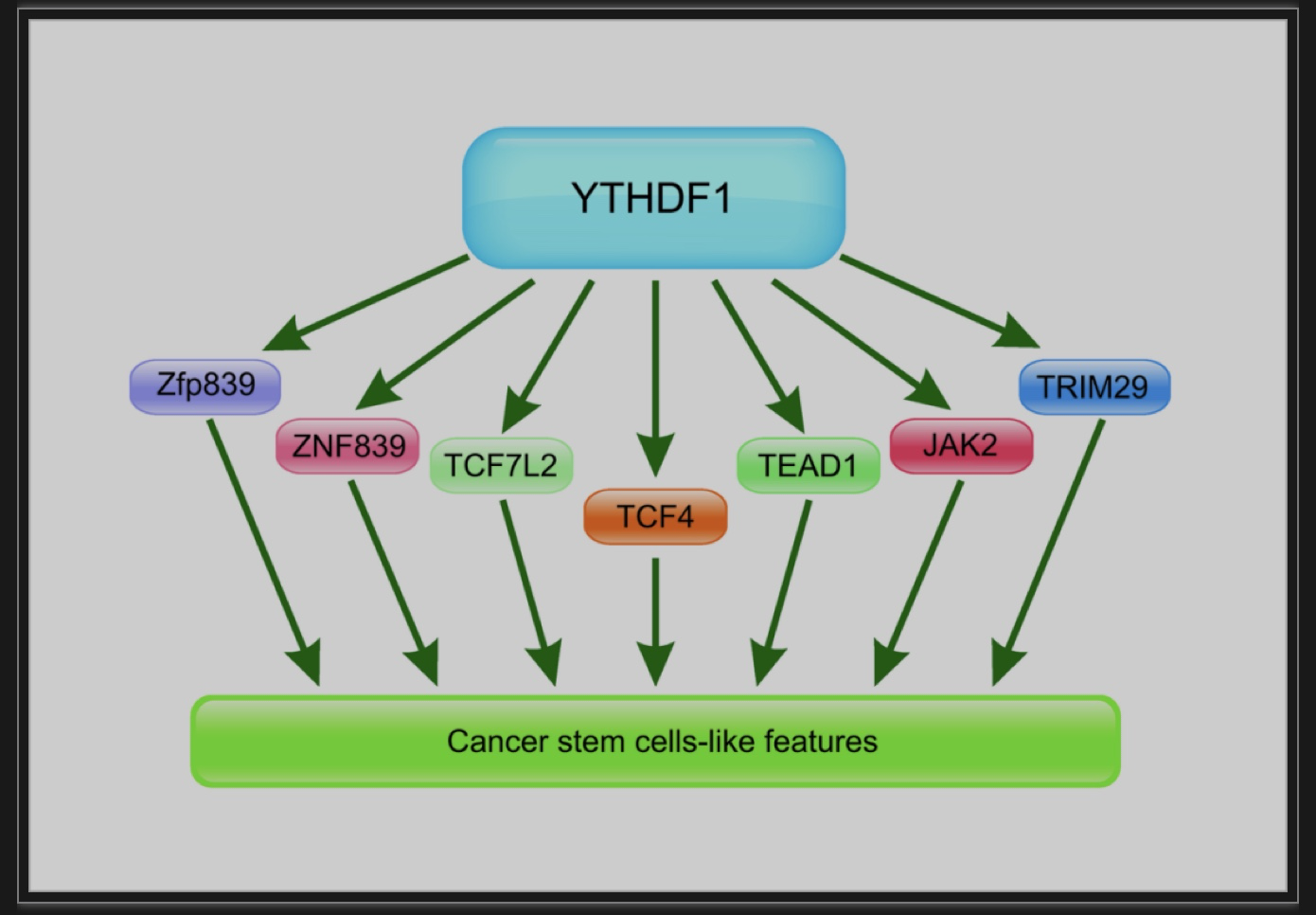
图4.YTHDF1调控的cscs样特性的关键蛋白
(图源:Zhu YN, et al., Cell Death Discov, 2023)
综上所述,YTHDF1通过促进m6A修饰的mRNA的翻译,促进了各种人类癌症的肿瘤发生和转移。它可以作为各种人类肿瘤的有效诊断和预后指标。到目前为止,还有以下几个问题需要继续探讨。
1. YTHDF1在细胞质中增强了目标mRNA的翻译,目前尚不清楚YTHDF1是否以及如何调控程序性细胞死亡,包括铁死亡、自噬性细胞死亡和细胞焦亡等。
2. YTHDF1缺陷小鼠的T细胞产生更多的干扰素-γ,表明宿主细胞中YTHDF1的敲除在早期促进了T细胞的活化,但其分子机制尚未明确。
3. YTHDF1具有较高的临床诊断准确性,需要构建和验证更有效的YTHDF1临床诊断模型。

