本世纪初短短20年内SARS-CoV、MERS-CoV、SARS-CoV-2三种冠状病毒接连出现,严重危害人类健康。特别是新冠疫情席卷全球,至今仍肆虐不止,是当前最为严重的“国际关注的公共卫生事件”。伴随新冠病毒的不断变异,当下流行的Omicron变异毒株传播能力更强,并呈现接种疫苗后的突破性感染,给疫情防控带来了极大挑战[1]。深入研究冠状病毒感染的调控机制,寻找新的干预靶点,开发广谱的冠状病毒抗病毒药物,不仅对限制SARS-CoV-2等已知冠状病毒的感染与传播具有重要意义,同时也为应对未来可能出现的其他新型冠状病毒的战略储备具有深远意义。
冠状病毒S蛋白负责识别并结合受体,启动膜融合和病毒入侵。胞外受体结合域(RBD)和介导细胞融合的HR1/2功能域是目前S蛋白靶向药物研发最为关注的功能域。S蛋白全长约1270aa,而胞内段仅约40aa,其中约20aa的半胱氨酸富集区(CRD)是S蛋白膜融合功能所必须的[2],如此短的结构域是如何调控膜融合行为和病毒感染能力,是否可作为冠状病毒广谱干预的靶点,目前尚不清楚。
研究人员前期研究发现新冠病毒S蛋白CRD结构域存在棕榈酰化修饰,其对S蛋白介导的膜融合和病毒感染至关重要[3],是否可作为冠状病毒广谱干预的靶点尚无报道。通过序列比对分析发现CRD结构域在冠状病毒属不同成员S蛋白羧基端均存在,Cys组成呈现出与病毒进化同步的特征(图1a),而冠状病毒科其他属及其他科病毒囊膜蛋白并未发现。为探究CRD是否为冠状病毒属家族的保守功能域,研究人员对不同人冠状病毒CRD结构域的Cys进行突变,细胞融合和假病毒感染实验证实CRD是S蛋白介导膜融合和病毒感染所必须的保守功能域(图1b)。进一步对SARS-CoV-2、SARS-CoV和MERS-CoV S蛋白CRD的系列突变分析,揭示了CRD功能调控的共有Cys组成规律:1+N rule,即均需要1个核心Cys及邻近约半数Cys共同维持CRD介导的膜融合和病毒感染(图1c)。
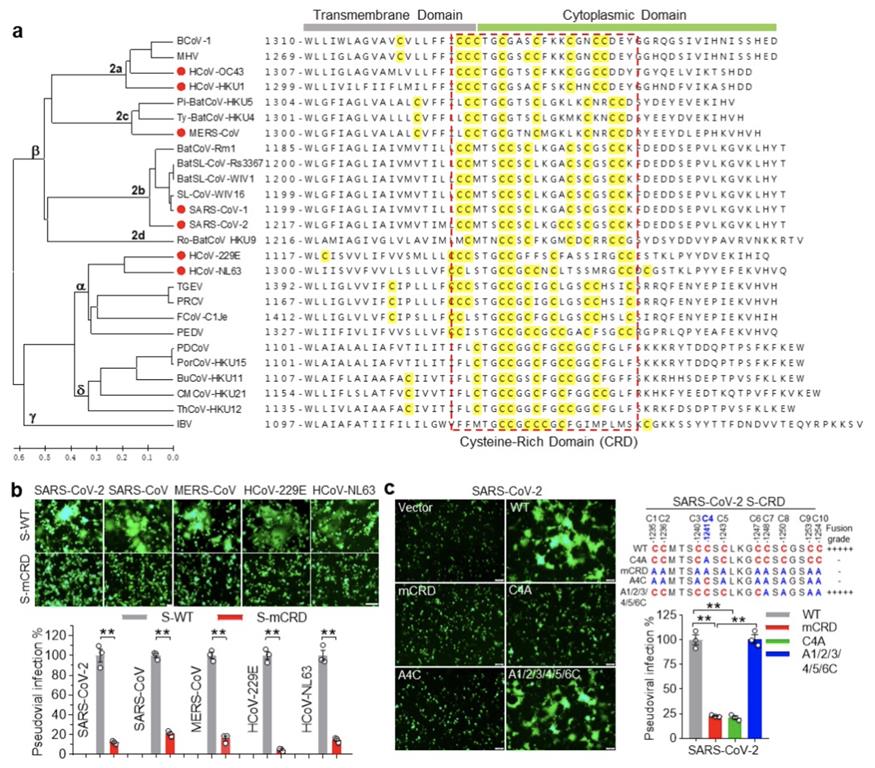
图1. S-CRD是冠状病毒共有功能域
(图源:Wu ZC, et al., Signal Transduct Target Ther, 2023)
为探究CRD是否可作为干预靶点,基于竞争性抑制思路和不同冠状病毒CRD组成特点,合成了针对不同病毒亚群的S-CRD穿膜多肽(图2a),通过细胞融合和假病毒模型实验发现S-CRD多肽可有效抑制人冠状病毒SARS-CoV-2、SARS-CoV、MERS-CoV、HCoV-229E、HCoV-NL63 S蛋白诱导的细胞融合和假病毒感染(图2b,c),并且S-CRD多肽表现出很好的交叉抗病毒作用。进一步在HCoV-229E感染模型中发现,S-CRD多肽可显著抑制病毒复制(图2d),IC50约为1.3μM,选择指数>45。为明确其是否同样抑制SARS-CoV-2感染,研究人员选取SARS-CoV-2 alpha和omicron毒株在Calu-3和ACE2-A549细胞上进行了测试,发现S-CRD多肽均能抑制两种毒株的复制(图2e),IC50为4.8μM,选择指数>12.5,从而证实CRD功能域是抗冠状病毒的全新靶点,S-CRD多肽是一种有效的广谱抗冠状病毒干预策略。
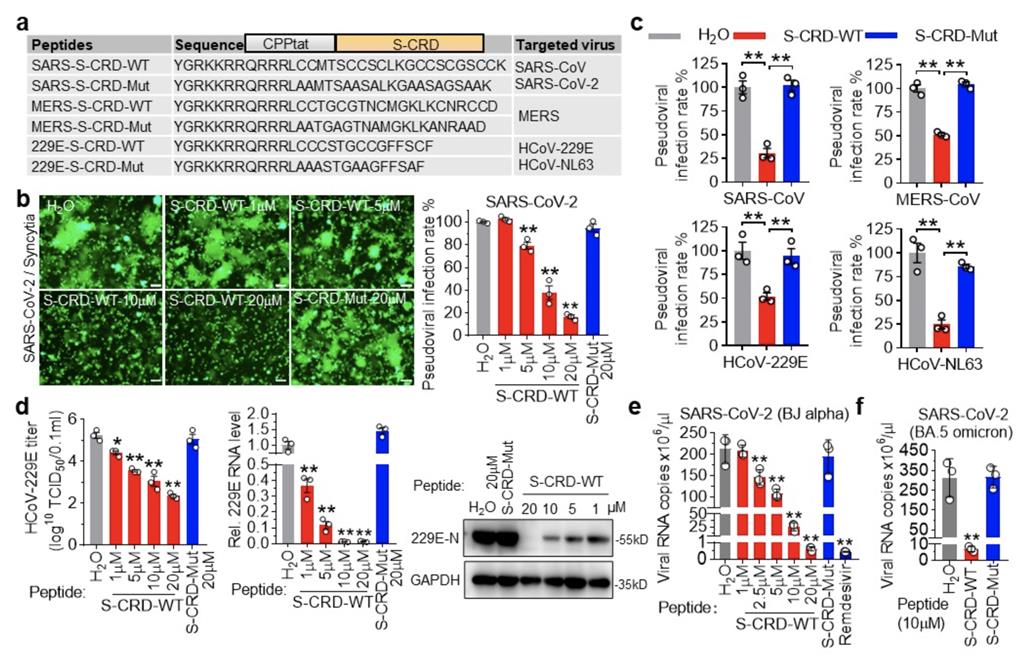
图2. S-CRD是广谱冠状病毒的潜在干预靶点
(图源:Wu ZC, et al., Signal Transduct Target Ther, 2023)
细胞骨架重塑在膜融合过程中发挥重要作用,CRD结构域位于S蛋白胞内侧,研究人员推测CRD有可能通过细胞骨架介导细胞融合,细胞松弛素B(微丝骨架抑制剂)处理也发现不同人冠状病毒S蛋白诱导的细胞融合被阻断(图3a)。通过免疫共沉淀和质谱分析发现S蛋白通过CRD结构域与参与骨架调节的Ezrin蛋白相互作用,敲低Ezrin导致S蛋白诱导细胞融合的能力显著降低(图3b-d)。S-CRD多肽可结合Ezrin并竞争性抑制S蛋白与Ezrin的相互作用,从而发挥抑制S蛋白介导膜融合的生物学行为(图3e,f)。

图3 S-CRD多肽阻断S蛋白与Ezrin的相互作用
(图源:Wu ZC, et al., Signal Transduct Target Ther, 2023)

