MMP全称为Matrix Metalloproteinases,基质金属蛋白酶。MMPs最初被认为是作用于细胞外基质(ECM)的一组蛋白酶,然而之后许多研究发现它的底物更多是非细胞外基质蛋白,这部分占比达到了69%。由于作用底物的多样性,MMPs参与了许多与自身稳定相关的功能,例如组织修复、免疫及病理过程,包括肿瘤、纤维化和感染。
结构与分类
MMP的结构主要有三个结构域,即前肽(Propeptide)、催化结构域(Catalytic domain)以及血红素结合蛋白结构域(Hemopexin domain),如下图所示:
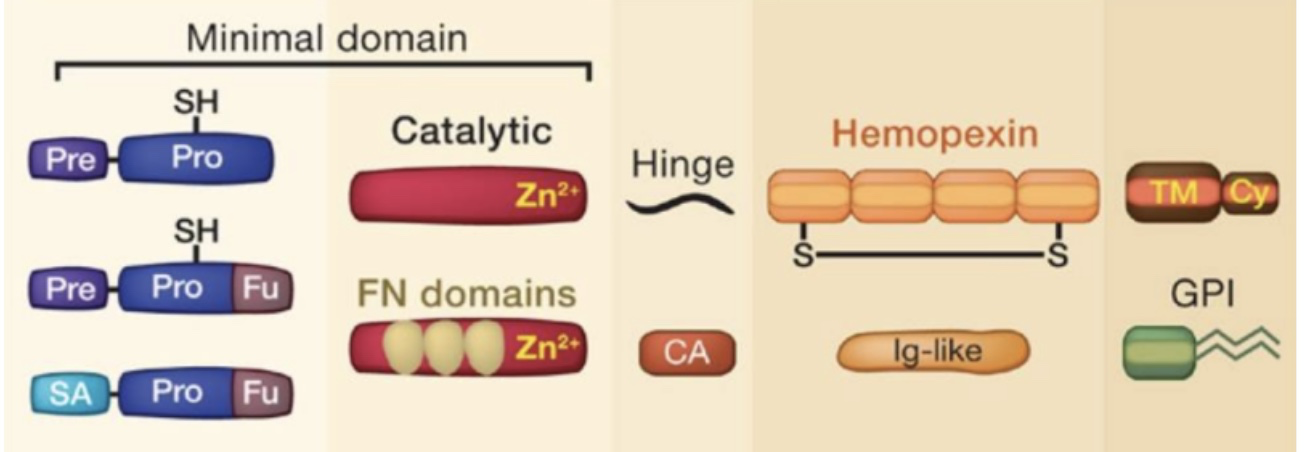
图1 MMP的结构域
MMP又可以根据结构域的差异和底物特异性进行细分,如下图所示。研究比较多的MMP2和MMP9之前被称为明胶酶A和B,因为它们能够裂解变性的胶原蛋白或明胶。

图2 MMP的分类
酶活
MMP是一种蛋白酶,那我们必须得提提它的酶活。MMP首先在体内合成酶原前体,并不具有酶活。因为前肽结构域内的半胱氨酸残基与催化域内的锌离子形成了络合物,从而防止酶活性。只有打开这个半胱氨酸开关,才能释放酶活性位点,使其和底物相互作用。
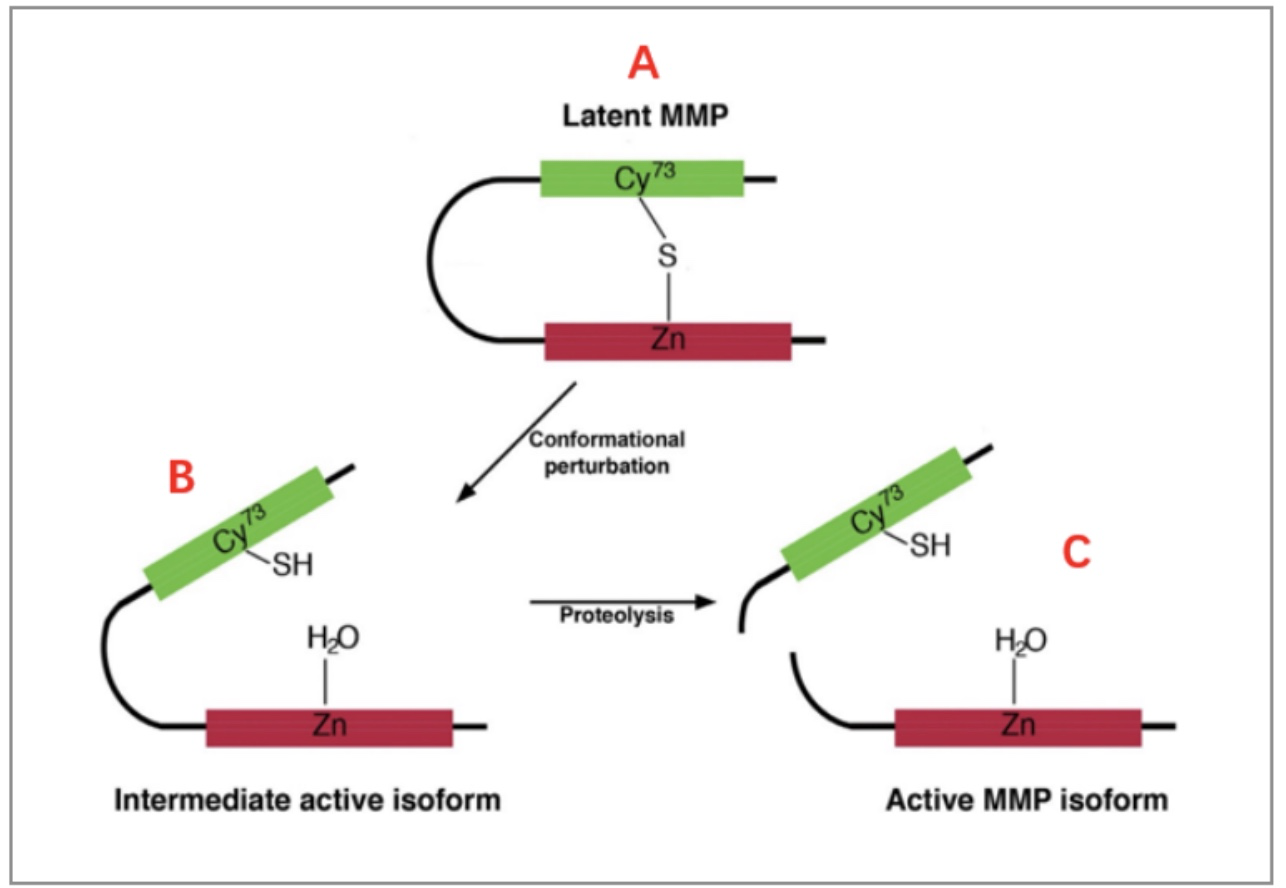
图3 MMP激活过程
上图中B亚型前肽没有完全去除,仍然连接在一起,也具有部分催化活性。C是前肽完全去除,具有最大的催化活性,也就是我们研究最多的活性MMP。
检测方法
因为MMP亚型较多,所以我们在检测时一定要考虑清楚自己想要检测的哪部分,哪部分才是和自己课题最关系密切的。因为很多MMP蛋白的直接测量不会区分活性酶和非活性酶。
不同的检测方法所观察的亚型是不同的:
❖
IHC:可以观察MMP的表达量和表达位置,但是无法区分是Latent MMP还是active MMP。
❖
底物(明胶)酶谱法:检测MMP活性常用的实验方法,可以清楚观察到有活性的MMP和proMMP。有一个问题是,TIMP可能在实验过程中与MMP解离,导致有活性的MMP比样本实际要多。
❖
ELISA:检测到的主要是active MMP。
❖
WB:使用的抗体可以识别图3的3种亚型,并且可以通过分子量来区别。缺点和酶谱法类似。
WB作为MMP主流的检测方法之一,需要注意什么呢?
01
样本表达量
大多数MMPs不是组成型表达,就是本底表达水平是比较低的,极少被储存。大多数细胞需要被激活才能表达MMPs,而且新产生的MMPs以酶原无活性形式存在。所以我们在选择研究对象时一定要充分考虑表达量,可以通过相关数据库或者参考文献以及预实验的结果,来确定样本中的表达量。
有小伙伴说,MMP在癌症中高表达,那我选择一种做不就行了?确实,MMP在很多癌症中是高表达的,而且作为预后观测的一个重要指标,但是并不是每种癌症或者癌细胞系都是高表达的。下图是HPA中各种癌症的表达量,差异还是非常大的。
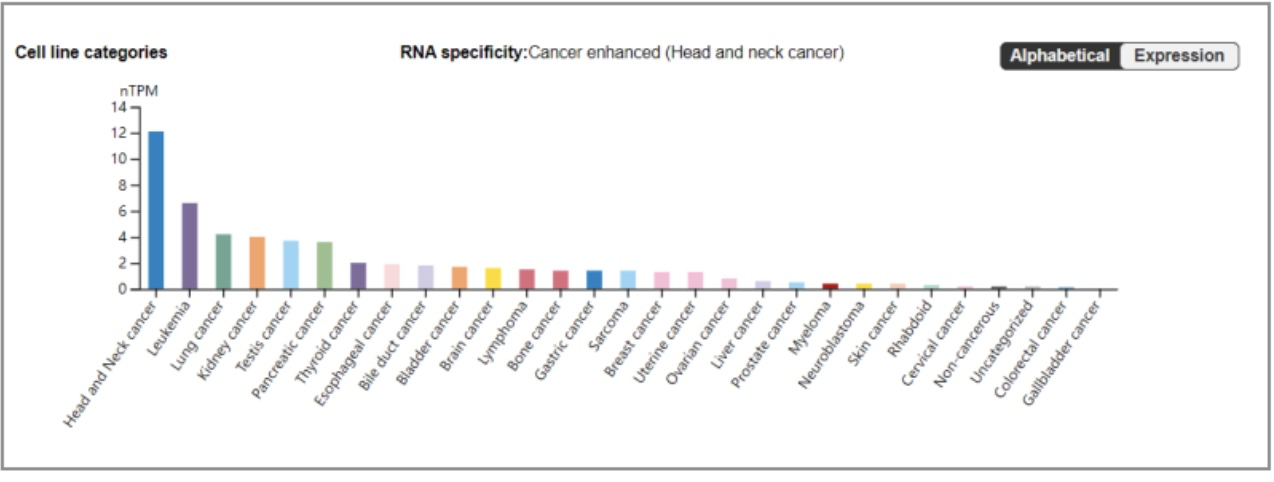
图4 MMP9在癌症中表达情况
02
表达位置
MMP会分泌至细胞外,很多小伙伴应该都清楚,所以在做细胞样本时需要收集培养基进行检测。而且很多时候光收集培养基还不够,因为浓度太低也不容易检测,还需要进一步浓缩培养基。
如何浓缩呢?下图CST厂家在检测MMP9时使用的是超滤管,将无血清培养基进行浓缩之后再检测。当然,如果做的是组织样本,就没有这种烦恼了。
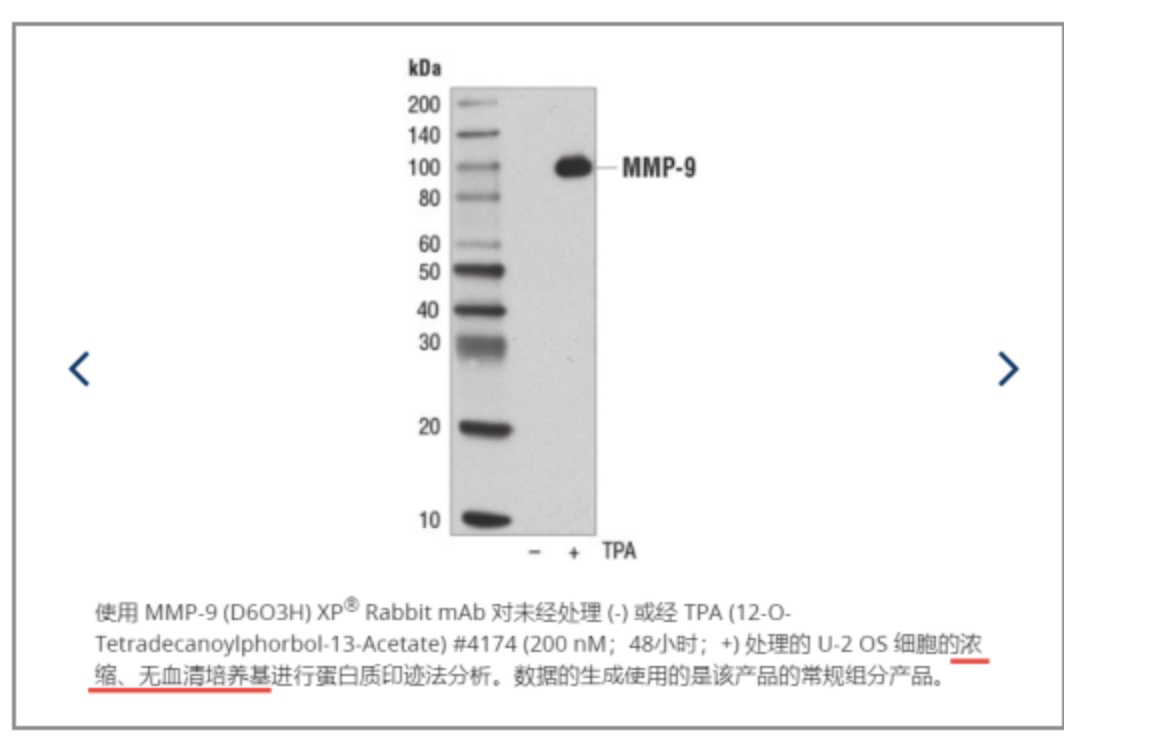
图5 MMP9使用浓缩培养基检测结果
除了分泌的MMP,一些研究还发现,分泌出去的MMP还会通过内吞作用回到细胞内,有的还会进入细胞核发挥功能。所以我们在检测的时候,千万不要只留了培养基,细胞沉淀就扔掉了,可以一起检测比对下。
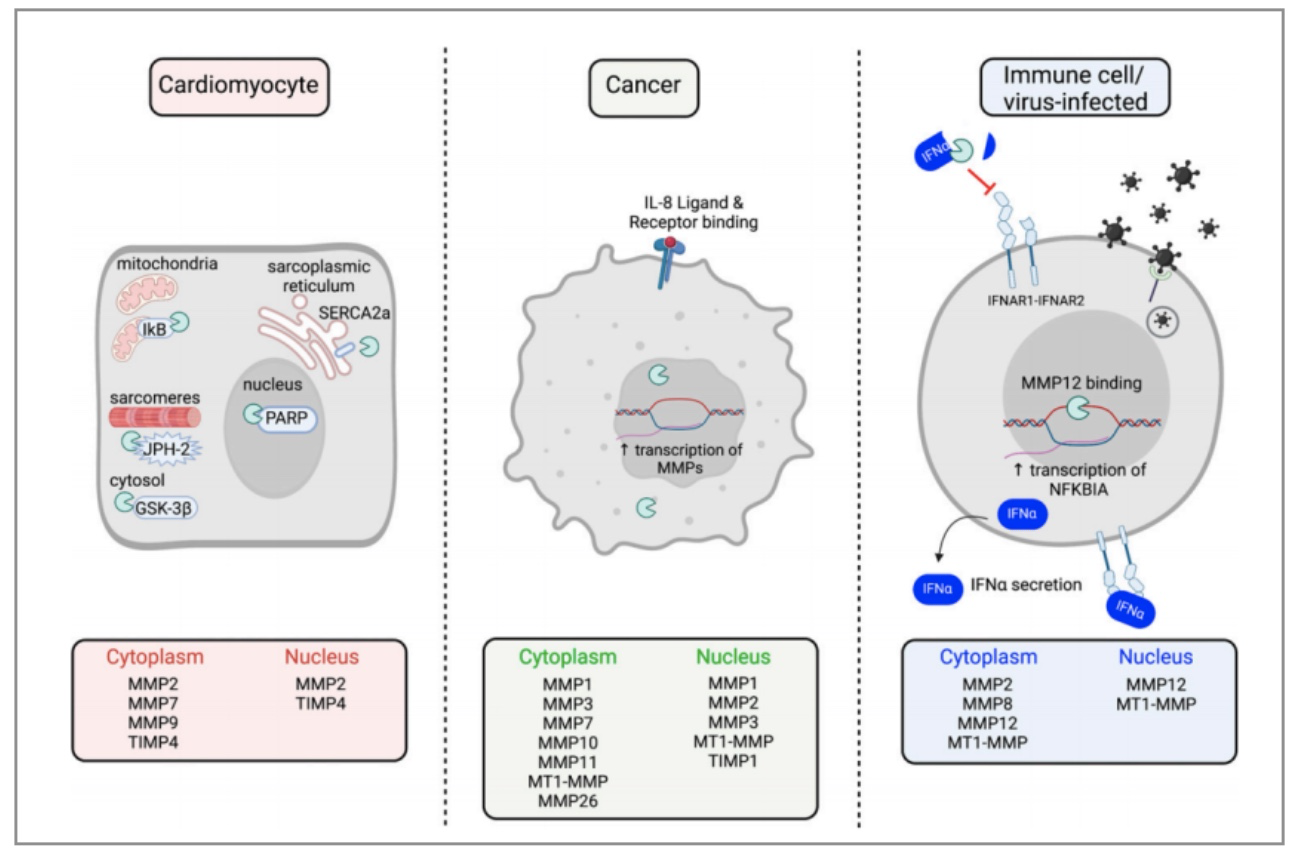
图6 MMP在不同细胞中表达位置
03
需要同时检测TIMP
TIMP是MMP的内源抑制剂,我们为什么要做呢?从图3可以看出, MMP的3个亚型理论上都可以被抗体检测到,而且由于这些亚型具有不同的分子量,我们是可以区别并且统计酶活的变化。但是有一点,就是MMP–TIMP复合物在电泳过程中是有可能解离的,因此,小分子量条带可能不能准确地代表内源性活性。如果这个时候,我们有了TIMP的WB结果,可以侧面帮助解决这个疑问。
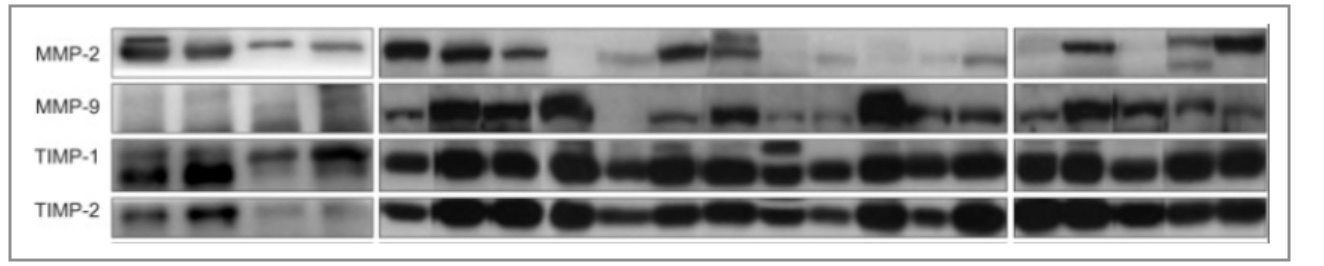
图7 文献中MMP和TIMP搭档出现
最后,再强调一句做MMP的WB之前,我们一定要做好充分的准备工作。准备研究的亚型,活性评估,研究对象,表达位置等等,只有弄清楚了这些问题再入手去做才能事半功倍。

