戈谢病(Gaucher Disease/GD)即葡糖脑苷脂病,是一种家族性糖脂代谢遗传疾病,是溶酶体沉积病中最常见的一种[1]。由于葡糖脑苷脂酶基因(GCase/GBA1)的突变而引起葡糖脑苷脂(β-GlcCer)在肝、脾、骨骼和中枢神经系统的单核-巨噬细胞内蓄积而发病,产生相应的临床表现[2]。GBA1基因突变同时也是帕金森病(PD) 发展过程中的遗传危险因素[3]。目前临床上治疗戈谢病的药物只针对I型症状,II型和III型的神经症状没有有效药物[4, 5]。由 GRN 编码的颗粒体蛋白前体 (PGRN) 是一种新型 GCase 调控因子[6],但 PGRN 在体内对GBA1 突变相关疾病的影响仍然未知。
该研究证明了 PGRN 在 GBA1 突变相关疾病(戈谢病和帕金森病)中的关键作用。建立的Gba和PGRN双基因敲除小鼠提供了一种临床相关的小鼠模型,可用于 GBA1突变引起的疾病戈谢病和帕金森病提供了新的动物研究模型。最令人兴奋的是,它开发了一种脑渗透性 PGRN 衍生的生物制剂,可以防止戈谢病和帕金森病的病理发展,为罕见的溶酶体贮积病和常见的神经退行性疾病,特别是神经型戈谢病和帕金森病提供潜在的治疗方法。
作者用PGRN敲除小鼠(Grn-/-)和Gba1缺陷的戈谢病小鼠(Gba9v/9v)杂交,建立了PGRN和Gba双突变小鼠(PG9V)(图1),并且分析比较了PG9V小鼠和其他对照组小鼠,野生型(WT),Gba9v/9v,和Grn-/- 的症状表型。

图1 PG9V小鼠的构建
(图源:Xiangli Zhao and Yi Lin, et al., PNAS, 2023)
经过比较作者发现PG9V小鼠呈现更加明显的戈谢病症状和早期发病的特征(包括戈谢病症状之一的管状溶酶体的形成)。和其他对照组小鼠相比,17个月的PG9V小鼠表现出了严重的四肢相交的行为缺陷症状。作者进一步分析发现PG9V小鼠呈现系统性的巨噬细胞诱发的炎症,在大脑中小胶质细胞和星型角质细胞明显增高。另外,作者还发现PG9V小鼠呈现出了神经退行性疾病的表型,比如帕金森疾病标志分子α-突触核蛋白(ɑ-Syn)[7]和β-淀粉样蛋白(β-Amyloid)[8]在大脑的不同部位有明显的堆积(图2)。PG9V小鼠呈现的更加严重的表型症状证实了PGRN在GBA1突变相关疾病,戈谢病和帕金森病中起到了重要的作用。
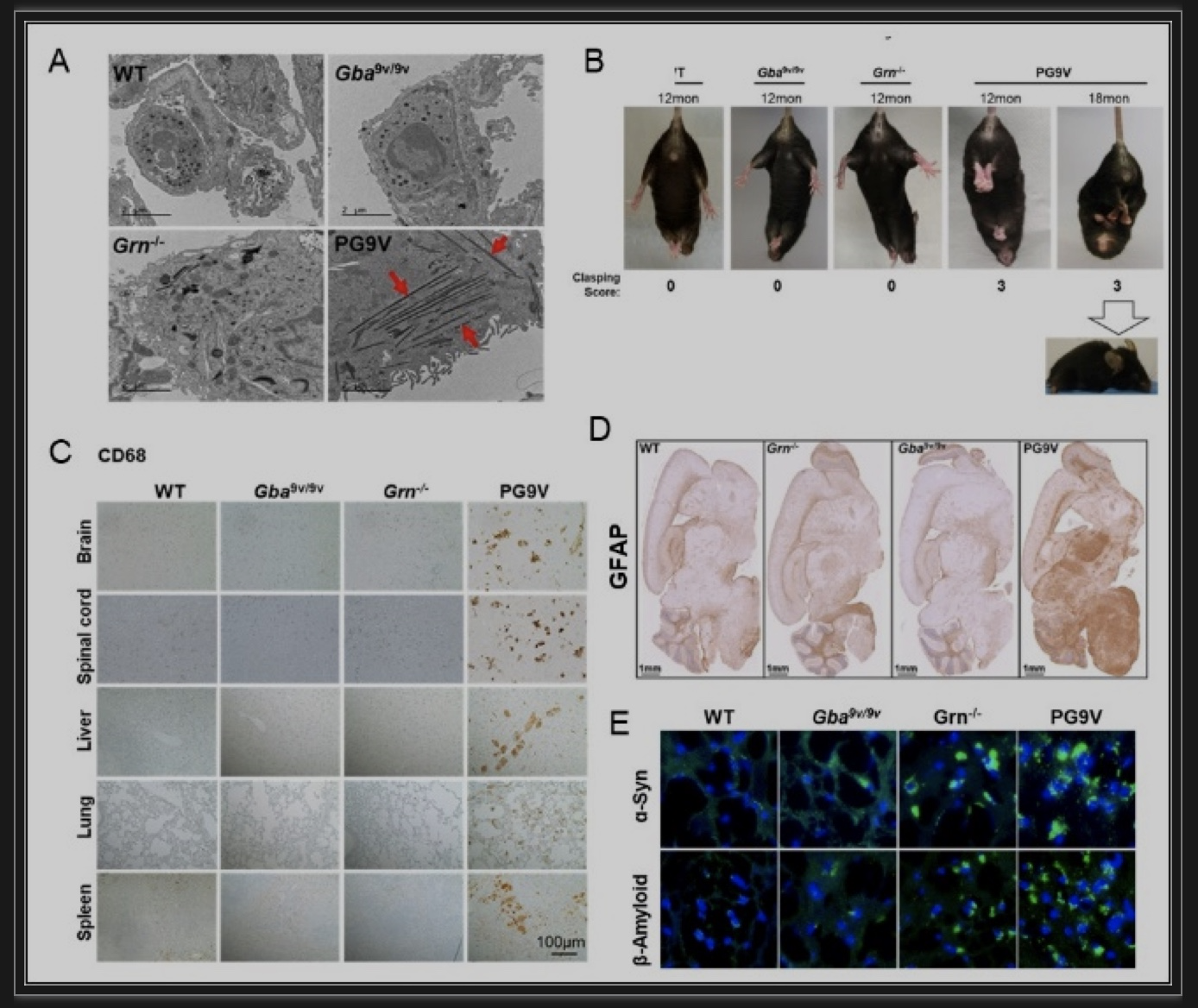
图2 PG9V小鼠表型分析
(图源:Xiangli Zhao and Yi Lin, et al., PNAS, 2023)
同时,作者构建和纯化了PGRN的衍生物ND7, PGRN C端的一段包含98个氨基酸的多肽。作者惊喜的发现ND7可以穿过血脑屏障,分布到大脑的不同部位。经过两个月的ND7给药,作者发现经过ND7给药的PG9V小鼠戈谢病症状明显有了缓解。和临床治疗戈谢病的药物Imiglucerase相比,ND7治疗的PG9V小鼠的大脑炎症和葡糖脑苷脂(β-GlcCer)的堆积都得到了明显的改善(图3)。
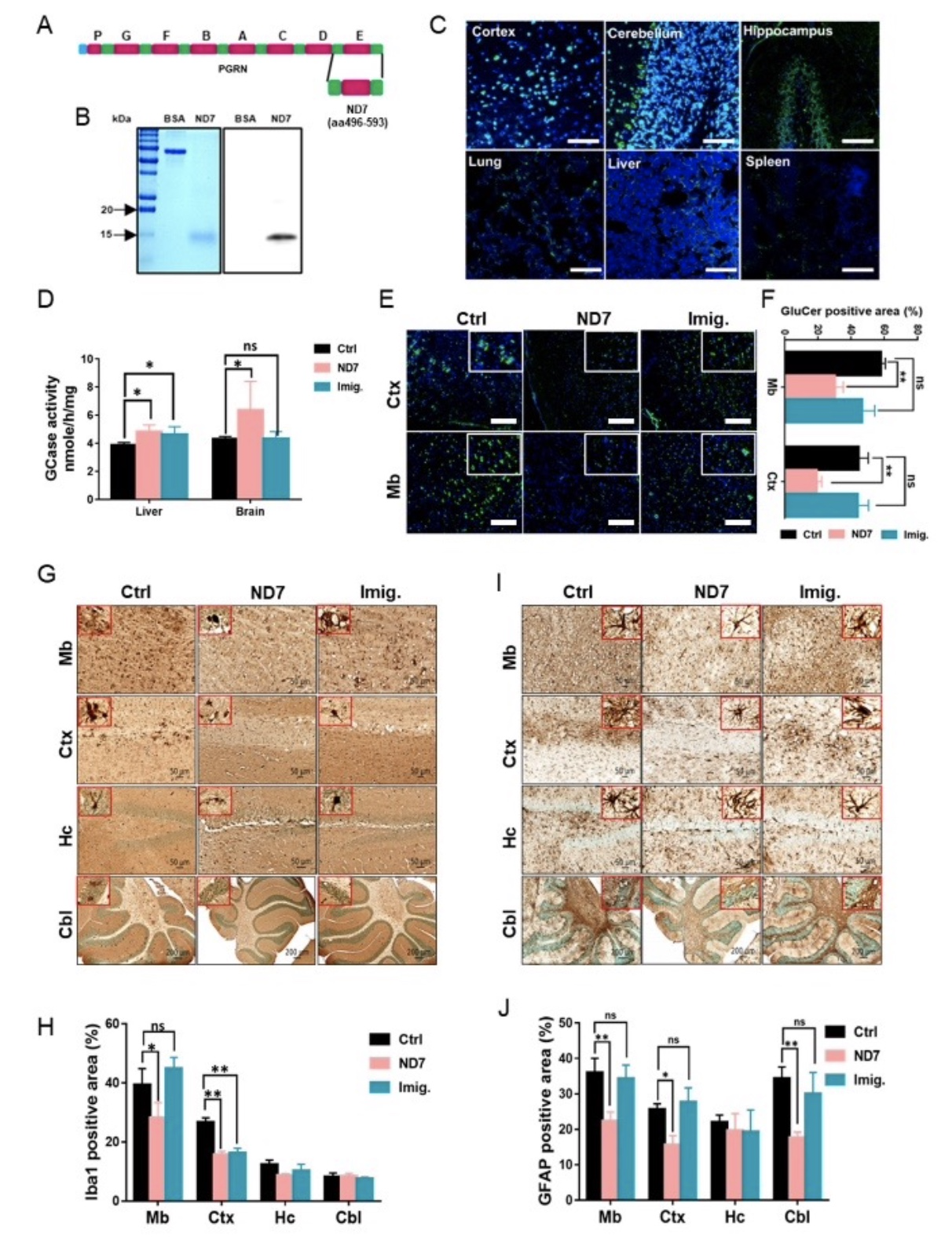
图3 ND7在PG9V小鼠中的治疗
(图源:Xiangli Zhao and Yi Lin, et al., PNAS, 2023)

