心脏疾病和肌肉收缩。心脏疾病是人类的第一杀手,每年有接近两千万的人死于心脏疾病。心脏疾病主要表现为心脏收缩和舒张功能减弱从而无法满足机体正常的血氧需求。在分子级别上(纳米)心脏的收缩是肌球蛋白为主要成分的粗肌丝和肌动蛋白为主要成分的细肌丝在相互作用,以ATP为能源以产生收缩力。肌肉的收缩机理长期以来被认为是钙离子结合以细肌丝蛋白受体引起的。最近的研究表明肌球蛋白需要被激活才能参与到肌肉收缩之中。根据这个原理,第一款以调控肌球蛋白活性的药物已经研发出来用于治疗增生性心脏病 [1]。但是目前人们对肌球蛋白休眠、激活状态下的结构以及机制却知之甚少。解决肌球蛋白的调控机制对于未来有针对性的靶向治疗心脏疾病有重要的意义。
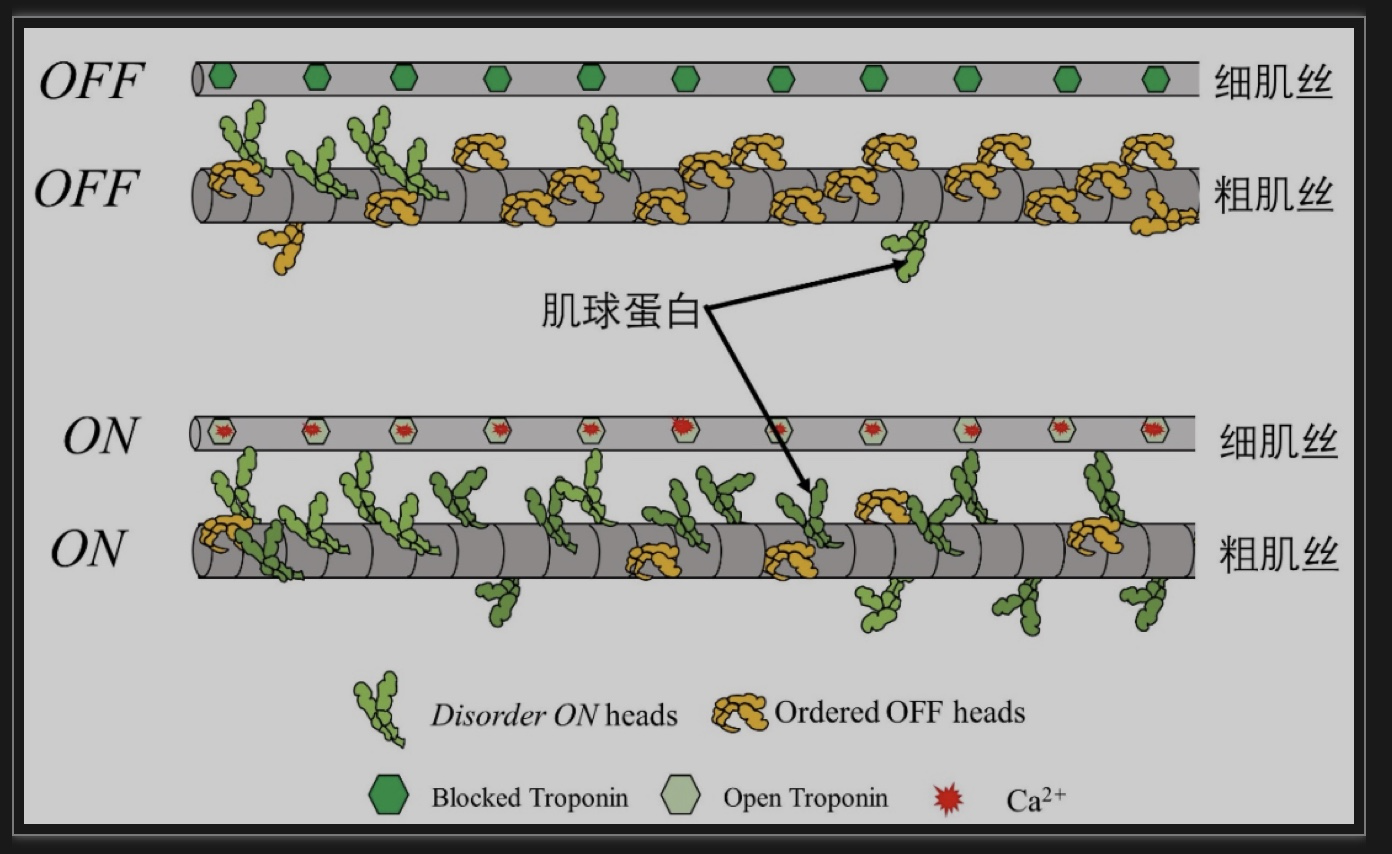
图1 粗肌丝,细肌丝在肌小节内的结构示意图
该研究利用同步光源小角X射线衍射,肌肉收缩力以及分子分子动态模拟技术揭示了静息状态下肌球蛋白的结构决定了肌肉收缩状态下收缩力的大小。
肌球蛋白是一种ATP水解酶,可以把ATP里的化学能转化为肌肉收缩的机械能。根据肌球蛋白在静息状态下水解ATP的速度,肌球蛋白要么处在超级静息状态(Super-Relaxed state, SRX),要么处于混乱静息状态(Disorder-Relaxed state,DRX)。从肌球蛋白结构的角度来看,肌球蛋白要么处在螺旋规律的静息状态(Helically ordered state, OFF),要么处于混乱的激活状态(Disorder state, ON)目前的普遍假设就是这个化学意义上SRX状态等同于结构意义上的OFF状态,而DRX状态等同于ON 状态。在这篇文章中作者利用该研究利用同步光源小角X射线衍射技术来研究在脱氧ATP诱导下的肌球蛋白从OFF往ON转变的过程。同步光源小角X射线衍射是唯一一个可以在接近生理状态下检测肌肉里边肌球蛋白结构变化的技术 [4]。作者发现随着随着脱氧ATP含量的增加,肌球蛋白从螺旋规律性的排列在粗肌丝上,慢慢的变成混乱的接近于细肌丝的状态。作者同时量化了dATP诱导的肌肉收缩力的变化,发现肌球蛋白机构的变化和肌肉收缩力的变化呈线性关系(图1 F)。同时dATP诱导肌球蛋白机构的变化和此前发表的dATP诱导肌球蛋化学性质的变化并不一样(图1 G)。作者最后用分子动态模拟技术揭示在静息状态下一部分的静息肌球蛋白可以和肌动蛋白微弱地结合,从而为后续的收缩做好准备。
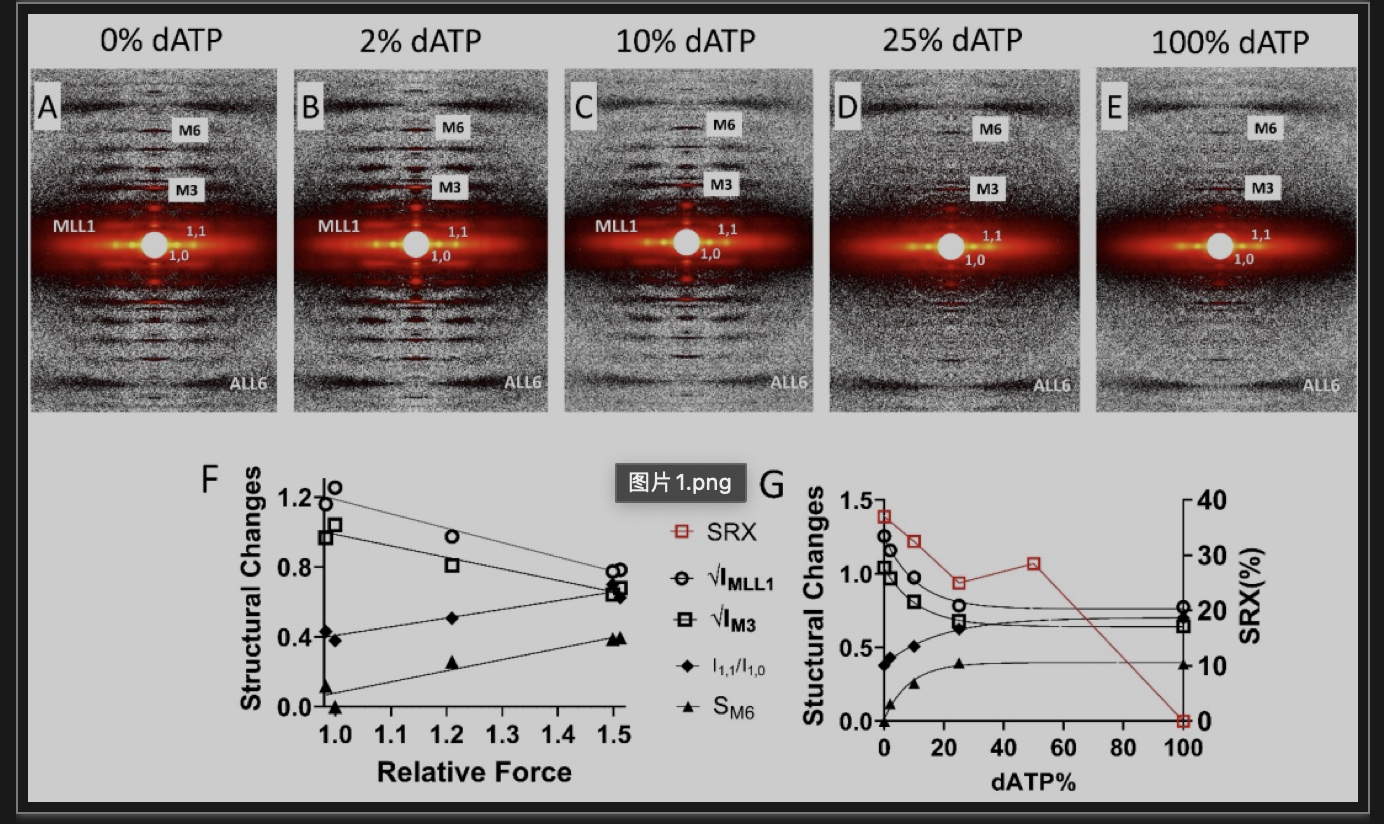
图2 A-E不同dATP浓度下猪心脏肌肉X射线图谱;F:dATP引起的结构变化于收缩力变化呈线性相关; G :dATP引起的结构变化和化学性质的变化(SRX)对比。
(图源:Ma, et al., PNAS, 2023)
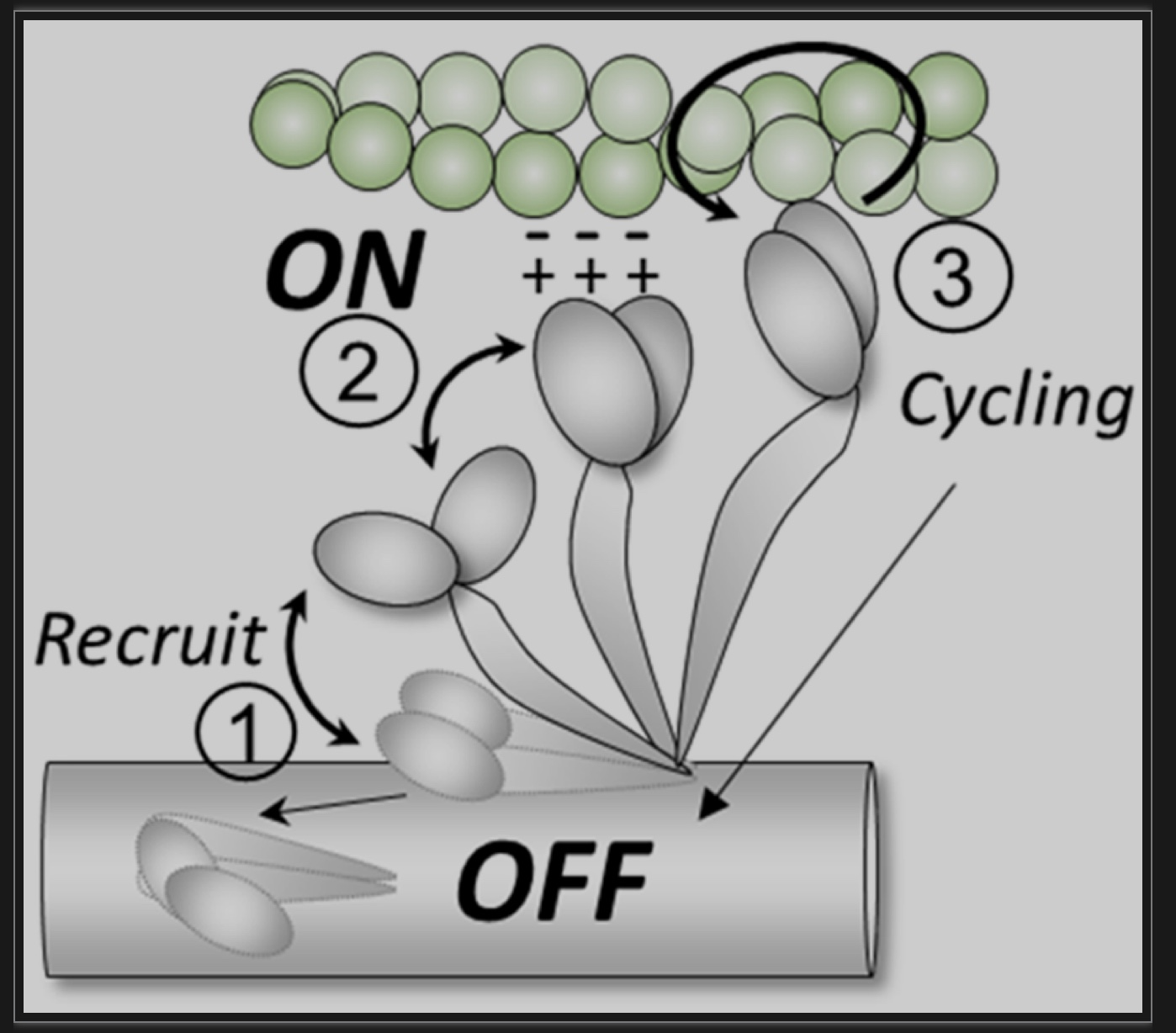
图3 肌球蛋白被激活过程的示意图
(图源:Ma, et al., PNAS, 2023)

