自噬是一种进化上保守的机制,有助于真核细胞维持平衡和更新。它参与调控了多个重要的细胞过程,包括维持细胞干性、促进胚胎发育、形成固有免疫,并影响衰老和长寿。传统的观点认为,自噬是蛋白质水平上的一系列细胞质事件,但近年来的证据表明,细胞核转录和表观遗传调控也对这一过程有深远的影响。
在细胞适应因营养缺乏及其他代谢紊乱引起的代谢变化时,自噬也发挥着关键的作用。一些营养传感器被证明可以调节自噬,从而维持细胞代谢和能量稳态。然而,m6A等表观转录组修饰在饥饿诱导自噬的调节中发挥什么作用,目前还不清楚。
研究材料与方法
在这项研究中,研究人员使用了小鼠胚胎成纤维细胞(MEF)。利用赛业生物提供的YTHDF3+/−小鼠,他们构建了YTHDF3−/−小鼠胚胎。在整个实验过程中,他们使用了基于LC-MS的蛋白质组分析、RNA免疫共沉淀测序分析(RIP-seq)和MeRIP-seq分析、免疫荧光染色和自噬流分析等。他们还通过LC-MS/MS和m6A斑点印迹测定了m6A修饰水平。
技术路线
研究结果
为了鉴定与自噬相关的表观转录组分子,研究人员对营养缺乏状态下的小鼠胚胎成纤维细胞(MEF)开展了蛋白质组学分析。有趣的是,他们发现m6A阅读器YTHDF3的水平显著升高。
为了分析YTHDF3诱导是否与自噬发生有关,他们利用shRNA载体来敲低MEF中的YTHDF3的表达,发现自噬标志物LC3-II水平下降,而自噬受体蛋白p62积累,表明自噬流降低。挽救实验表明,YTHDF3的异位表达能够提高LC3-II水平,并加快p62降解。他们还利用赛业生物提供的YTHDF3+/−小鼠繁育YTHDF3−/−小鼠胚胎并获得了YTHDF3−/− MEF细胞,发现YTHDF3缺失导致MEF细胞中自噬体和自噬性溶酶体数量大幅减少。这些数据表明,YTHDF3上调是营养缺乏期间的自噬诱导所必需的。此外,后续的分析表明,YTHDF3缺失损害了自噬体形成和溶酶体功能。
2、YTHDF3需要m6A修饰来促进自噬
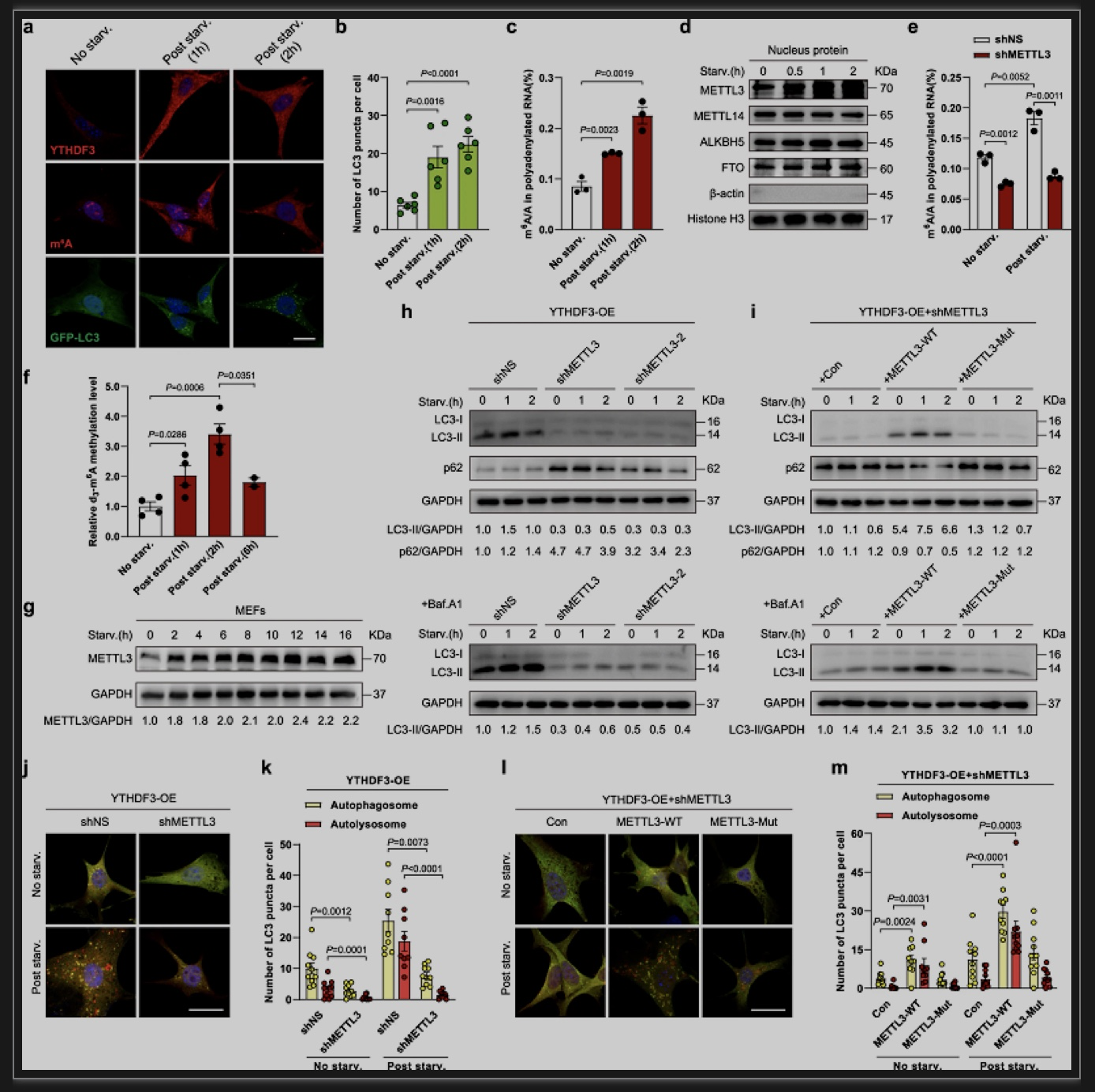
图1 YTHDF3需要METTL3介导的m6A修饰来促进自噬[1]
研究人员推测,METTL3介导的m6A修饰可能是YTHDF3促进自噬的关键。他们在过表达YTHDF3的MEF中敲低METTL3,发现饥饿诱导的LC3-II积累和p62降解均显著减弱。之后他们将野生型和催化活性缺失突变型METTL3重新引入METTL3沉默细胞中,发现野生型METTL3可以挽救沉默细胞的自噬缺陷,而突变型则不行。这些数据表明,YTHDF3需要METTL3介导的m6A修饰来促进自噬。
3、FOXO3是YTHDF3促进自噬的重要靶点
为了确定营养缺乏时与YTHDF3结合的潜在m6A甲基化靶点,他们将营养缺乏时YTHDF3 RIP-seq的上调峰与MeRIP-seq的上调峰相叠加,获得了86个峰,其中7个基因被注释到自噬通路。在这些基因中,FOXO3是文献报道的调节自噬的最重要转录因子之一。为了验证YTHDF3-FOXO3 mRNA的相互作用是否依赖于METTL3介导的m6A修饰,他们在MEF中敲低了METTL3,发现FOXO3转录本的CDS和3’UTR区域的m6A修饰水平均下降。相应地,YTHDF3与FOXO3 mRNA的结合也减少。之后,他们还利用含有FOXO3不同序列的探针开展EMSA实验,表明一旦从RNA探针中去除m6A修饰,YTHDF3与探针之间的相互作用就显著减弱。这些结果表明,在营养缺乏期间,METTL3介导的m6A高甲基化是YTHDF3-FOXO3 mRNA相互作用所必需的。
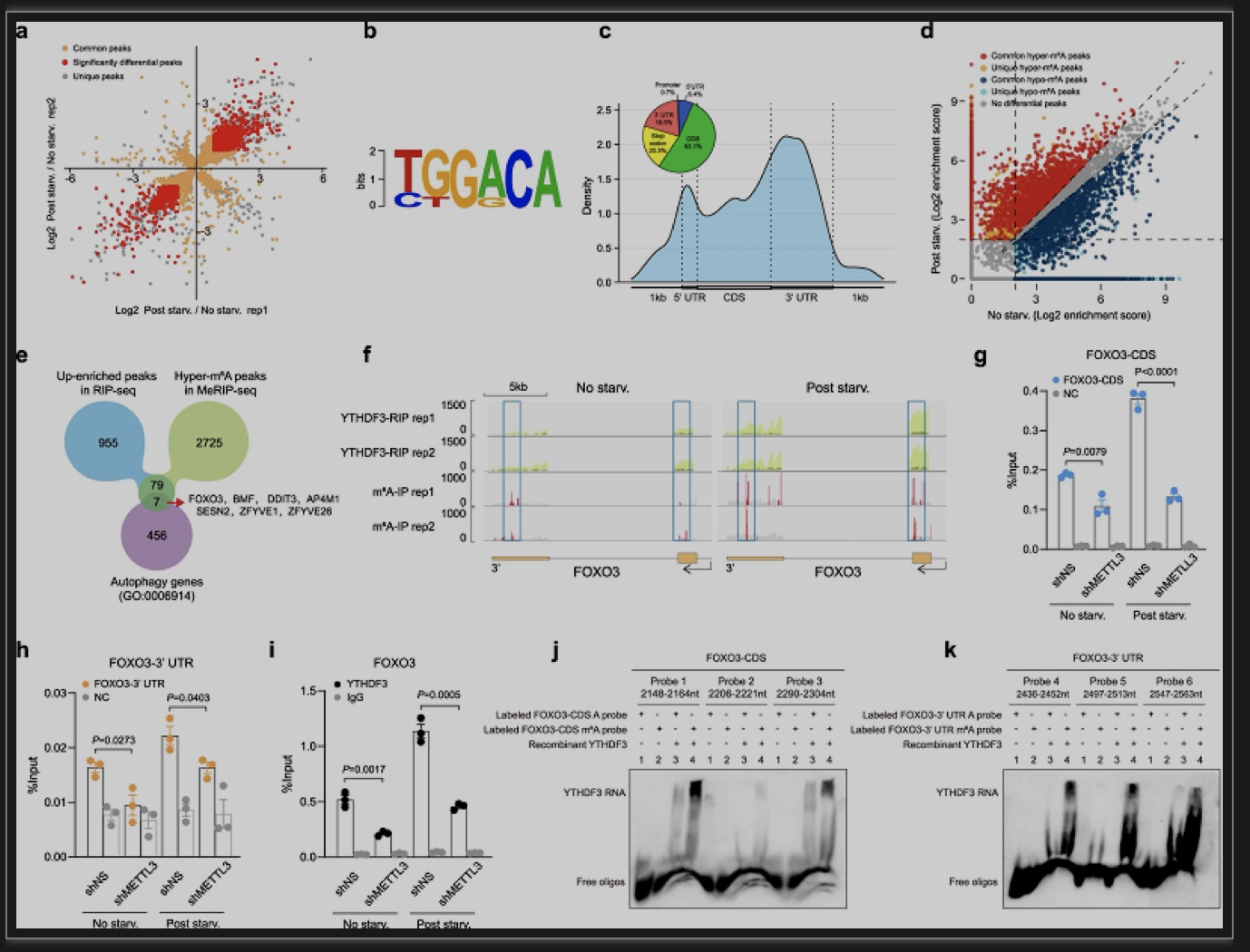
图2 YTHDF3识别饥饿诱导的FOXO3 mRNA的m6A高甲基化[1]
之后,通过进一步的分析,研究人员发现YTHDF3的作用可能是调节FOXO3的翻译,而不是FOXO3的翻译后修饰(如磷酸化)。他们发现,YTHDF3以METTL3依赖性的方式调节FOXO3的表达,并改变FOXO3靶向的自噬基因的表达。他们还在YTHDF3缺陷型细胞中异位表达了FOXO3,发现LC3-II的表达得到恢复,p62逐渐降解。这些结果表明,FOXO3是YTHDF3促进自噬的关键功能靶点。
4、YTHDF3促进FOXO3的翻译,但不影响其mRNA的稳定性
翻译控制通常发生在起始阶段。在开展co-IP LC-MS/MS分析后,研究人员注意到多个翻译起始因子与YTHDF3存在相互作用。其中,eIF3a和eIF4B是营养缺乏时最明显富集的。通过不同核糖体组分的Western blot分析和分子对接模型分析,他们认为eIF3a、eIF4B和YTHDF3之间很可能存在蛋白质相互作用。在敲低eIF3a或eIF4B后,FOXO3蛋白水平降低,表明YTHDF3可能与eIF3a和eIF4B相互作用来促进FOXO3翻译。
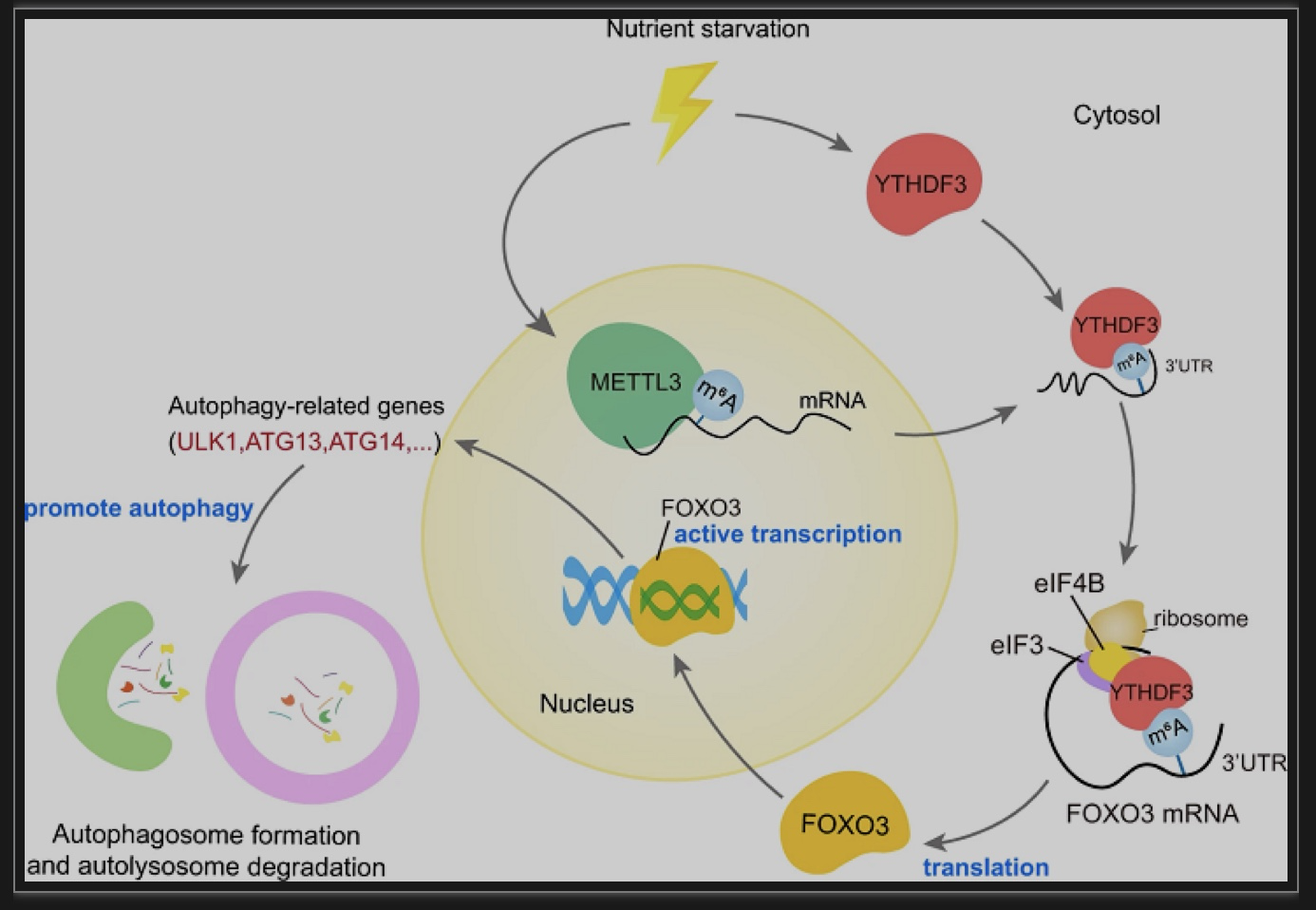
图3 YTHDF3诱导自噬的可能机制[1]
总的来说,这项研究揭示了表观转录组学与自噬之间的重要关联。一系列的证据表明,m6A阅读器YTHDF3作为营养反应器,与FOXO3 mRNA终止密码子附近的m6A修饰位点结合,然后招募eIF来迅速促进FOXO3翻译,并进一步从转录上激活一系列核心自噬基因,从而促进自噬(图3)。

