核糖核苷酸还原酶(RNR或RR)参与核苷酸代谢,将核苷酸催化生成脱氧核苷酸。这是产生DNA合成前体中的限速步骤,并且维持了dNTP池的相对比率,是DNA生物合成、修复和复制所必需的。哺乳动物的RR包含两种不同的同源二聚体亚基,即大亚基RRM1和小亚基RRM2。在整个细胞周期中,RRM1的表达水平过量并且保持恒定,而RRM2的表达水平却是波动的。可见,RRM2的表达在细胞周期中受到严格控制。许多研究发现,RRM2与肿瘤抗性、细胞程序性死亡以及肿瘤免疫有着密切的联系。因此,需要了解RRM2的表达调控模式以及在肿瘤中的作用,为RRM2靶向治疗提供分子基础。
药物化学专业在读研究生左赞文为该文章的第一作者。作者首先阐述了RRM2的结构特征,然后讨论了该基因从转录到翻译的过程中在多个水平上的调控方式,紧接着作者对该基因与肿瘤耐药性、调节细胞死亡和肿瘤免疫的相关性进行了分析,最后总结了基于不同机制开发和设计靶向RRM2的策略。

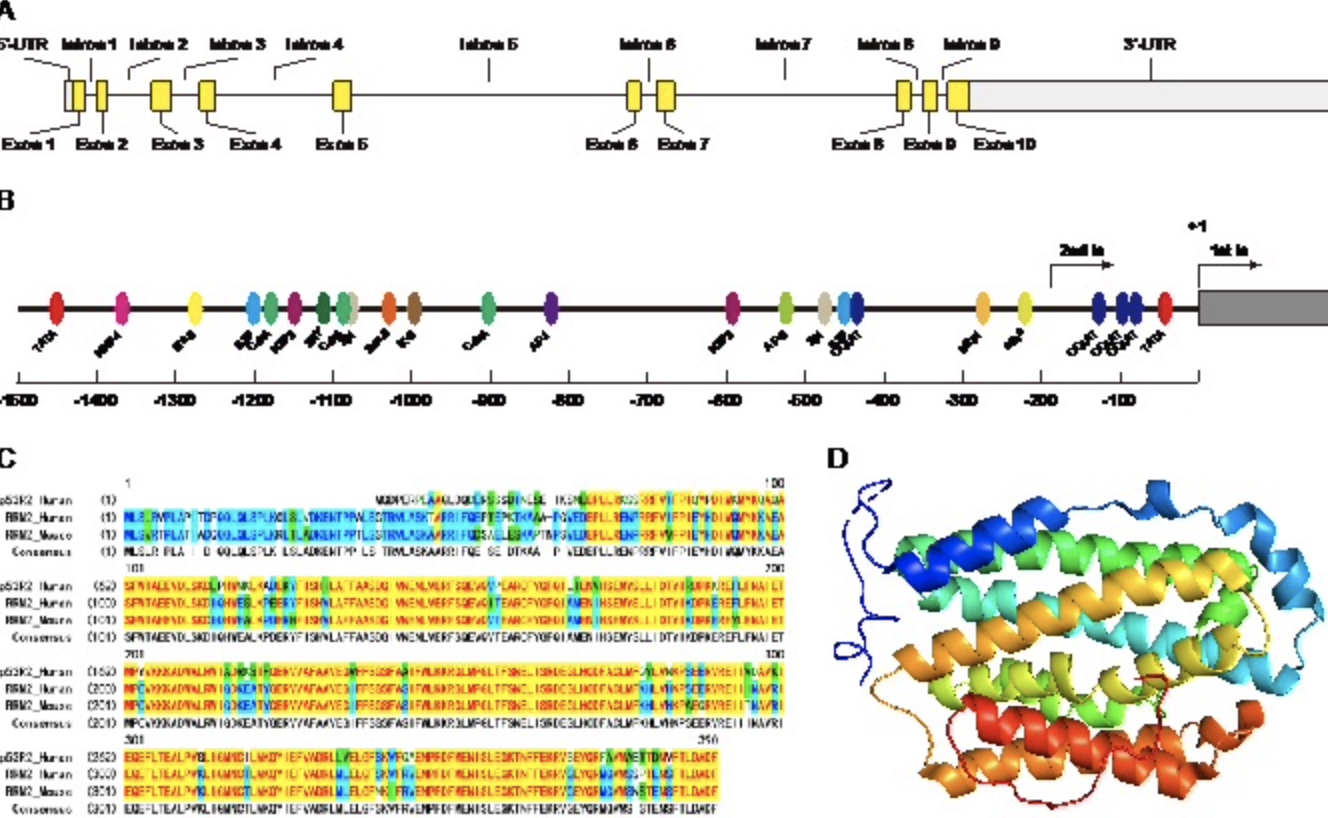
图1 RRM2的结构特征
(图源:Zan wen Zuo, et al., Genes & Diseases, 2023)
(1)启动子中的核心元件。RRM2的两个转录本由两个独立的启动子表达[3]。对于第一个转录本,从-800到+1 bp的片段贡献了最高的启动子活性。从-125 bp到+1 bp的启动子片段包含三个CCAAT序列和一个非典型的TATA-box。CCAAT序列负责RRM2的大量转录和S期特异性表达。非典型TATA-box的转录效率只有共识TATA-box序列的25%。
(2)甲基化。组蛋白甲基化通过调节基因表达参与了多种细胞过程和疾病。H3K36me3对RRM2转录的调节也有积极作用。SET-domain 2蛋白(SETD2)负责H3K36的甲基化。在人类骨肉瘤U2OS细胞中,通过SETD2敲低或利用CRISPR敲除SETD都会降低RRM2 mRNA和蛋白水平[4]。减少H3K36me3也抑制了RRM2的水平。
(3)信号通路。在MDA-MB-231细胞中,RRM2的抑制会降低Akt的磷酸化水平,这表明RRM2可以调节PI3K/Akt通路[5]。当RRM2沉默时,PI3K/Akt通路激动剂IGF1可恢复Akt的磷酸化水平。这表明PI3K/Akt途径可以由IGF1/IGF1R和RRM2调节。在乳腺癌细胞系MCF-7中,si-RRM2细胞中MEK、ERK和p38的磷酸化水平下降,这表明MAPK信号通路被RRM2下调所抑制;另一方面,MEK抑制剂trametinib抑制了IGF1诱导的RRM2上调,表明RRM2的表达受MEK/ERK/JUN的调节[6,7]。

图2 RRM2的调控机制
(图源:Zan wen Zuo, et al., Genes & Diseases, 2023)
(4)转录因子。E2F家族包括八个不同的基因,编码转录激活剂如E2F1和抑制剂如E2F4。E2F1诱导RRM2的表达,E2F4抑制RRM2启动子的活性[7,8]。E2F4有一个核输出信号,从而主要存在于细胞质中。E2F4与视网膜母细胞瘤蛋白家族成员相关,也被称为口袋蛋白如p107和p130。当口袋蛋白被磷酸化时,复合物解离,E2F4被释放,导致细胞质中的E2F4逐渐增加。E2F1有一个核定位信号。当被激活时,E2F1诱导细胞周期相关基因和S期促进基因的表达,然后细胞进入S期。
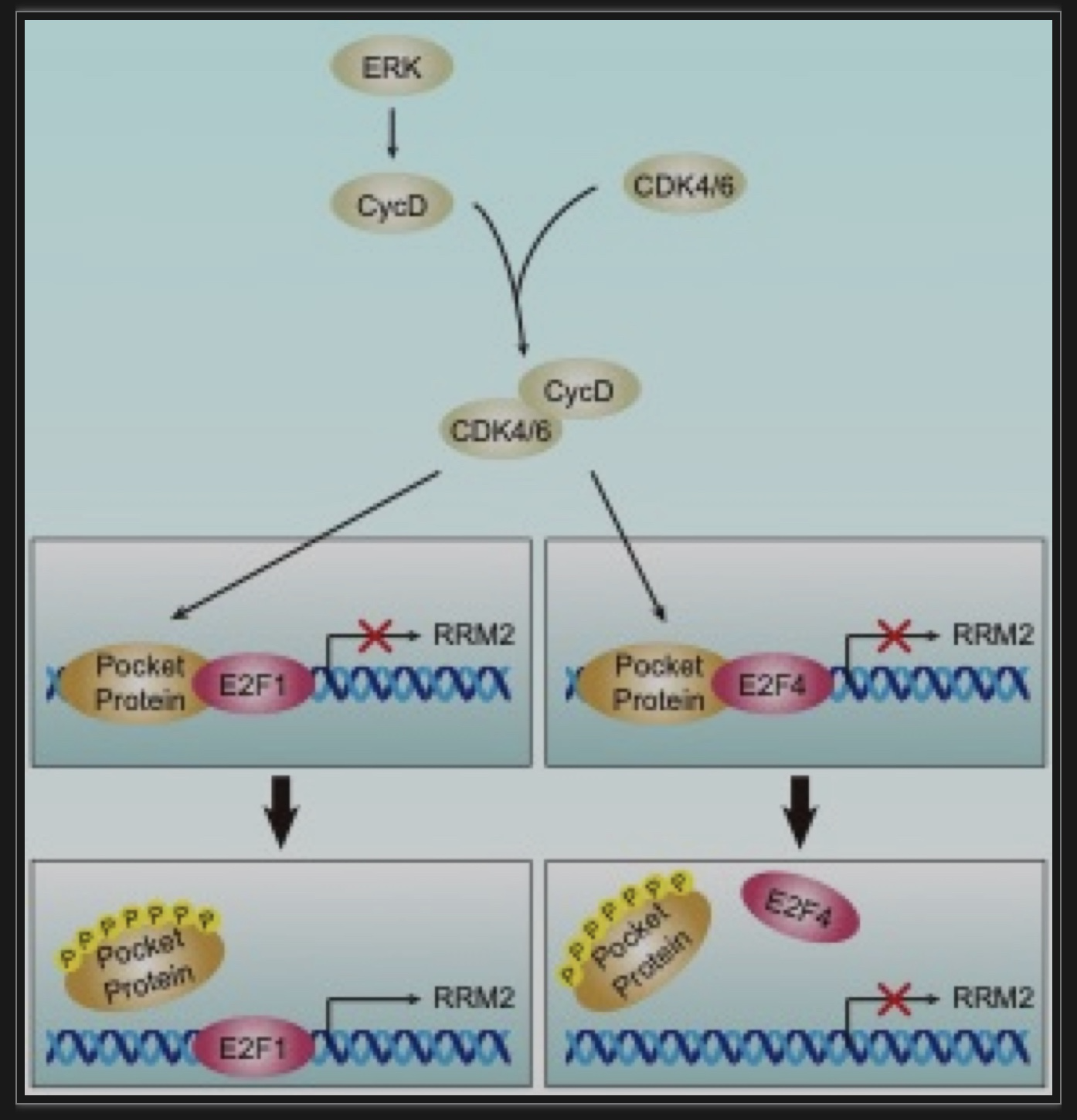
图3 E2F1和E2F4调控RRM2转录的作用机制
(图源:Zan wen Zuo, et al., Genes & Diseases, 2023)
(5)非编码RNA。LncRNAs与miRNAs相互作用,导致释放miRNA的目标基因。利用生物信息学和实验方法,在乳腺癌中一些调控RRM2基因的lncRNAs和miRNAs已经被确定,如表1所示。

表1 乳腺癌细胞中lncRNA和miRNA调控RRM2基因
(表源:Zan wen Zuo, et al., Genes & Diseases, 2023)
(6)蛋白质合成。在真核生物中,蛋白质的合成受真核翻译起始因子(eIFs)和翻译抑制因子的调节。在横纹肌肉瘤细胞中,mTORC1/eIF-4E cap依赖性蛋白翻译参与了对RRM2表达的调节[9]。在肉瘤细胞系中也有类似的结果,其中4E-BP1通过抑制mTORC1/2而被激活,从而抑制RRM2的翻译。此外,4E-BP1的转录可以被MYBL2诱导。因此,MYBL2在转录和翻译水平上同时调控RRM2的表达。研究发现,eIF3a对HeLa和NIH3T3细胞的RRM2表达有积极的调节作用。耗尽S6K1会导致RRM2的上调。
(7)翻译后修饰。蛋白质翻译后修饰(PTMs)是蛋白质结构变化的关键步骤,参与多种生物过程。赖氨酸乙酰化是一种多功能的PTM,参与了许多重要的细胞过程。SIRT2是是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖性的去乙酰化酶。RRM2的乙酰化/脱乙酰化是RR活性的一个分子开关[10]。RRM2在K95处的乙酰化破坏了其同源二聚体,导致RR的失活;而SIRT2使RRM2去乙酰化,从而激活RR。
(8)降解。RRM2受泛素化-蛋白体系统(UPS)的调节[11,12]。APC/CCdh1可以识别位于RRM2的N端保守的KEN盒,与之结合并将其泛素化。研究还发现,在G2期,CDK介导的Thr33磷酸化后,RRM2通过SCFCCNF降解,从而维持了dNTP池的平衡和基因组的稳定。CCNF以ATR依赖的方式下调,使得RRM2在应对DNA损伤时积累,从而高效修复DNA。CCNF过量表达会降低RRM2的蛋白水平。S期激酶相关蛋白2(Skp2)也是SCF复合体的一部分。Skp2和RRM2在抗羟基脲(HU)的细胞系KB中同步过表达。并且Skp2与RRM2直接相互作用,增强了RR的活性。WEE1是一种酪氨酸激酶。WEE1的抑制会激活CDK1/2,从而增加RRM2在Thr33的磷酸化,导致促进RRM2的降解。
(1)酶功能。DNA复制是癌症的一个标志。一些用于癌症治疗的化疗药物,通过干扰DNA复制而发挥抗肿瘤功能。RRM1的激活是癌细胞获得耐药性的一个重要标志。因此,RRM2的过度表达已被证明是引起耐药性的一个潜在因素。在抗HU15倍的人KB细胞系中,RRM2的基因扩增,mRNA和蛋白水平增加,RR的活性增强。抑制RRM2可以克服纤维肉瘤、胰腺癌等的耐药性,提高化学敏感性。一些研究还发现,MMR2是HU、他莫昔芬和阿霉素抗性的一个标志。
(2)非酶功能。研究表明,RRM2参与了铁死亡作用[13]。而RRM2也被认为是前列腺癌和肺腺癌的铁摄取相关代谢基因。有报道称,RRM2在肝癌细胞和肺腺癌中是一个内源性的铁萎缩抑制因子,RRM2敲除后可诱导铁萎缩。在肝癌细胞中,RRM2在T33的磷酸化促进了GS蛋白的表达,而GS蛋白对GSH的合成至关重要。RRM2的去磷酸化增强了RRM2和GS的相互作用,同时,触发了蛋白酶体的降解,从而导致它们的降解。基于实验和生物信息学研究,证实RRM2与肿瘤免疫之间存在关联,RRM2有助于免疫逃逸[14]。免疫检查点抑制是改善患者预后的有效治疗手段,如程序性细胞死亡1/程序性细胞死亡配体1(PD-1/PD-L1)阻断。RRM2沉默会减少、而过表达会增加786-O和A498细胞中PD-L1的mRNA和蛋白水平。
RRM2被认为是诊断、治疗和预后预测的一个有前途的靶标,对DNA复制和癌细胞增殖至关重要。RRM2调控的分子机制极其复杂。例如,RRM2可以受某个途径调节,也可以调节该途径,形成反馈信号。在从转录到翻译的过程中,几乎每一个步骤都会发生调控。尽管化疗在治疗癌症和防止其复发和扩散方面具有重要作用,但耐药性是主要问题。在乳腺癌细胞的治疗中,RRM2上调,参与了对GTI-2040、他莫昔芬、阿霉素和顺铂的抗性。获得性抗性很容易被RRM2的抑制所克服。然而,许多RRM2抑制剂本身会促进化疗耐药性,而且无效果或有副作用。因此,需要继续努力开发和设计有效且毒性较小的RRM2抑制剂。天然产物也可以成为抗肿瘤药物的来源。它们具有明显的优势,如安全、副作用少、毒性低。除了使用小分子化合物或天然产品的传统疗法外,基因疗法,如使用包括lncRNA和miRNA在内的基于RNA的疗法,为治疗疾病创造了一个新途径。深入了解RRM2的调控机制将促进我们对肿瘤发展和抗性的理解。

