缺氧(hypoxia)是实体恶性肿瘤的主要特征之一[1-3],缺氧区的形成是由于肿瘤新生血管的生长速度落后于肿瘤细胞的生长速度,使得周围毛细血管中扩散到肿瘤内的氧气量不能满足肿瘤细胞快速生长的需求,导致肿瘤内部氧气和营养供应不足,形成缺氧微环境[4]。缺氧区的存在降低了肿瘤对化疗的敏感性,产生耐药[5-7],导致新生血管和缺氧诱导因子的形成,诱发肿瘤细胞的复发、侵袭和转移,这是肿瘤难以治愈的根本原因。因此,从改变肿瘤内部缺氧状态角度,开发一种毒性更小、更有效的肿瘤治疗策略具有重要的临床意义。
硒是人体必需的微量元素,具有预防和治疗癌症的作用。含硒化合物,如亚硒酸钠(Na2SeO3)、硒代胱氨酸(CysSeSeCys)、硒代蛋氨酸(SeMet)和硒甲基半胱氨酸(MeSeCys)是目前研究最多的具有抗癌作用的食用硒化合物[8]。当这些硒化合物在体内代谢时,会产生一种常见的中间代谢物--硒化氢(H2Se)。H2Se是一种活性非常高的强还原性分子,遇到氧气会立即与氧气反应生成超氧阴离子(O2-)和硒单质(Se0)[9]。从硒代谢角度考虑,利用硒治疗缺氧性肿瘤的同时,给予高浓度的氧气来改善肿瘤的缺氧微环境,是否可以进一步提高肿瘤的治疗效果,起到增效减毒的作用,尚未有研究报道。该研究发现氧疗法可以通过调控Nrf2和MAPK信号通路,显著增强硒化合物抗肝癌的作用,为缺氧性肿瘤的治疗提供了新策略,为硒在恶性肿瘤治疗中的应用指明了新方向。

肝细胞癌(Hepatocellular carcinoma, HCC)属于实体恶性肿瘤,肿瘤内部处于缺氧状态[3,10]。研究者选取HCC为缺氧肿瘤模型,首先通过体外实验证明:与缺氧微环境(1% O2)相比,高氧环境(60% O2)下两种含硒化合物Na2SeO3和CysSeSeCy均表现出更强的促进肝癌HepG2细胞死亡的效果。研究者进一步选用荷瘤小鼠进行了体内实验,小鼠氧疗法分为两种方式,一种为荷瘤小鼠灌胃硒化合物后立刻转移到95% O2环境中吸氧4 h(Fig. 2A);另一种为荷瘤小鼠灌胃硒化合物的同时口服增氧剂洛沙坦(Losartan)(Fig.2B)。结果发现无论是Na2SeO3联合氧疗组还是CysSeSeCy联合氧疗组,相比较单独Na2SeO3或CysSeSeCy治疗组,肿瘤增长速度均进一步受到抑制,尤其是化合物使用剂量为2 mg/kg时,Na2SeO3或CysSeSeCy联合氧疗组肿瘤体积约为单独硒化物处理组的50%,治疗效果达到了5 mg/kg单独硒化合物处理组的水平(Fig. 2C-F)。小鼠肝脏和肾脏HE染色结果显示,硒化合物联合氧疗法对正常脏器均未显示出毒副作用,说明氧疗法能够明显提高硒化合物的抗肝癌效果,且对正常组织器官是安全的。
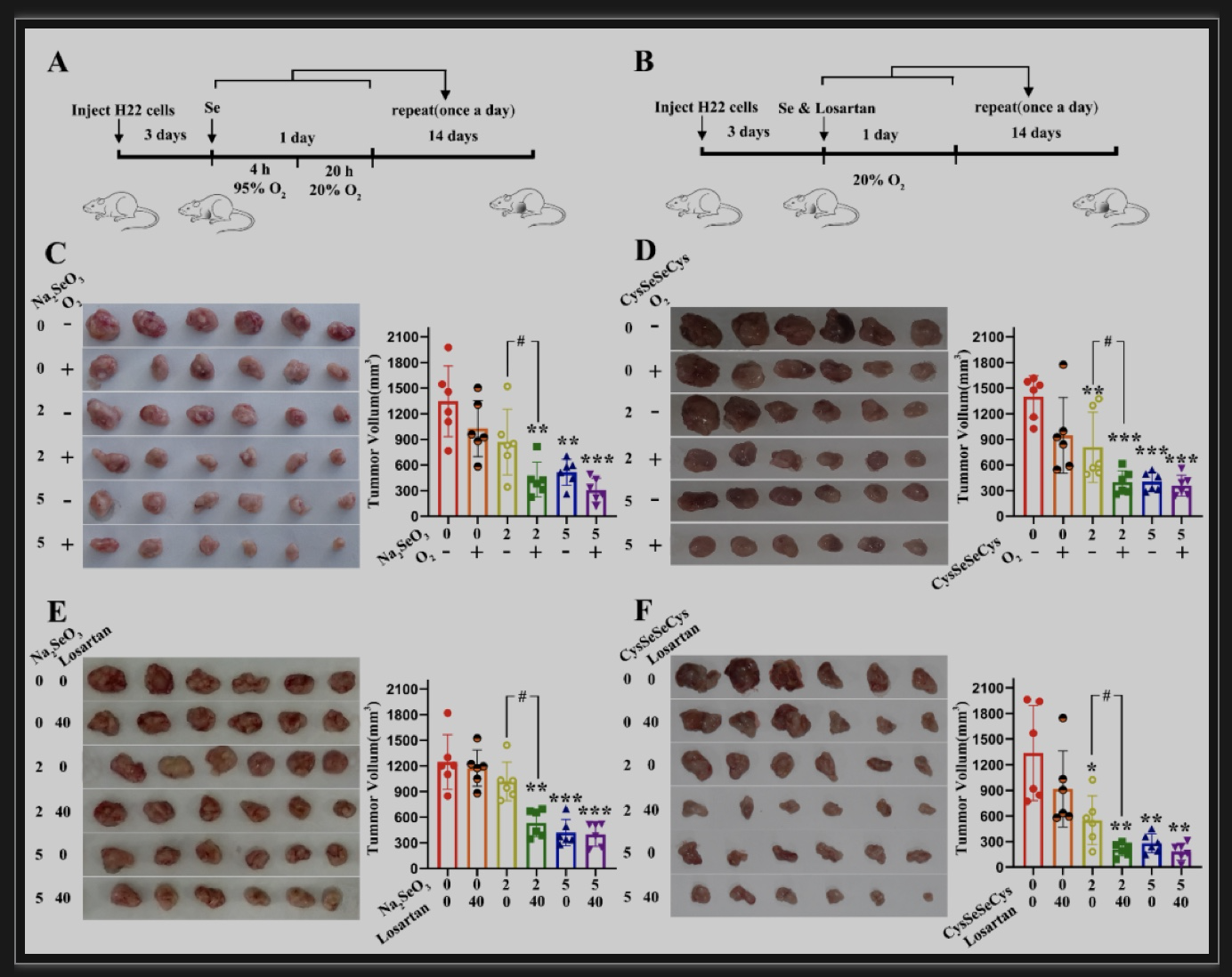
图1 硒化合物联合氧疗法对小鼠实体肿瘤大小的影响
(图源:Wang C, et al., Pharmacol Res, 2023)
机制研究表明,两种硒化合物分别处理HepG2细胞后,细胞凋亡比例均随氧气浓度的增加而上升(Fig.2 A-C),说明硒化合物联合氧疗法可以诱导HepG2细胞凋亡。因为凋亡和自噬有着密不可分的关系,接下来研究者利用Western blot检测自噬和凋亡标志性蛋白的表达,结果发现,低氧条件(1% O2)下,两种硒化合物作用HepG2细胞后,均引起LC-3 II表达量的升高,Bax和Bcl-2表达量无明显变化;然而,随氧气浓度的增加,LC-3 II和Bcl-2表达量逐渐降低,Bax表达量逐渐升高(Fig.2 D-I)。研究结果提示,在低氧条件下,两种硒化合物均引发细胞保护性自噬,延缓细胞凋亡;而高氧条件下,自噬被适度抑制,凋亡增加,进而加快了细胞的死亡速度。
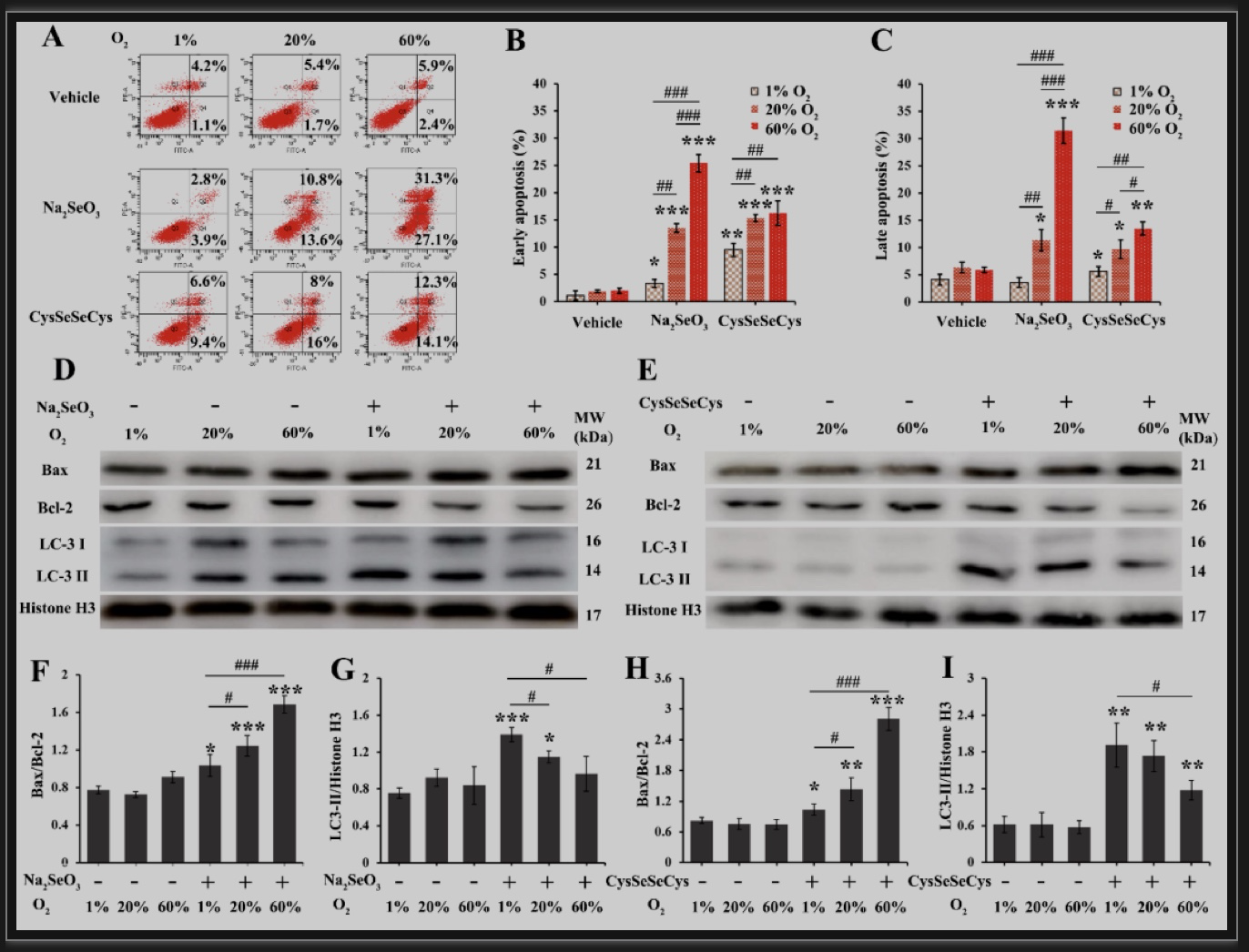
图2 硒化合物联合氧疗法对细胞自噬和凋亡的影响
(图源:Wang C, et al., Pharmacol Res, 2023)
为了进一步探究高氧加速肝癌细胞凋亡的原因,研究者对细胞内的氧化还原环境进行了检测,结果发现在低氧条件下硒化合物代谢产生的H2Se发生积累,细胞内处于还原性微环境;高氧条件下硒化合物代谢产生的H2Se被氧化转变成了H2O2,使细胞转变为氧化应激状态。体内实验进一步证实了这一现象。硒化合物单独治疗后,随着硒化合物浓度的升高,H2Se含量明显增加;当硒化合物治疗的同时给小鼠呼吸95% O2或给予Losartan联合治疗后,与对照组相比,联合治疗组中H2Se含量虽然增加,但并未随着硒化合物浓度的增加而继续升高(Fig. 5A、C)。肿瘤组织冰冻切片观察结果与此类似(Fig. 5B、D)。相反,硒化合物单独治疗后,随着硒化合物浓度的升高,H2O2含量几乎无明显变化;而当硒化合物与氧疗法联合治疗后,H2O2含量随着硒化合物浓度的增加而升高(Fig. 5E、G),肿瘤组织冰冻切片结果与此一致(Fig. 5F、H)。说明氧疗法使硒化合物在肿瘤内代谢产生的H2Se转变成了H2O2,使细胞由还原应激转变成了氧化应激。
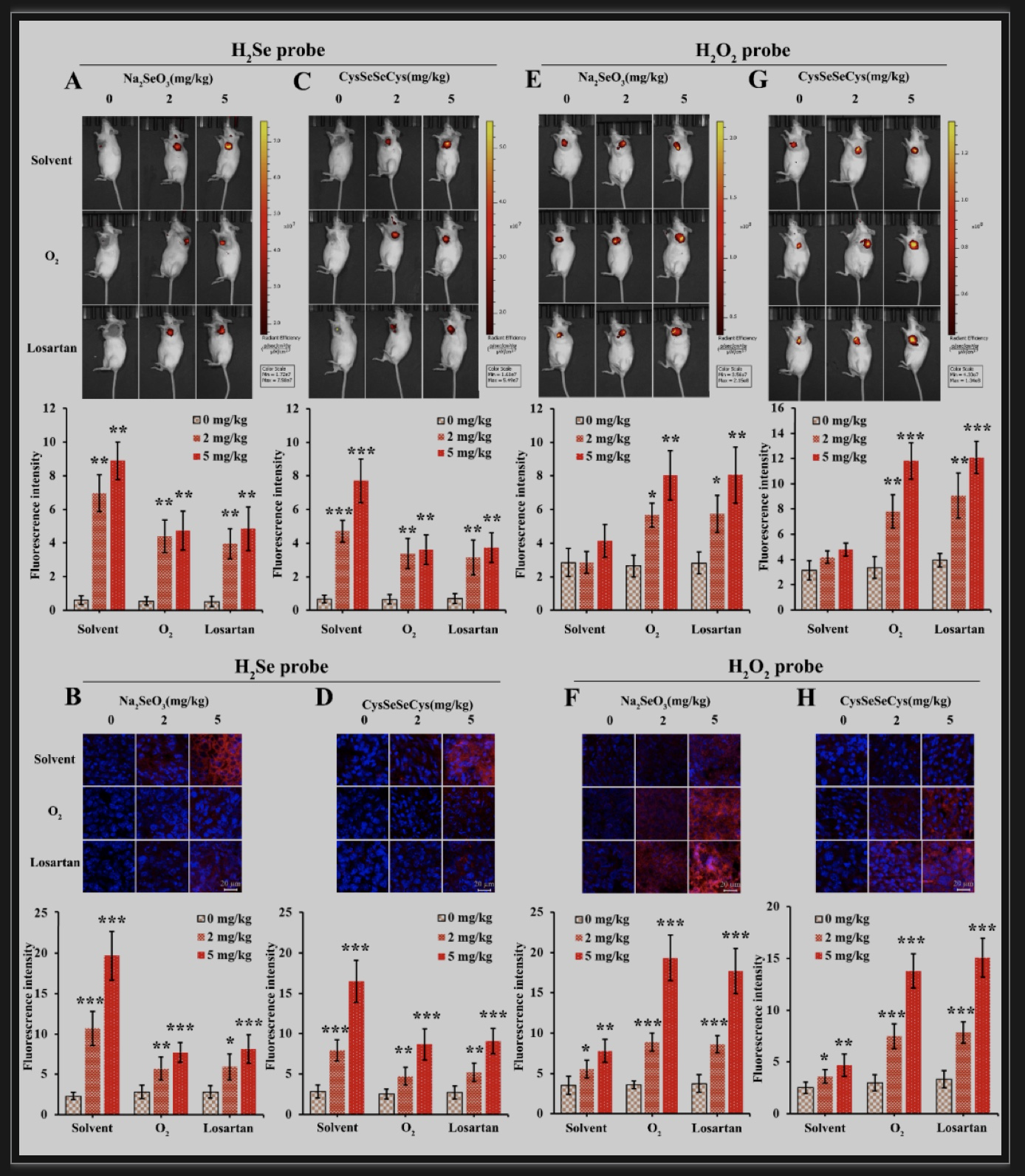
图3 硒化合物联合氧疗法对小鼠肿瘤内氧化还原环境的影响
(图源:Wang C, et al., Pharmacol Res, 2023)
进一步的机制研究表明,缺氧条件下Na2SeO3和CysSeSeCys均促进Nrf2的表达,这可能与H2Se的积累有密切关系;然而联合氧气治疗则抑制了Nrf2的表达,同时伴随着HO-1、CAT和SOD的表达降低。Nrf2信号通路与MAPK信号通路有复杂的串扰关系,而且均参与自噬和凋亡的调控。作者研究发现,Na2SeO3和CysSeSeCys在低氧条件下均引起了细胞自噬,同时Nrf2表达量增加、少量p38和MKK4发生磷酸化;而高氧条件下自噬被抑制、凋亡增加,伴随着Nrf2表达量降低和大量p38、MKK4的磷酸化,利用RNA干扰技术敲低细胞内的Nrf2基因后,自噬进一步被抑制、凋亡进一步增加,同时p38和MKK4的磷酸化进一步升高。说明Nrf2通路和MAPK通路与自噬和凋亡之间有着复杂的信号串扰关系,这应该归因于不同氧气条件下硒化合物代谢产物H2Se及其衍生产物ROS的不同作用(Fig. 4)。

图4 硒化合物在不同氧气环境下治疗肝癌的机制
(图源:Wang C, et al., Pharmacol Res, 2023)

