
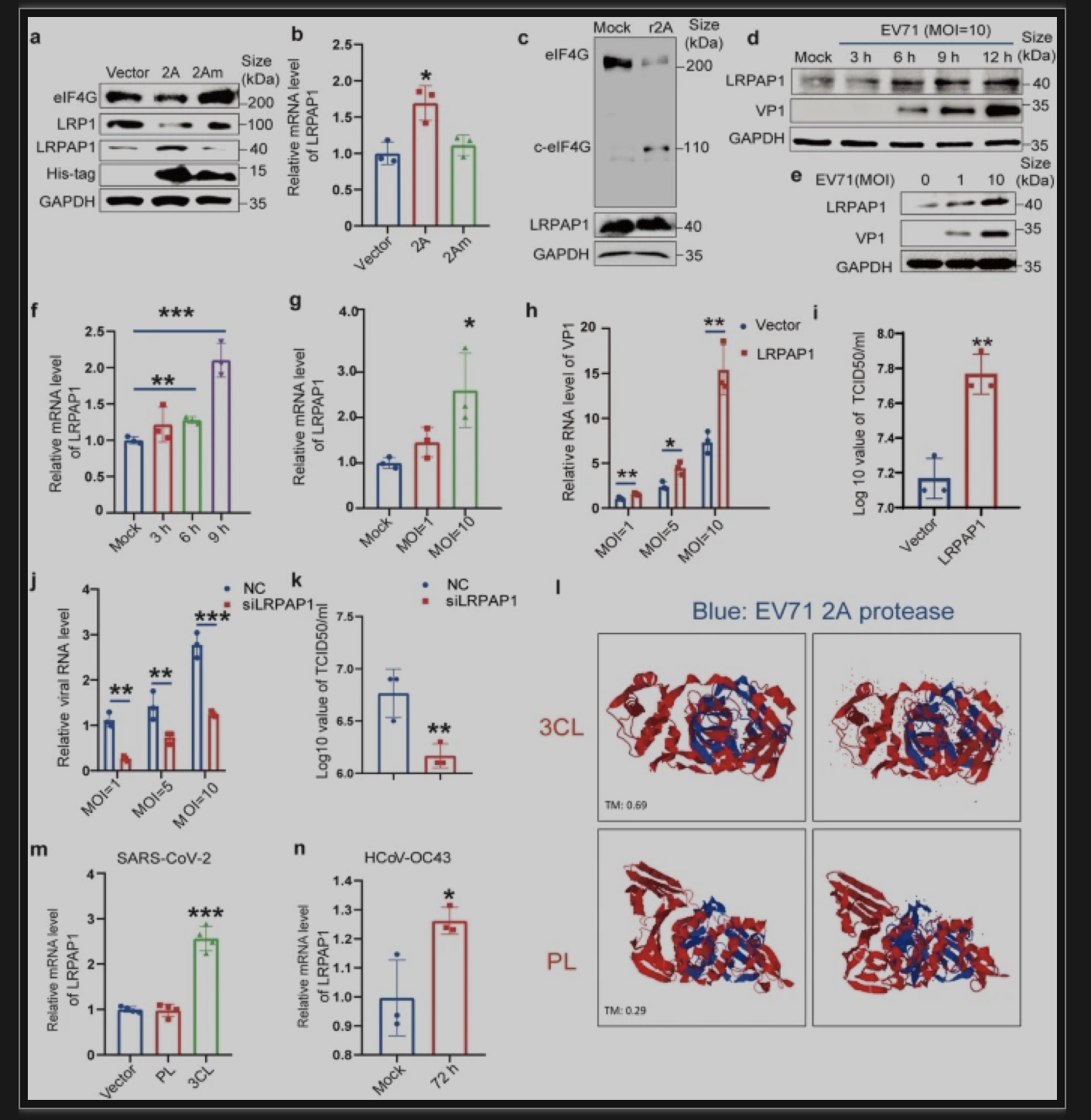
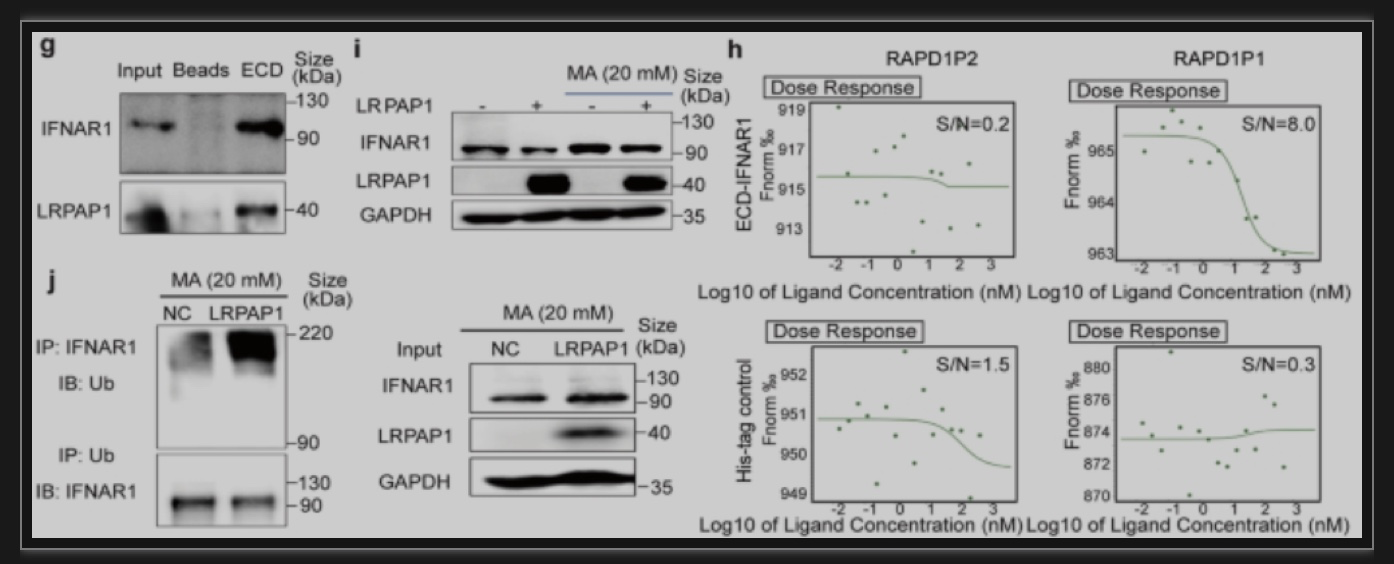

本研究首次揭示了肠病毒71(EV71)2A蛋白酶和新冠(SARS-CoV-2)3CL蛋白酶可以帮助LRPAP1出胞,胞外的LRPAP1通过溶酶体使I型干扰素受体降解。同时,从LRPAP1 N端合成的肽段(RAPD1P1)可以结合I型干扰素受体并增强病毒感染。此外,本研究还发现LRPAP1的天然抑制剂(α2M)可抑制多种病毒感染(包括RNA和DNA病毒),而α2M之前被用于治疗类风湿性关节炎,这进一步为其成为广谱抗病毒药物提供可能。综上,本研究首次发现了I型干扰素受体的抑制性配体,为天然免疫研究提出了一个新概念。

