炎症性肠病(Inflammatory bowel disease, IBD)是一种病因不明的慢性非特异性肠道炎症性疾病,具有不可治愈、终身复发及可致残性等特点,患者需长期用药和定期复诊。近年来,IBD的发病率迅速增长,已成为全球性疾病,极大加重全球负担,预计到2025年,我国IBD患者将达到150万人[1]。目前,IBD的临床治疗药物主要通过发挥抗炎或免疫抑制作用来缓解疾病,但超过一半的IBD患者无法通过现有的临床治疗达到持续一年的临床缓解。鉴于IBD的发病机理通常被认为是机体对肠道菌群的异常免疫反应[2,3],因此,使用特定抗生素调节肠道微生物群和不适当免疫反应之间的不平衡将是治疗IBD的新型有效策略。
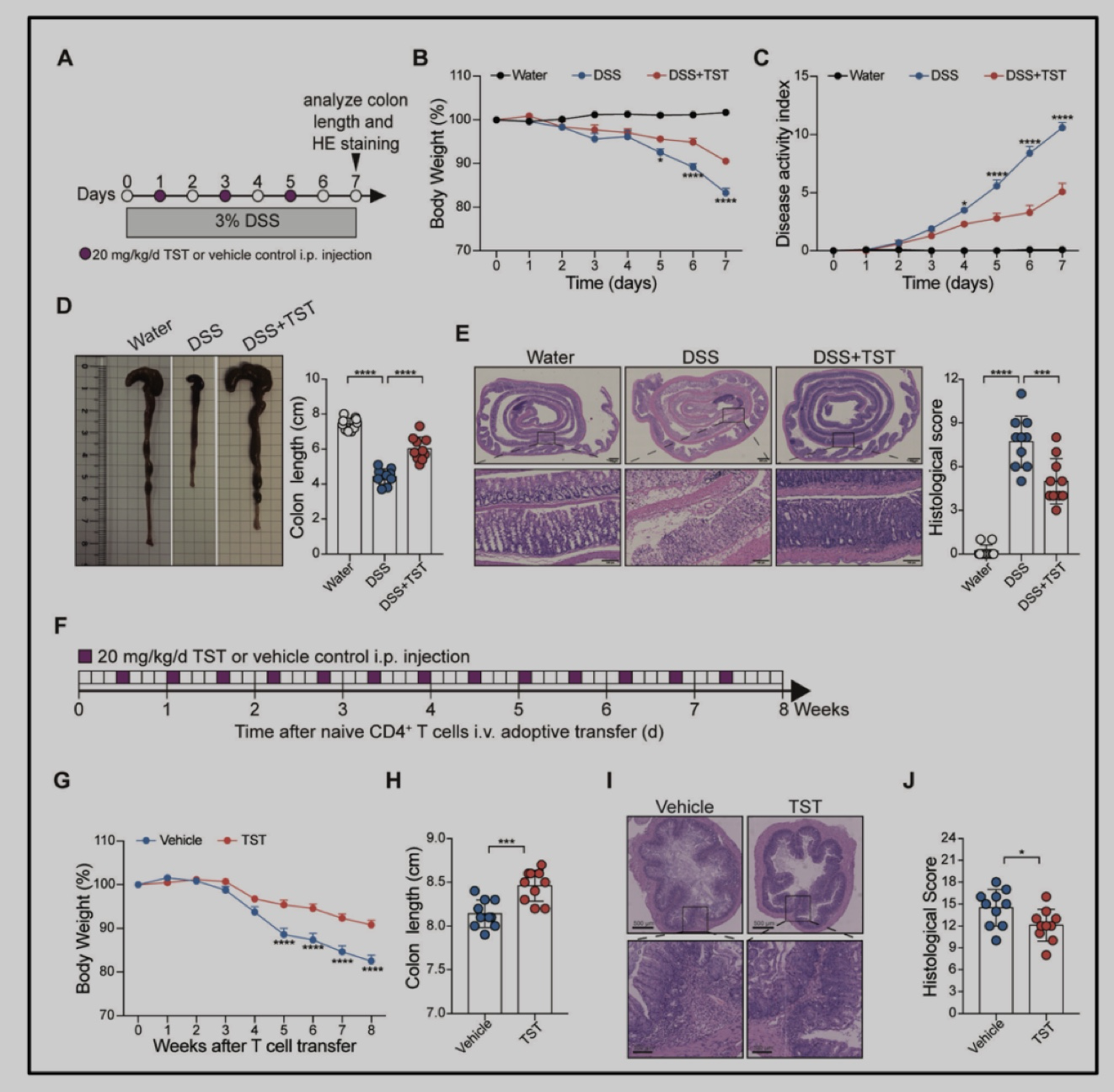
为了解抗生素TST在结肠炎中的作用,构建了葡聚糖硫酸钠(Dextran sulfate sodium, DSS)诱导和T细胞介导的小鼠结肠炎模型,对模型小鼠进行TST给药处理,发现在两种结肠炎模型中,对比对照组小鼠,TST处理组小鼠均表现出体重减轻放缓、结肠较长、组织病理评分较低等症状(图1)。此结果表明,TST能够治疗性缓解小鼠结肠炎症状。
图1. TST处理显著减轻DSS诱导和T细胞介导的结肠炎。
2. TST处理会抑制促炎因子IL-17A的产生,并下调RORγt+细胞比例
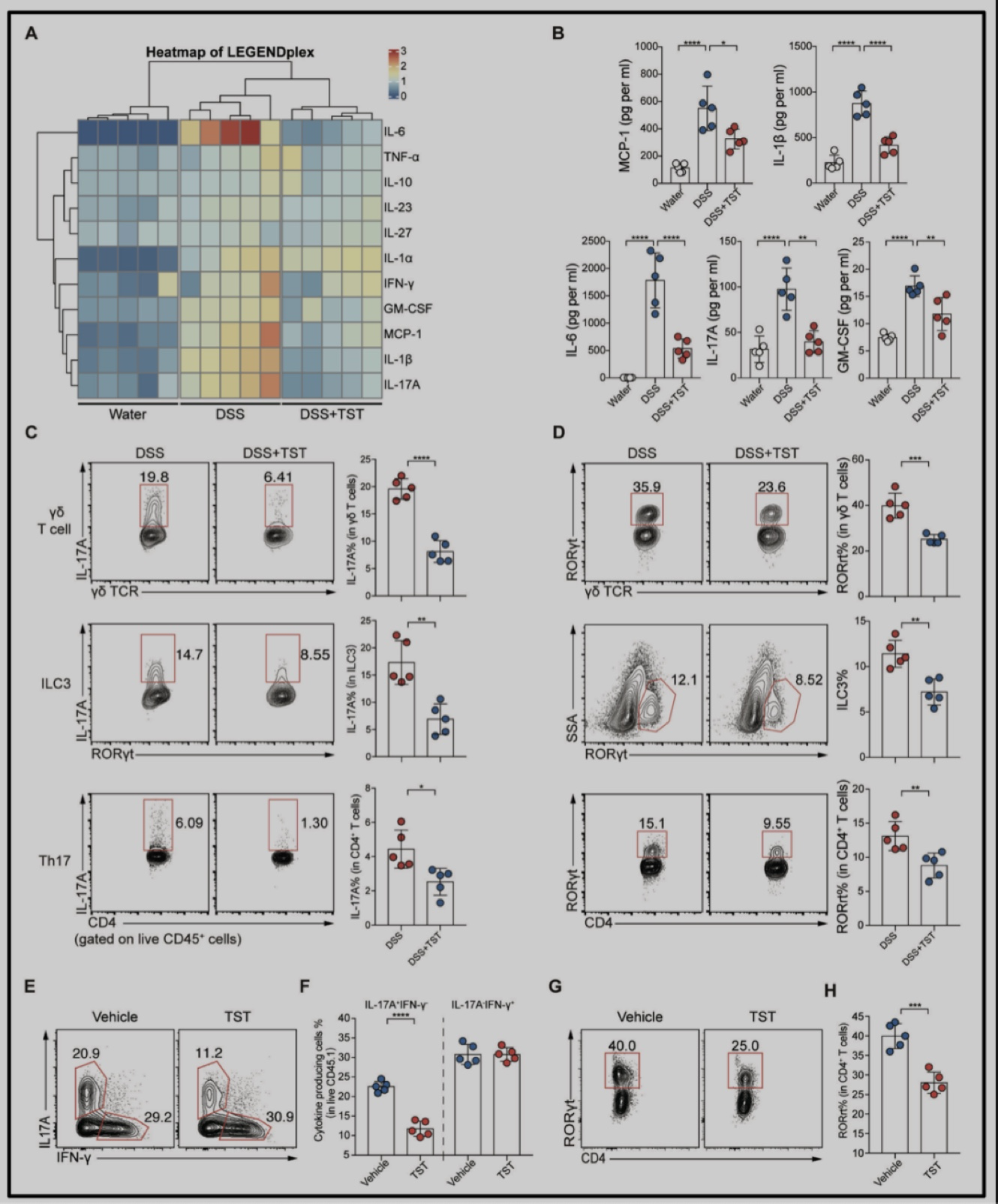
炎症因子的过度表达与肠道炎症疾病的恶化程度及IBD的临床症状密切相关,为了解TST如何发挥缓解结肠炎的作用,首先对结肠组织中炎症因子的表达进行检测,发现对比DSS处理组小鼠,TST处理组中IL-17A等结肠促炎细胞因子的水平显著降低(图2A-B);随后,通过多色流式对分泌IL-17A的免疫细胞亚群进行分析,发现与DSS组相比,TST处理会引起γδT细胞、3型先天性淋巴细胞ILC3以及Th17细胞减少,并使三群细胞中RORγt表达降低(图2C-H)。此结果说明,TST能靶向RORγt阳性免疫细胞,以限制IL-17A的来源。
图2. TST对RORγt的抑制导致分泌IL-17A的细胞减少。
3. TST通过增强RORγt和Itch的结合从而促进RORγt的泛素化降解
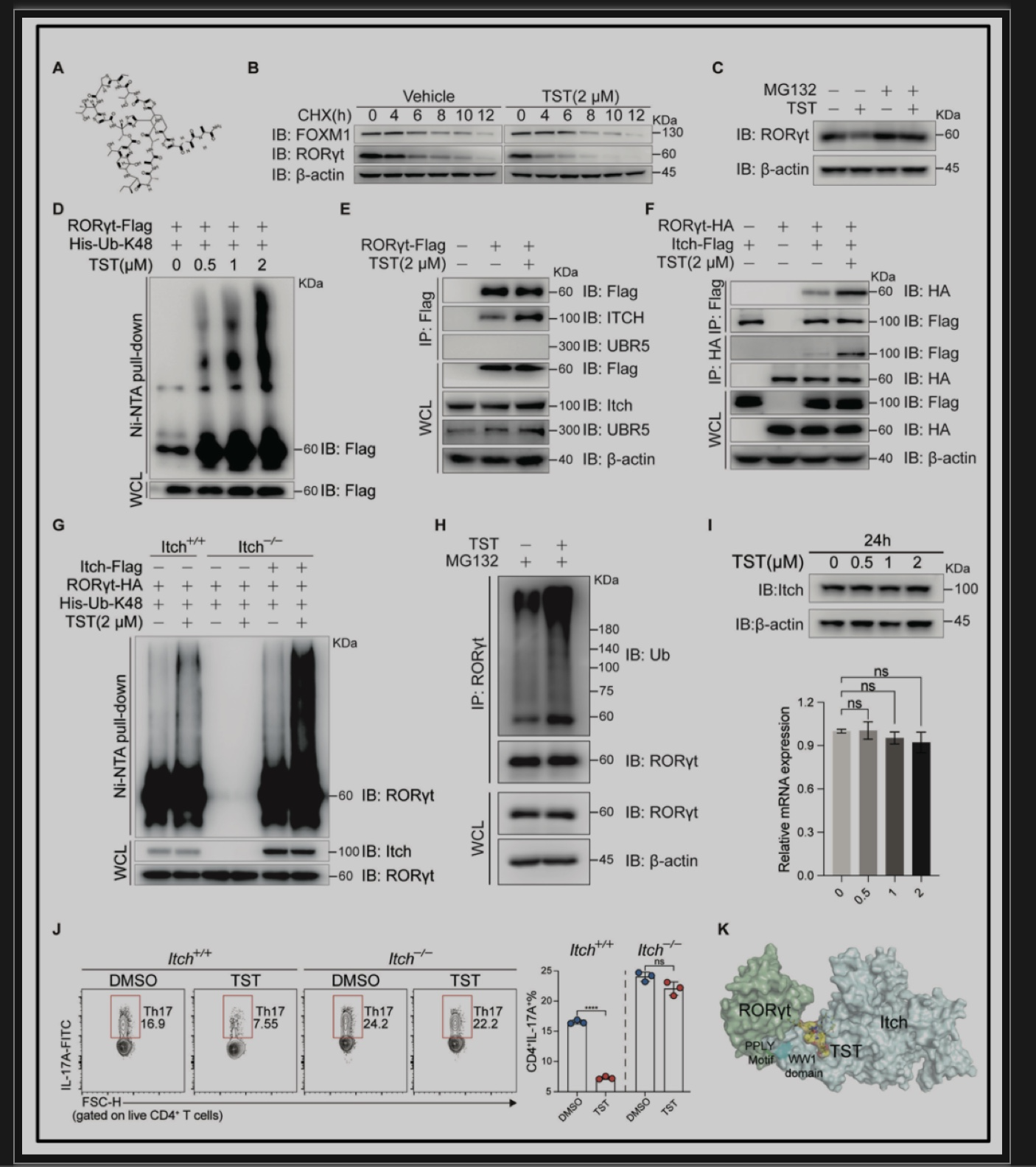
为深入探究TST如何降低RORγt蛋白表达的具体分子机制,首先对EL4细胞进行了蛋白质半衰期检测实验,发现TST能够缩短RORγt的半衰期,同时MG132可阻断TST介导的RORγt蛋白水平的下调,并且TST剂量依赖性的增加了RORγt的泛素化水平,说明TST可通过泛素化途径下调RORγt的蛋白表达(图3A-D)。随后,通过免疫共沉淀实验,发现TST可显著促进293T细胞中RORγt与Itch的结合;通过体外泛素化实验,发现Itch的缺失不仅会阻断RORγt的基础泛素化水平,还会阻断TST介导的RORγt泛素化水平增加(图3E-G);对Il17a-EGFP小鼠中CD45+EGFP+细胞进行的间接体内泛素化实验,近一步证实了TST可显著增加IL-17A产生细胞中RORγt的泛素化水平(图3H),以上结果说明,TST能够增强RORγt和Itch的结合来促进RORγt的泛素化降解。此外,分子对接模拟TST与RORγt-Itch二元蛋白复合体的结合模式(图K),也提示TST可能作为一种潜在的分子胶来降解RORγt。
图3. TST通过增强RORγt与Itch的结合来靶向促进RORγt的泛素化降解。
4. TST对结肠炎的保护作用部分依赖于肠道微生物群
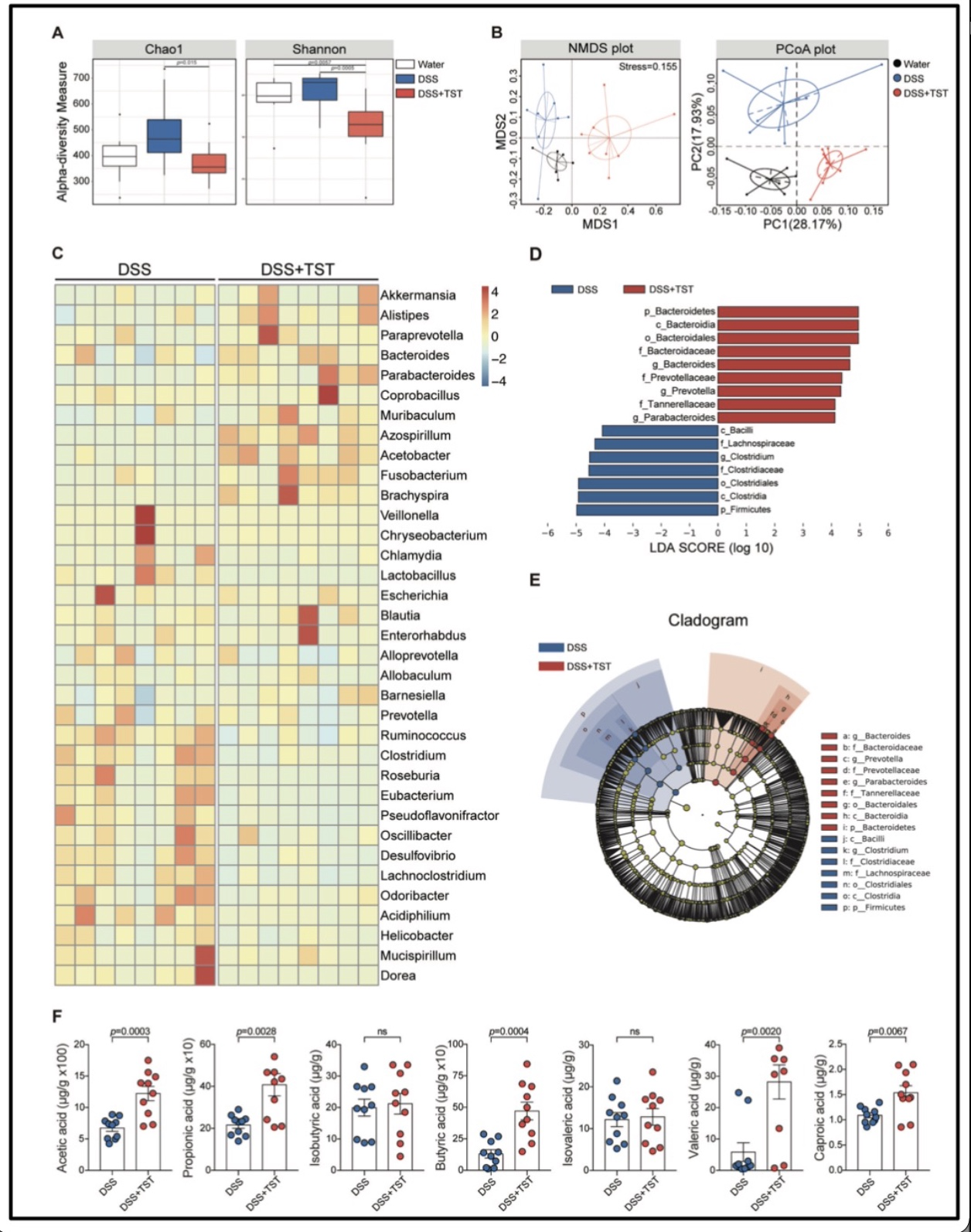
抗生素是肠道菌群的强效调节剂,为研究天然抗生素TST对结肠炎模型中肠道菌群多样性的影响,首先评价了微生物群落的多样性,发现对比DSS组小鼠,TST处理组中Chao1指数和Shannon指数显著降低(图4A),表明TST具有强效抗菌活性;在种水平上,发现对照组、DSS组和TST处理组小鼠肠道菌群在Beta多样性上具有显著性差异(图4B);随后,在属水平上发现TST处理会导致属水平菌群丰度发生变化(图4C);接下来,通过LEfSe进行高维度数据分析(选取LDA得分>4.8为截断值),发现对比对照组,TST处理会引起g_Bacteroides(拟杆菌属)、g_Prevotella(普雷沃氏菌属)和g_ Parabacteroides(副拟杆菌属)在肠道发生富集(图4D-E)。此外,通过对短链脂肪酸(Short-chain fatty acid, SCFA)的定量分析,发现对比DSS组,TST处理会使乙酸、丙酸、丁酸、戊酸和己酸水平显著增高。上述结果表明,TST提高了肠道微生物群控制结肠炎的能力。
图4. TST处理显著改变了肠道微生物群的组成和功能。
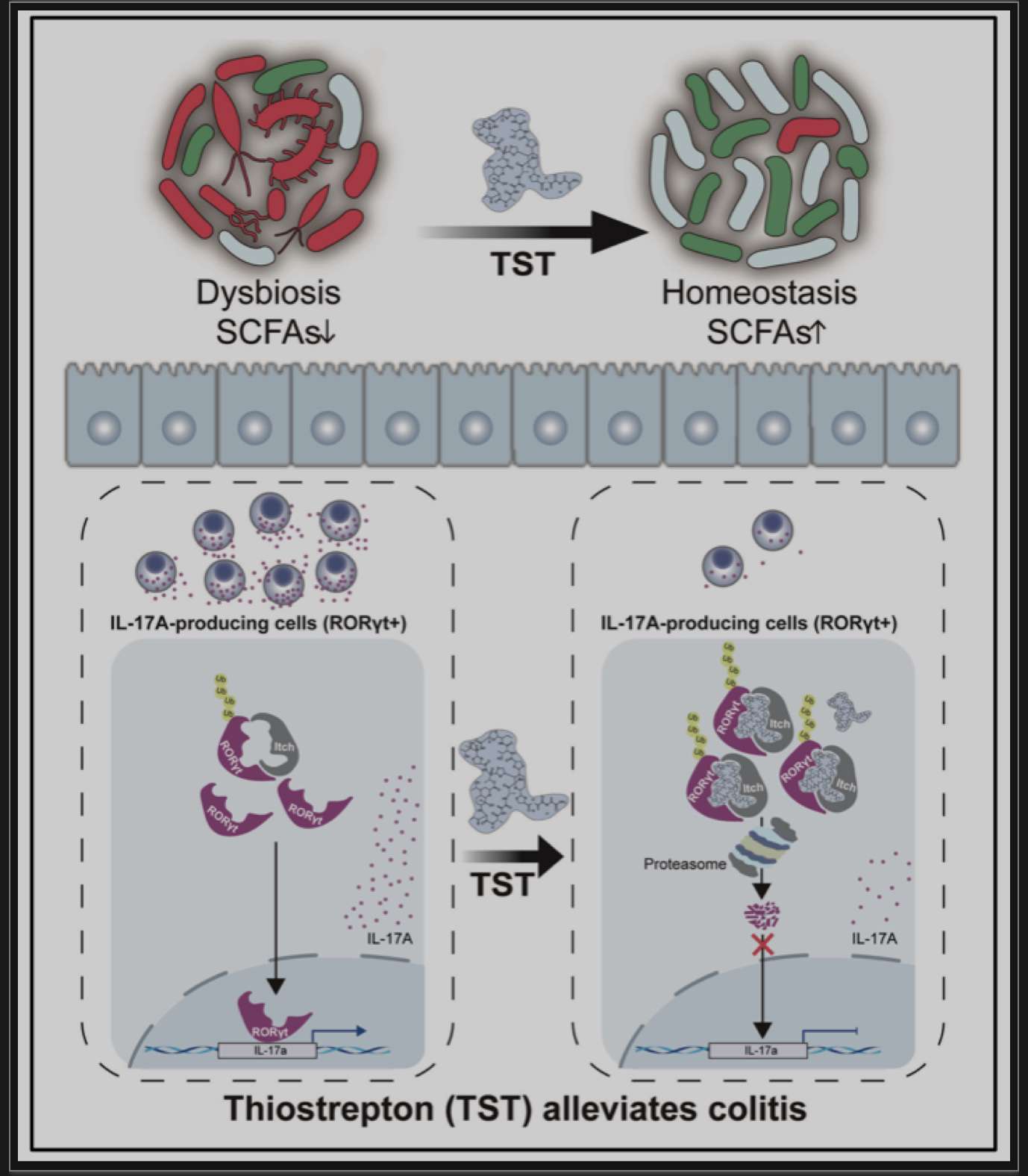
该研究首次证实了TST在保护小鼠免受实验性结肠炎侵袭方面发挥双重作用(图5)。首先,TST通过靶向RORγt进行泛素化和降解,发挥其直接免疫调节作用来抑制IL-17A的产生。此外,TST通过调节肠道微生物群失调,发挥其抗菌作用,改善DSS诱导的结肠炎。总之,尽管此项研究仅局限于小鼠结肠炎模型,但该研究仍表明TST有望在临床上成为治疗IBD的一种有前景的候选药物。