
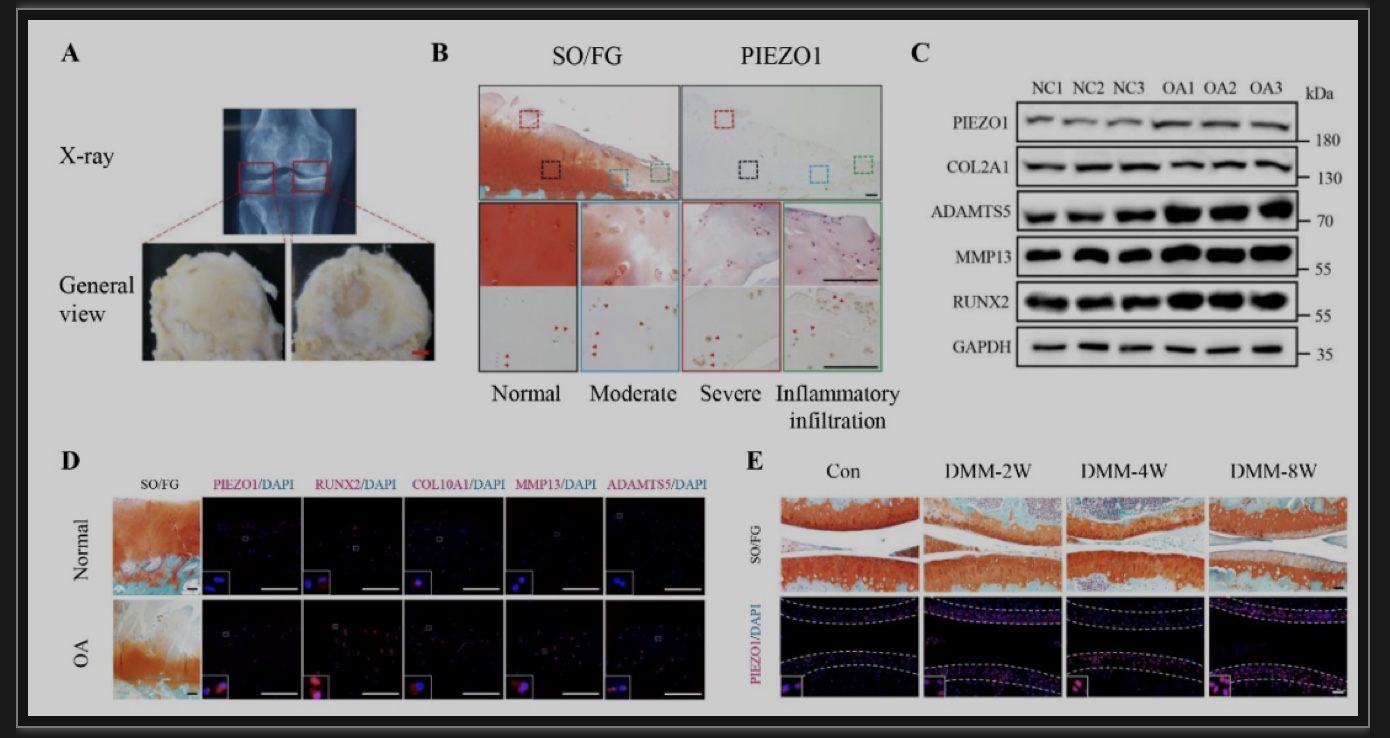
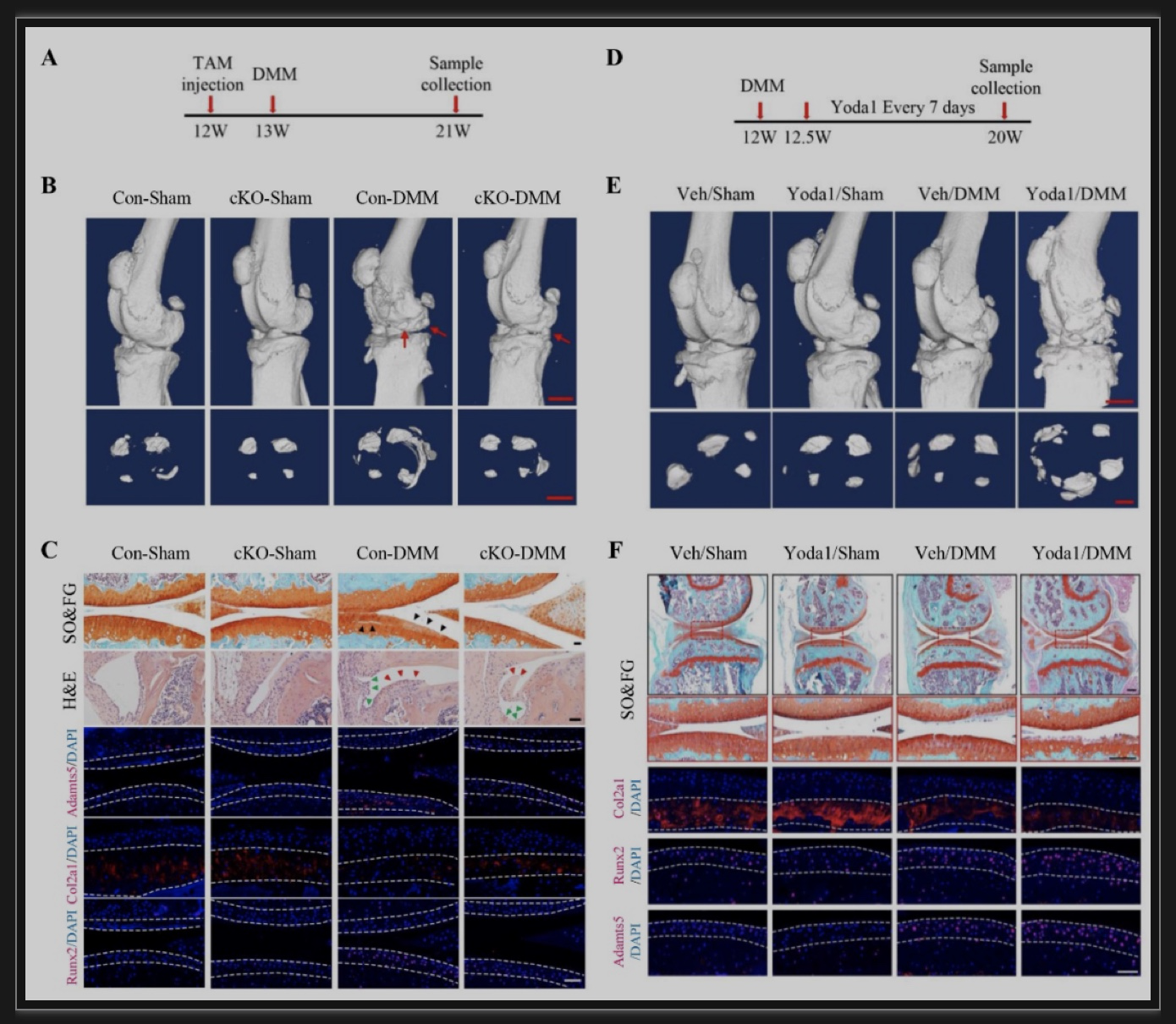
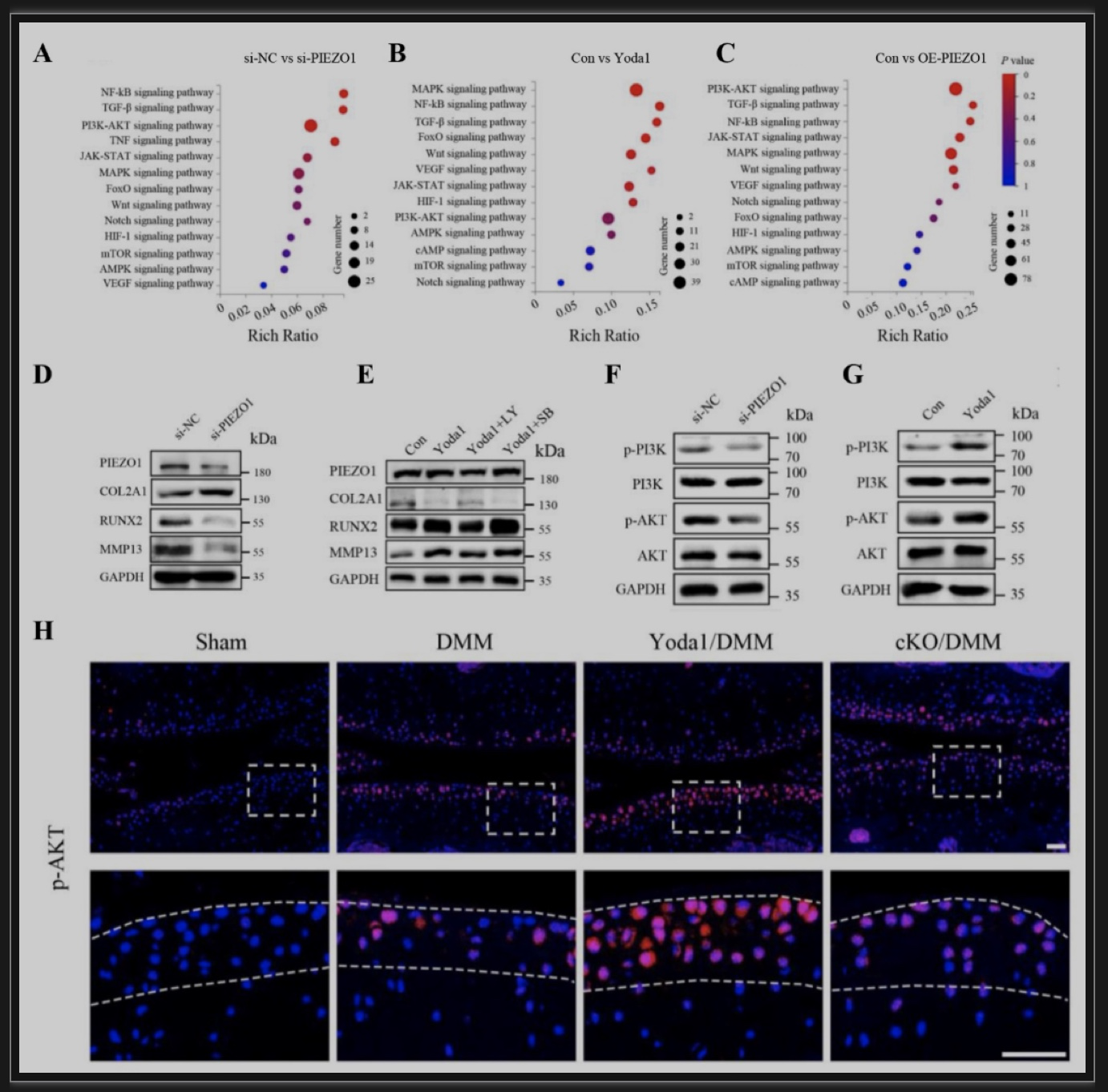
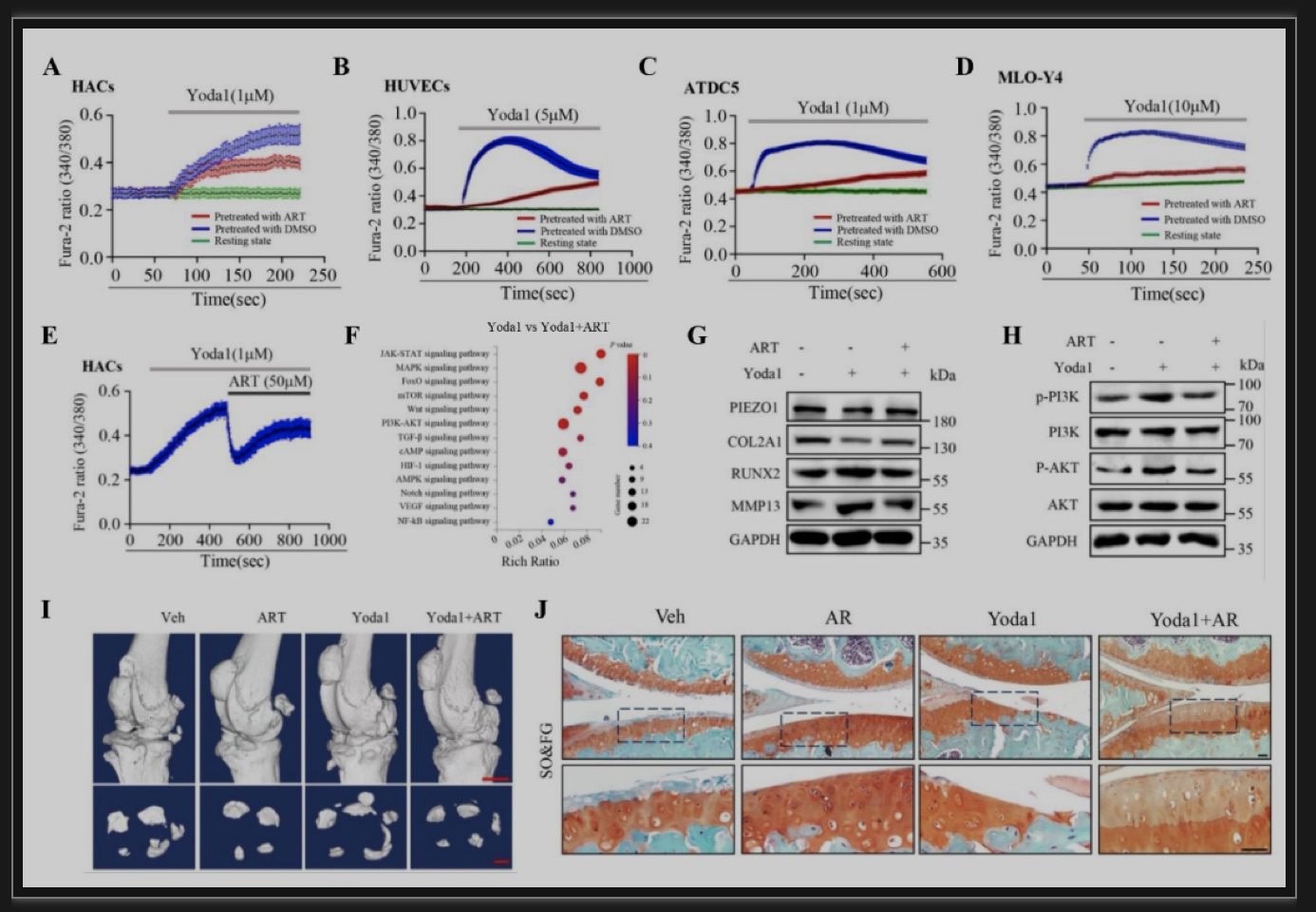
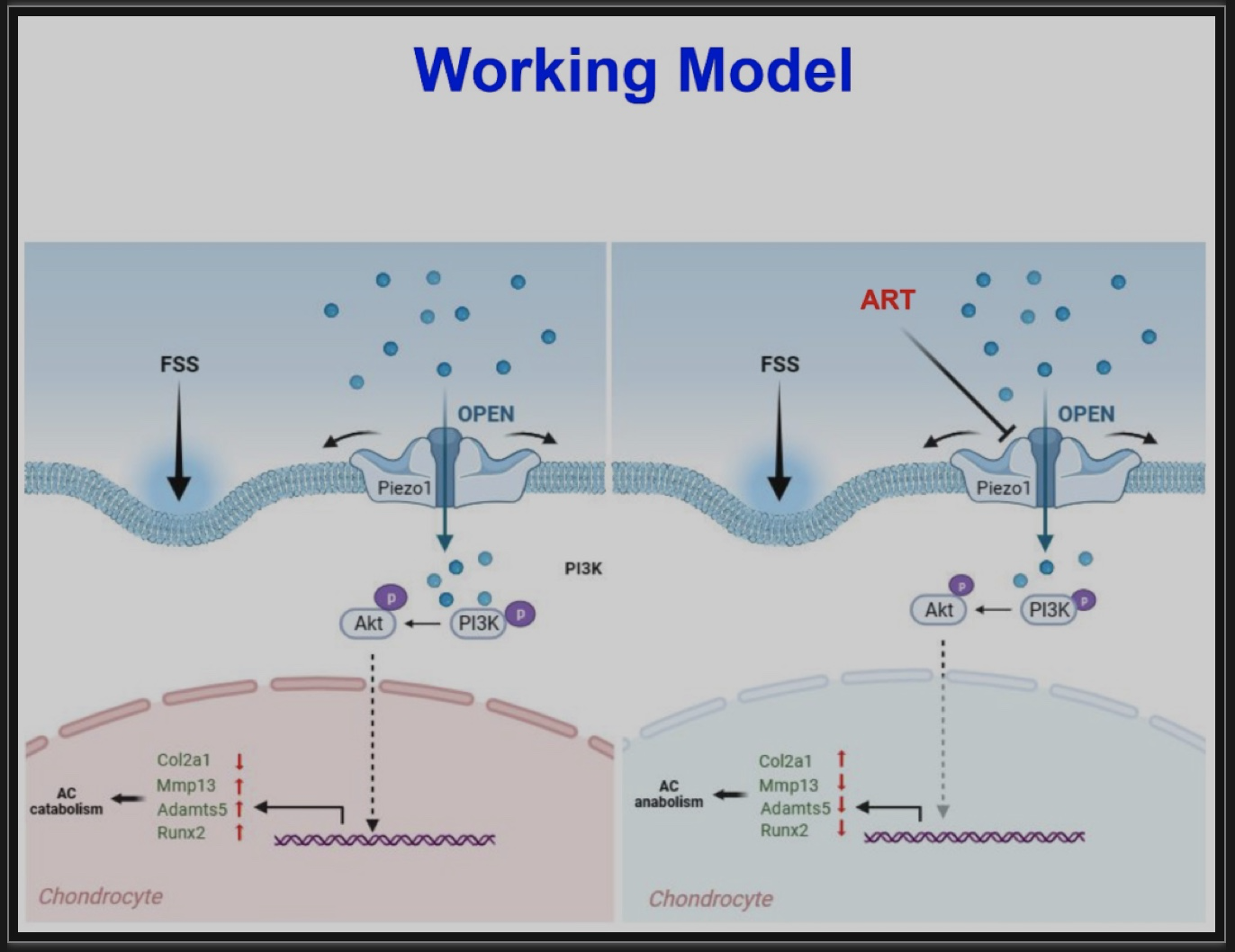
综上所述,该研究发现PIEZO1蛋白在人类OA软骨细胞中的表达极显著上调,然后使用遗传小鼠模型和合成的小分子激活剂证明了机械敏感通道Piezo1在促进OA发展和进展中的关键作用。关节软骨细胞中Piezo1表达的缺失可以显著防止DMM诱导的OA损伤,且大大降低了OA发病的关键分子Runx2及其下游Adamts5的表达水平。相反,膝关节腔内注射Yoda1对Piezo1的局部激活加剧了DMM诱导的小鼠OA损伤。进一步揭示了PIEZO1以PI3K-AKT依赖的方式调节原发性OA HACs中RUNX2和分解代谢酶的表达。表明调节PIEZO1的表达和激活可能是治疗OA的一种新策略,证实了ART通过抑制小鼠关节的Piezo1来预防OA损伤。此外,该研究发现在正常小鼠中,条件性缺失Piezo1或Piezo1激活不会引起OA病变。这可能表明Piezo1的激活可能只是OA发展的一个加重因素。在未来,研究在衰老相关或其他未行DMM的OA模型中,Piezo1激活是否影响OA病变将是一件有趣的事情。

