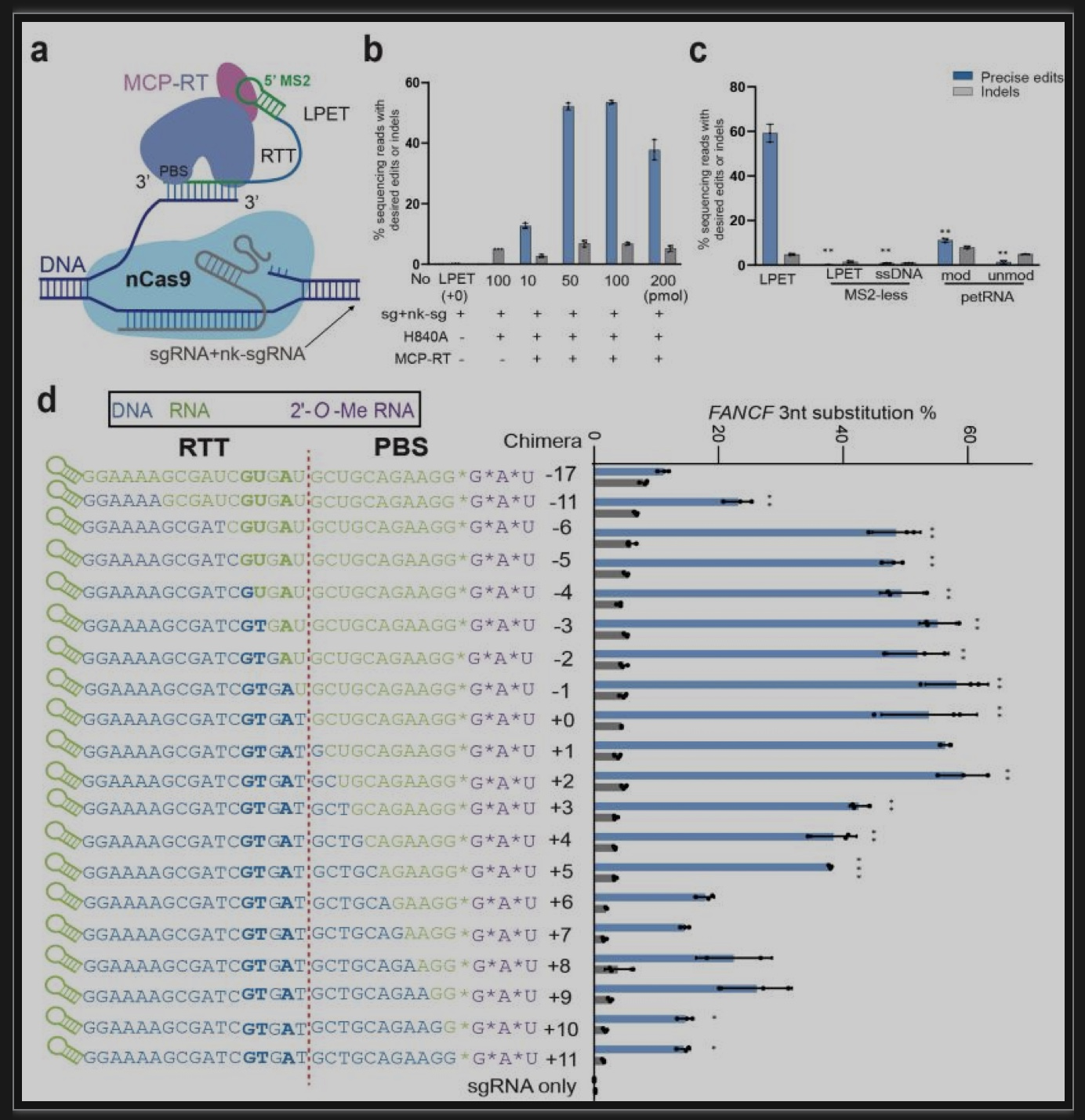

综上所述,本研究首次运用高保真Phi29 DNA聚合酶和DNA模板进行精确基因编辑。相对于逆转录酶,高保真DNA聚合酶能够极大降低了先导编辑潜在引入错误的可能性。同时使用含有DNA模板稳定且易合成,降低了成本,解决了传统的pegRNA化学合成困难的问题,进一步拓展了模块化先导编辑工具箱,为先导编辑非病毒载体的体内递送和临床应用开辟了新的方向。


综上所述,本研究首次运用高保真Phi29 DNA聚合酶和DNA模板进行精确基因编辑。相对于逆转录酶,高保真DNA聚合酶能够极大降低了先导编辑潜在引入错误的可能性。同时使用含有DNA模板稳定且易合成,降低了成本,解决了传统的pegRNA化学合成困难的问题,进一步拓展了模块化先导编辑工具箱,为先导编辑非病毒载体的体内递送和临床应用开辟了新的方向。