肝纤维化是由多种肝损伤引起的过度修复反应,已成为世界范围内肝脏相关疾病和死亡的主要原因之一。肝纤维化过程涉及多种肝脏细胞,如肝星状细胞(HSC)、肝实质细胞、巨噬细胞、内皮细胞和胆管细胞等。其中肝星状细胞是纤维化的主要效应细胞。在肝损伤的反应中,原本处于静息状态的肝星状细胞被炎症因子或肝脏微环境紊乱引起的持续氧化应激而激活。活化的肝星状细胞表现出增殖和迁移特性,并转化为肌成纤维细胞样细胞,分泌大量Ⅰ型和Ⅲ型胶原蛋白等胞外基质,引起纤维化。纤维化的调控机制尚未完全了解清楚,从而限制了抗纤维化药物的发展。到目前为止,临床上还没有抗纤维化药物获得批准。 NPM (nucleophosmin,核磷蛋白)是一种主要定位在核仁的磷酸化蛋白,在增殖细胞中广泛表达。NPM的细胞功能主要是促进增殖、调控分化并抑制程序性细胞死亡,因而NPM的高表达与肝癌在内的多种恶性肿瘤进展有关。目前NPM与肝纤维化过程之间的相关性尚未有报道。该研究首次发现高表达的NPM蛋白通过多种途径促进了肝纤维化的进展。
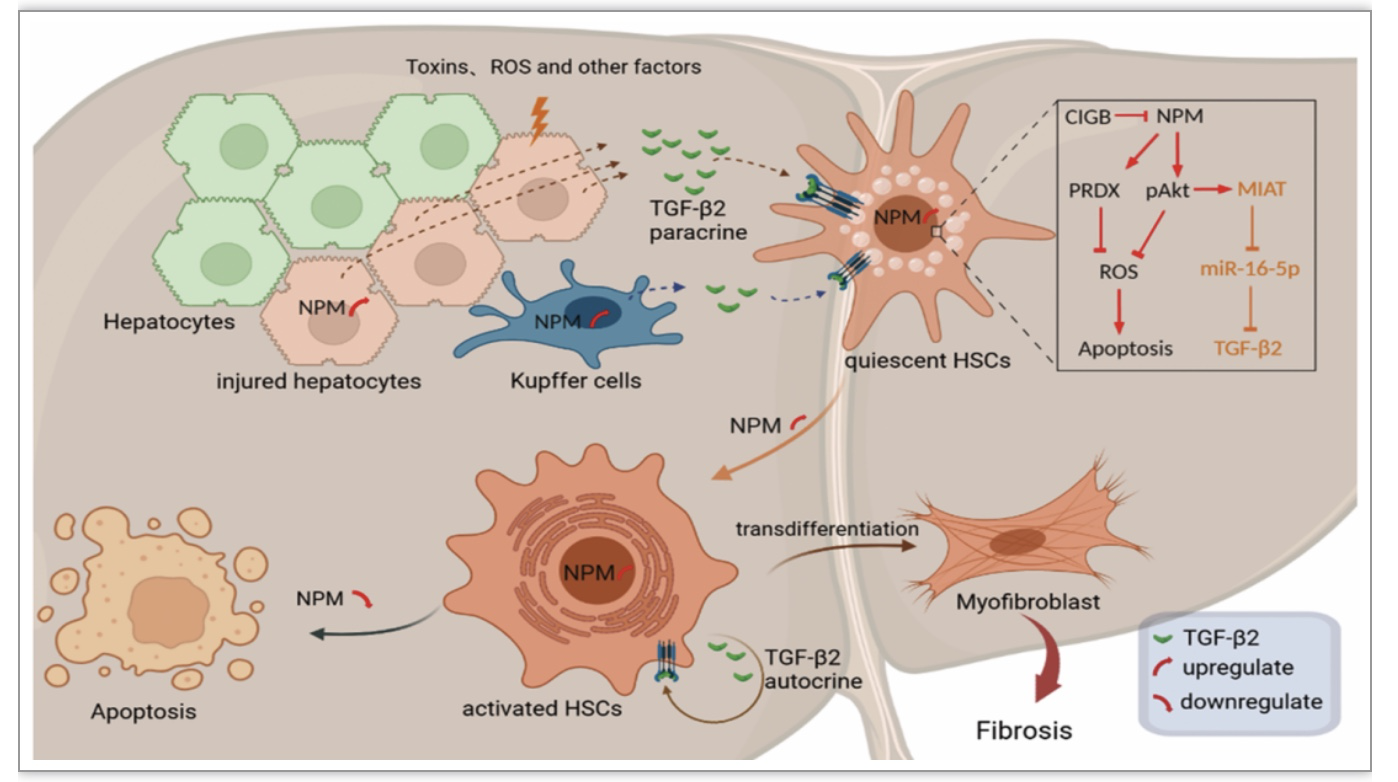
该研究首先通过分析人肝病组织芯片、原代分离培养的肝星状细胞和永生化的肝星状细胞系LX-2,证实了NPM在纤维化肝组织和活化的肝星状细胞中高表达。而NPM在肝星状细胞中的沉默或NPM抑制剂处理,显著降低肝纤维化标志物α-SMA、I型胶原和MMP9的表达。动物实验证实,靶向小鼠肝星状细胞敲低NPM表达,或者用NPM抑制剂CIGB300处理四氯化碳诱导的纤维化小鼠,可显著抑制肝纤维化的进展。在机制上,研究证实了NPM不仅通过Akt/ROS途径抑制肝星状细胞凋亡,还通过Akt诱导的非编码RNA分子MIAT上调TGF-β2表达,从而促进肝纤维化。研究还证实了在肝星状细胞中MIAT通过竞争性吸附miR-16-5p上调TGF-β2 mRNA水平。在肝损伤后,肝实质细胞、Kupffer细胞和肝星状细胞上调NPM,分别增加了TGF-β2的表达,以旁分泌或自分泌的方式进一步激活肝星状细胞,导致肝纤维化加重。
NPM在肝组织中各类细胞中广泛表达,在肝纤维化过程中受到多种因素的上调。在肝星状细胞(HSC)中上调的NPM,通过激活Akt信号通路和上调抗氧化蛋白PRDX表达,进一步下调ROS水平并抑制ROS诱导的凋亡,从而促进HSC活化和胶原分泌。此外,NPM通过Akt上调非编码RNA分子MIAT,从而通过竞争性吸附miR-16-5p而促进TGF-β2的表达和分泌。TGF-β2来源于损伤的肝细胞、Kupffer细胞和HSC,通过旁分泌或自分泌方式激活HSC的增殖和胶原分泌,促进肝纤维化过程。CIGB300是NPM Ser125位点磷酸化的抑制剂,可抑制Akt并上调HSC的凋亡,从而抑制肝纤维化的进展。
综上所述,该研究揭示高表达的NPM蛋白具有促进肝纤维化的作用,这一作用是通过抑制肝星状细胞凋亡和上调TGF-β2分泌实现的,而抑制NPM表达或应用NPM抑制剂CIGB300可显著减轻肝纤维化。因此该研究结果提示:NPM是治疗肝纤维化的潜在新药靶点。另一方面,考虑到NPM在肝脏不同细胞表达丰度的巨大差异(例如NPM在Kupffer细胞和血源细胞中高丰度表达)和信号通路的细胞特异性,NPM促肝纤维化作用的主要效应细胞尚未定论,在肝星状细胞中揭示的分子调控通路是否在Kupffer细胞同样起作用尚有疑问,NPM是否通过胆管反应影响纤维化过程等问题尚待深入研究。这些问题的阐明和NPM抑制性药物的开发,必将有助于肝纤维化的临床治疗与药物研发。