背景介绍
IAV促进 SARS-CoV-2 病毒的传染性
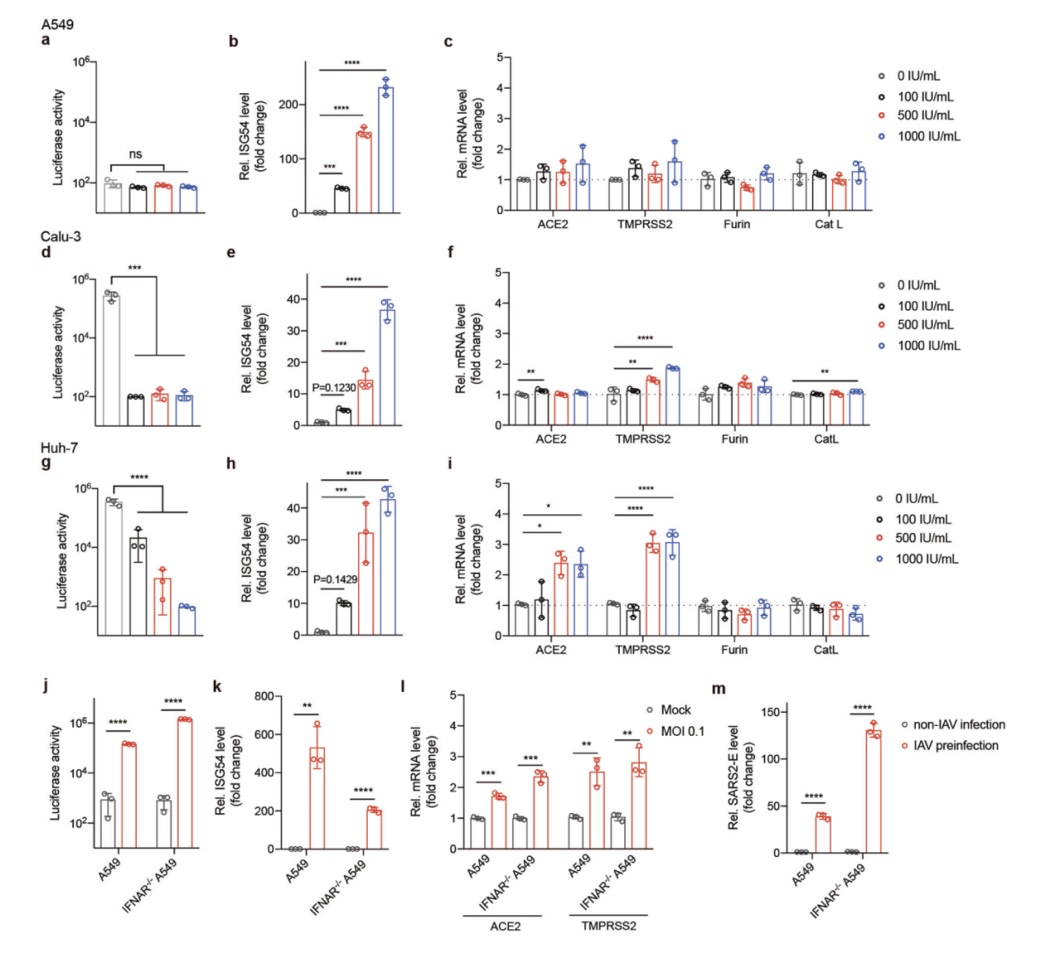
为了研究 IAV与SARS-CoV-2 之间的相互作用,作者用 A549(一种低三倍体肺泡基底上皮细胞株)细胞对 IAV感染敏感,但通常不支持SARS-CoV-2 感染,检测 IAV预感染是否会调节SARS-CoV-2 的传染性。使用带有 SARS-CoV-2 刺突蛋白(伪 SARS-CoV-2)的假型VSV 荧光素酶报告颗粒来观察病毒进入。 细 胞 先 感 染 IAV(A/WSN/1933(H1N1))或模拟感染 6 h、12 h、24 h,然后再感染伪SARS-CoV-2 病毒24 h(实验方案如图1a 所示)。图1b数据显示,A549细胞在感染 IAV后对伪SARS-CoV-2 病毒高度敏感(高达1万倍),相比之下,IAV预感染对携带VSV- g 蛋白的假型VSV颗粒无影响(图1c)。 作者进一步测试了更多的细胞株,结果显示 IAV增强伪 SARS-CoV-2 的传染性是一种普遍效应,尽管程度不同(图1d)。为了验证上述结果,作者将伪 SARS-CoV-2 替换为活SARS-CoV-2(实验方案如图 1e 所示)。作者发现,在 A549 细胞裂解液(~12- 58倍)和上清液(~10- 15倍)中,IAV预感染显著增加了SARS-CoV-2 基因组(E(包膜)和N(核衣壳)基因)的拷贝数(图 1f)。值得注意的是,在 Calu-3(图 1g)和NHBE(图 1h)细胞中,天生对SARS-CoV-2敏感的细胞,IAV预感染进一步使SARS-CoV-2的传染性提高了> 5倍。
总的来说,这些数据表明,在广泛的细胞类型中,IAV 对SARS- CoV-2具有辅助作用。
IAV 和 SARS-CoV-2 联合感染对感染小鼠的病理影响更为严重
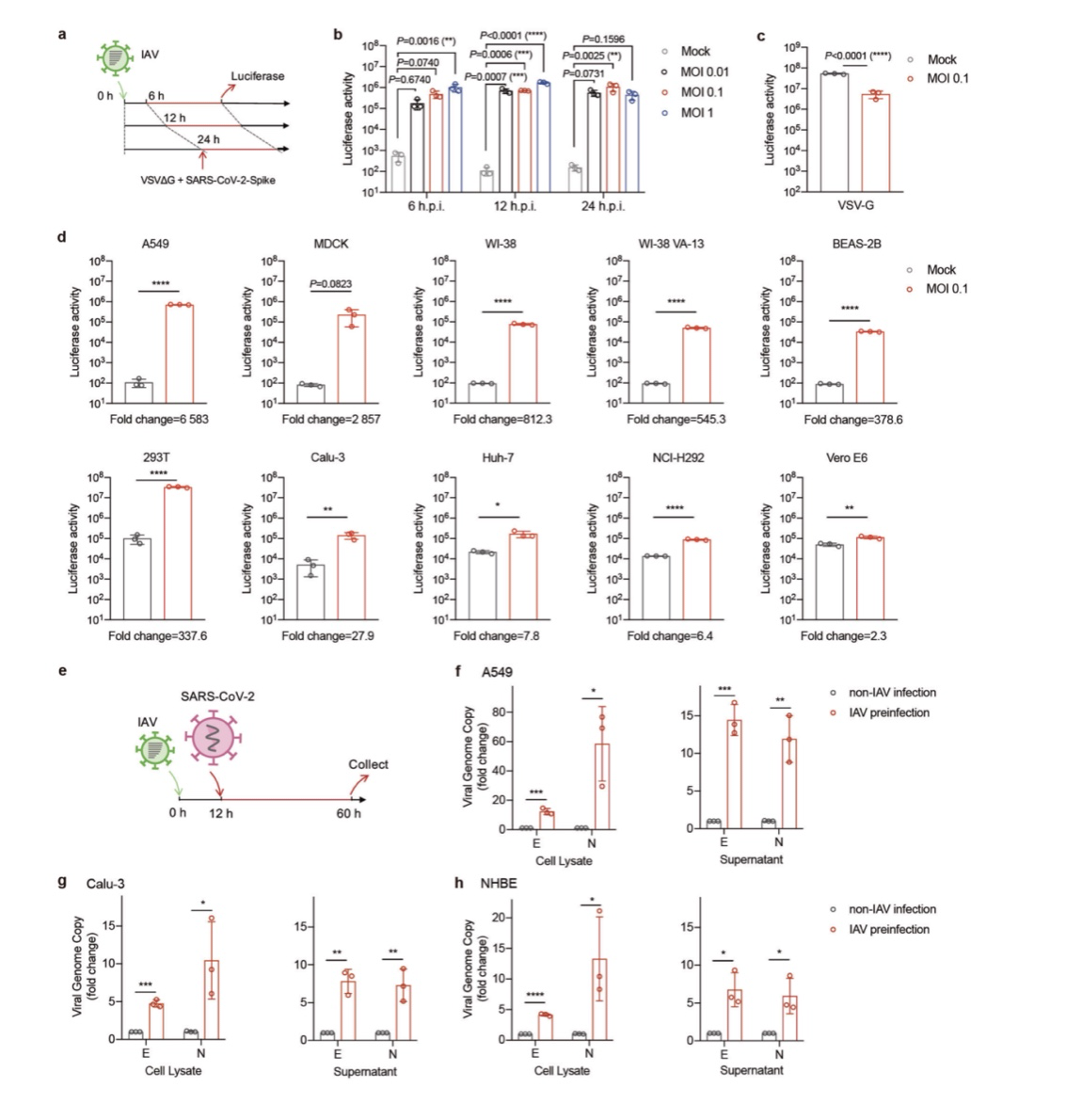
在小鼠中,IAV和SARS-CoV-2 合并感染导致 SARS-CoV-2 病毒载量增加和更严重的肺损伤
采用K18-hACE2 转基因小鼠在体内研究 IAV与SARS-CoV-2的相互作用。小鼠感染 3 × 105 SARS-CoV-2的PFU预感染或未预感染 2000个 IAV的PFU后,在感染后 2天处死(实验方案如图2a所示)。从图2b的数据可以看出,各组小鼠感染后 4 天内体重(d.p.i.)无显著差异。从肺匀浆中复制的病毒RNA基因组证实SARS-CoV-2有效感染两组(超过4 × 10)9 N个基因拷贝)(图2c)。相比之下,流感NP基因仅在IAV感染前组检测到(图2d左)。有趣的是,与SARS-CoV-2单感染小
鼠相比,共感染小鼠的肺匀浆中 SARS-CoV-2病毒载量显著增加(图2d中,E基因增加12.9倍;图2d右,N基因增加6.6倍)。图2e肺组织学资料进一步显示,与 SARS-CoV-2 单次感染或模拟感染相比,IAV和 SARS-CoV-2 联合感染引起的肺病理改变更为严重,有大量细胞浸润和明显的肺泡坏死。
IAV特异性促进SARS-CoV-2感染
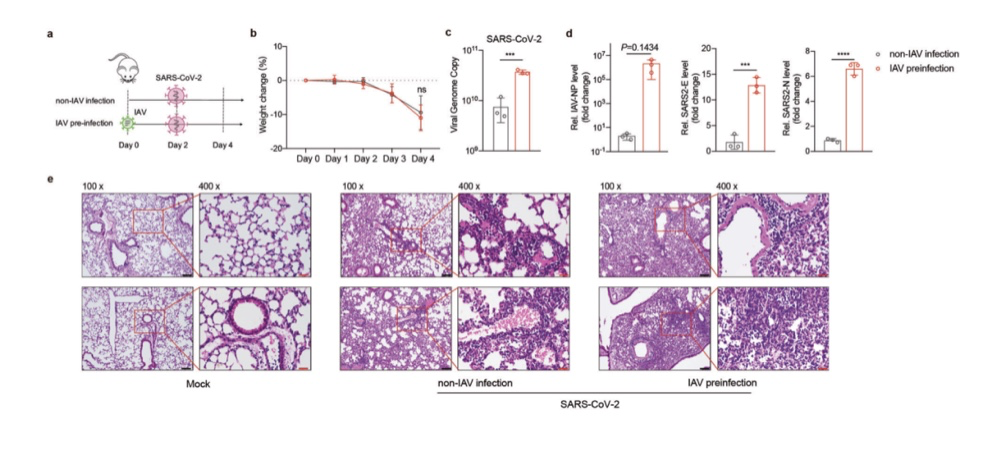
作者进一步检测了其他几种呼吸道传播病毒是否对 SARS-CoV-2感染有类似的促进作用。A549 细胞分别感染人呼吸道合胞病毒(HRSV)、人副流感病毒(HPIV)和人鼻病毒 3 (HRV3)的 SARS-CoV-2。令人惊讶的是,HRSV(图 3a)、HPIV(图 3b)和HRV3(图3c)在低、高感染剂量下均不能刺激伪 sars - cov -2 感染HRSV、HPIV和HRV3 的病毒基因定量保证了这些病毒在感染
后 12 小时的有效感染(h.p.i.)(图 3d-f)。活的 SARS-CoV-2 病毒结果也显示 HRSV(图 3g)、(图 3h)或HRV3(图 3i)感染前未诱导。再次,从HRSV、HPIV 和HRV3 中提取的病毒基因在 hpi 为 60时被定量,以确认这些病毒的充分感染(图 3j-l)。综上所述,这些数据表明,与 HRSV、HPIV 和HRV3 相比,IAV具有促进伪
sars - CoV-2和活 sars - CoV-2 感染的独特特征。
IAV感染诱导ACE2表达升高
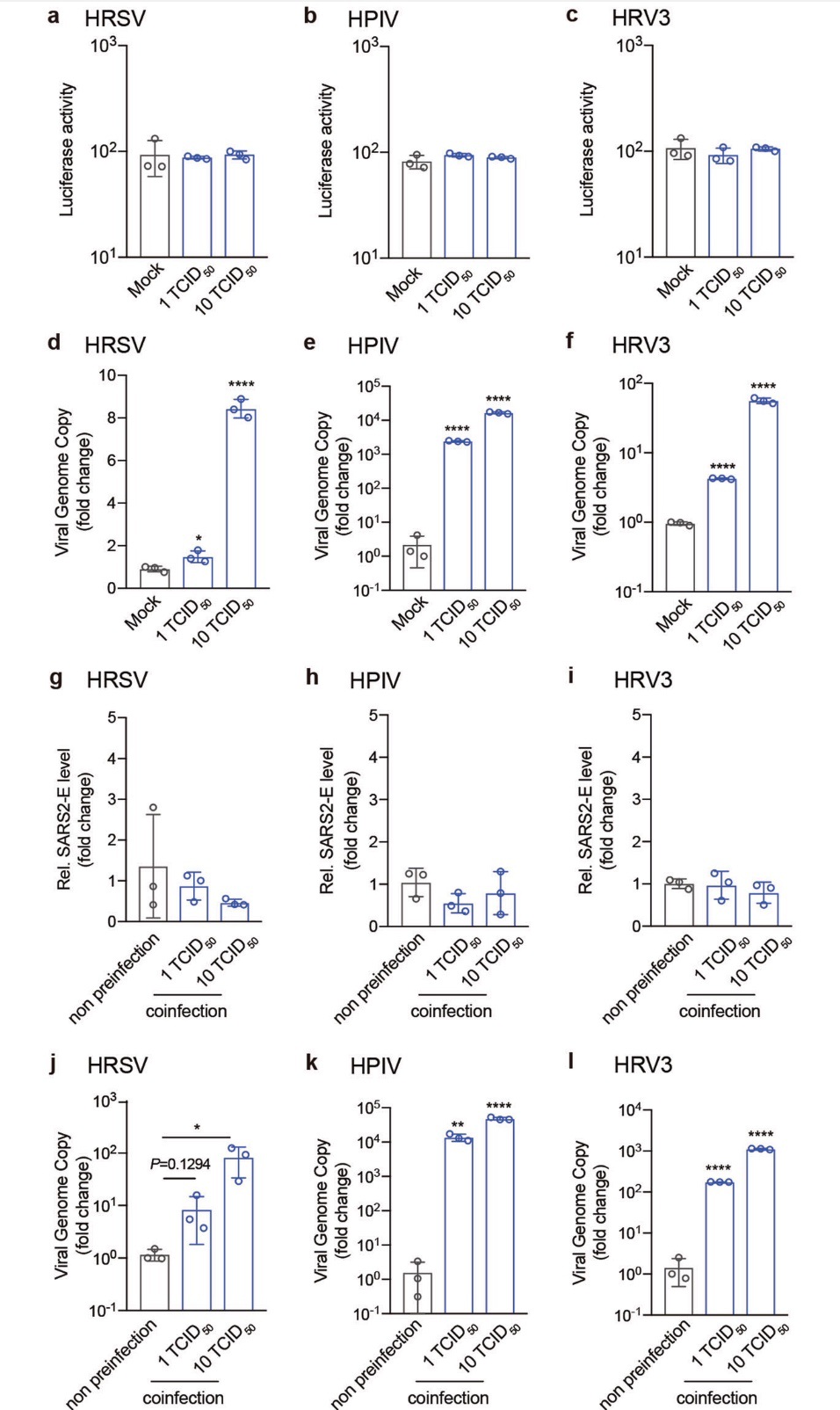
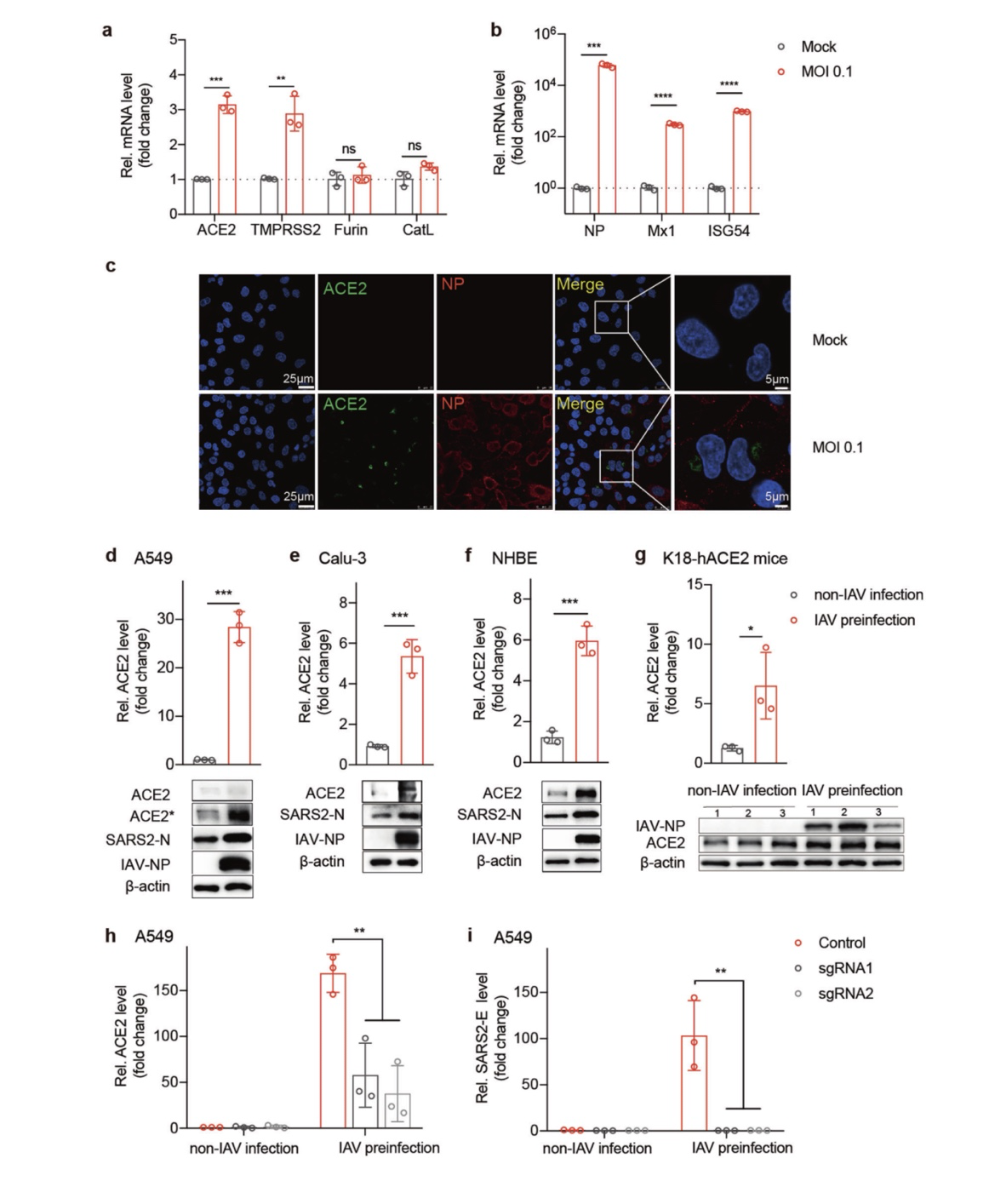
由于 IAV强烈增加伪 SARS-CoV-2 感染,作者检测了病毒进入过程。据报道,细胞受体血管紧张素转换酶2 (ACE2)以及跨膜丝氨酸蛋白酶 2 (TMPRSS2),呋喃 组织蛋白酶 L(CatL), 介导SARS-CoV-2 病毒进入。在 iav 感染的细胞中,作者发现ACE2 和TMPRSS2 的mRNA水平,而不是 Furin 和CatL 的 mRNA 水平,大约增加了 3 倍(A549 细胞,见图4a)。iav后12小时,细胞内ACE2表达的明显开关被触发感染(图 4c)。此外,流感 NP、mx 和 ISG54 相应增加,证实IAV感染成功(图4b)。有趣的是,在 IAV 和SARS-CoV-2 共感染细胞中,ACE2mRNA水平增加更显著,A549 细胞中 ACE2 mRNA水平增加 28倍细胞(图 4d), Calu-3 细胞增加 5 倍(图 4e), NHBE 细胞增加 6倍(图4f)。在合并感染小鼠的肺匀浆中,ACE2的mRNA和蛋白水平也相应升高(图4g)。作者进一步检测了ACE2的表达。数据显示,这些病毒 ( 不能促进 SARS- CoV-2 感染 ) 对ACE2、TMPRSS2、Furin 和 Cat L 的表达没有影响(补充信息,图S3)。当细胞被编码 ACE2- sgrna(小向导RNA)的慢病毒转导,抑制ACE2的表达(图4h)时,iav介导的SARS-CoV-2感染的增强被完全消除(图4i)。
这些数据表明,IAV允许SARS-CoV-2感染的增加主要是通过上调ACE2的表达。
增强的 SARS-CoV-2 感染与 IFN信号无关。
ACE2 在人气道上皮细胞中是一种干扰素(IFN)刺激基因(ISG)。IAV感染也刺激 I 型IFN信号通路。因此,作者检测了 ACE2 表达的增加是否依赖于 IFN。首先用不同剂量的IFNα(图 5)和 IFNγ(补充信息,图 S4a-c)预处理细胞,然后感
染伪 SARS-CoV-2 。数据显示,IFNα 不促进伪 SARS-CoV-2 在A549细胞中的感染性(图5a),
但对 Calu-3 细胞(图 5d)和 Huh-7 细胞(图 5g)的伪 SARS-CoV-2 感染具有明显的抑制作用。与 ISG54 的mRNA 水平相比(图5b, e, h),在IFN的作用下,ACE2和TMPRSS2的mRNA水平
仅轻度升高约 1- 3倍(图 5c, f, i)。这些数据表明,在这些细胞中,ACE2对IFN没有强烈的反应,这反过来说明 ACE2介导的病毒进入不受外源 IFN的影响。此外,在 IFNAR - / - A549 细胞中,伪 sars - cov -2 在IAV合并感染下的传染性增强是完整的(图5j)。与IFNAR - / - A549 细
胞中 ISG54水平下降相比(图 5k;补充信息图 S4d), IFNAR - / -A549 细胞在 IAV 感染下 ACE2 和 TMPRSS2 的 mRNA 水平仍然升高(图 5l)。此外,在IFNAR - / - A549细胞中,活的SARS-CoV-2 在IAV共感染下的传染性再次增强(图5m)。这些结果强烈表明,SARS-CoV- 2 对 IAV感染有应答,而不是内源性 IFN信号,有利于病毒感染。