人生在世,难免会有各种压力,而有压力就有应激,人体内也有相应的调控机制。但奇点糕还真没想到,主管应激反应的交感神经通路,竟然还会用同一条路径,给努力抗癌的CD8+T细胞们“上压力”啊。
今天登上《自然》的一项最新研究就显示:交感神经可通过分泌去甲肾上腺素,作用于CD8+T细胞表面的肾上腺素能受体β1(ADRB1),加速T细胞在慢性感染和癌症中的耗竭,因此ADRB1也是免疫检查点,而未来将β受体阻滞剂与现有免疫检查点抑制剂联合使用,有望实现协同增效、破解治疗耐药[1]。

论文首页截图
CD8+T细胞表面的肾上腺素能受体,很早就引起了学界的注意,不过既往研究大多认为,交感神经只能通过肾上腺素能受体,对CD8+T细胞间接施加影响[2],但开展本次研究的Salk研究所团队并不这么想。
研究团队专门分析了脑膜炎病毒模型小鼠(LCMV病毒)体内,因长期慢性感染而处于终末耗竭状态的CD8+T细胞,ADRB1就是这部分细胞内表达显著上调的基因,且表达水平比病毒急性感染期还高。
其它肾上腺素能受体的表达,则都不存在与ADRB1相似的模式,说明ADRB1显然与CD8+T细胞的耗竭关系匪浅。来自HIV感染者的数据也显示,CD8+T细胞的ADRB1表达水平,往往与耗竭标志物(如PDCD1)成正比。
而在分析耗竭CD8+T细胞的空间分布时,研究团队看到在慢性感染小鼠的脾脏,以及胰腺癌和非小细胞肺癌模型小鼠中,耗竭CD8+T细胞的分布都更接近交感神经。那么交感神经的调节,是不是压垮CD8+T细胞的那根稻草呢?
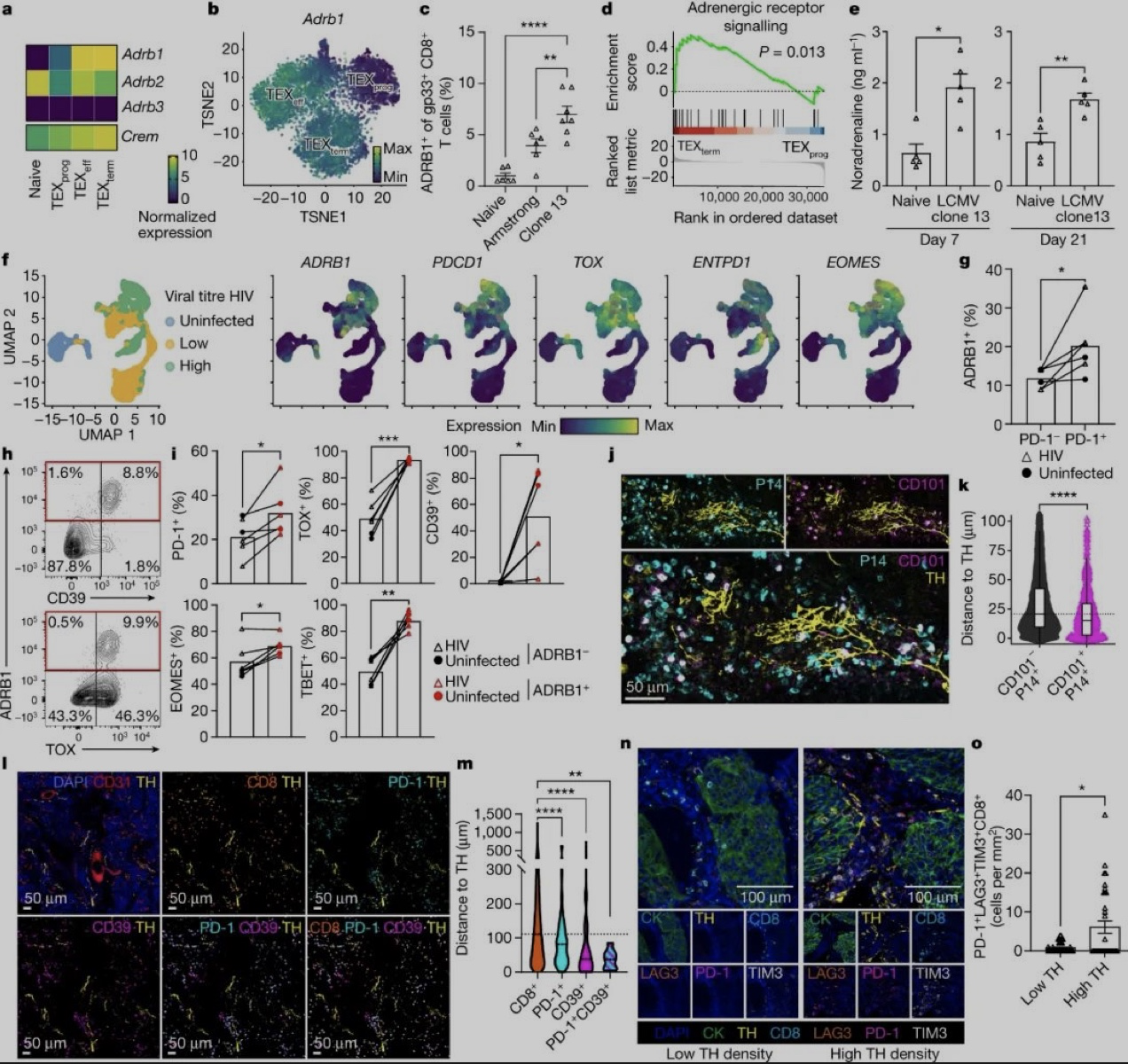
耗竭CD8+T细胞的ADRB1表达显著上调,且空间分布更接近交感神经
为了分析交感神经和ADRB1的作用,研究团队使用逆转录病毒使CD8+T细胞过表达ADRB1,CD8+T细胞增殖和释放细胞因子的能力随即下降,这两条特征也正是T细胞耗竭的典型表现,而调控这一进程的是cAMP-cREM信号轴,它们会在去甲肾上腺素与ADRB1结合后,加速CD8+T细胞向终末耗竭状态的分化。
过表达ADRB1会加速耗竭,敲除ADRB1起到的作用则恰好相反:敲除掉小鼠的ADRB1基因,就使病毒感染7天后终末耗竭T细胞的占比显著减少,小鼠免疫系统控制感染的能力也更好,起到“预防”耗竭的作用;而且,CD8+T细胞还会“自觉”地远离交感神经,不再被交感神经信号摆布而进入耗竭状态。
在敲除ADRB1表达的基础上,再使用PD-1抑制剂还能“锦上添花”,进一步增强免疫细胞的战斗力;换成癌症模型小鼠,被敲除ADRB1+PD-1抑制剂处理所强化的,就是以CD8+T细胞为代表的肿瘤浸润淋巴细胞们了。而用β肾上腺素能受体阻滞剂阿替洛尔处理,也能起到与敲除ADRB1表达相似的作用。
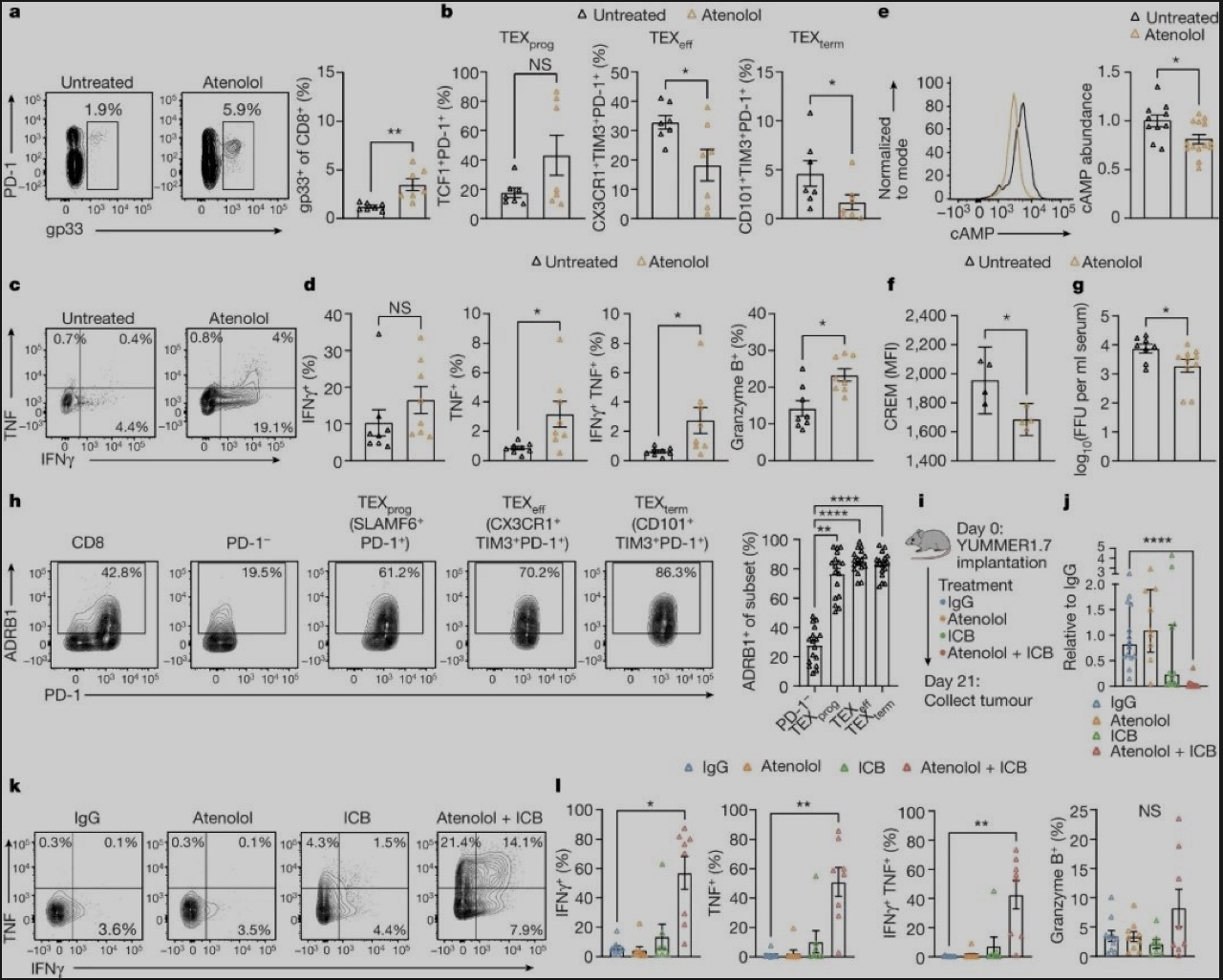
敲除ADRB1可与PD-1抑制剂处理协同增效,增强免疫应答
最后,研究团队还专门评估了敲除ADRB1或阿替洛尔处理,能否改善“癌中之王”——胰腺癌抑制性极强的免疫微环境,这是因为胰腺受到交感神经的高度支配。果不其然,胰腺癌微环境里的耗竭CD8+T细胞也存在ADRB1高表达,且单独敲除ADRB1、阿替洛尔处理或PD-1抑制剂都不够,必须得靠联合治疗。
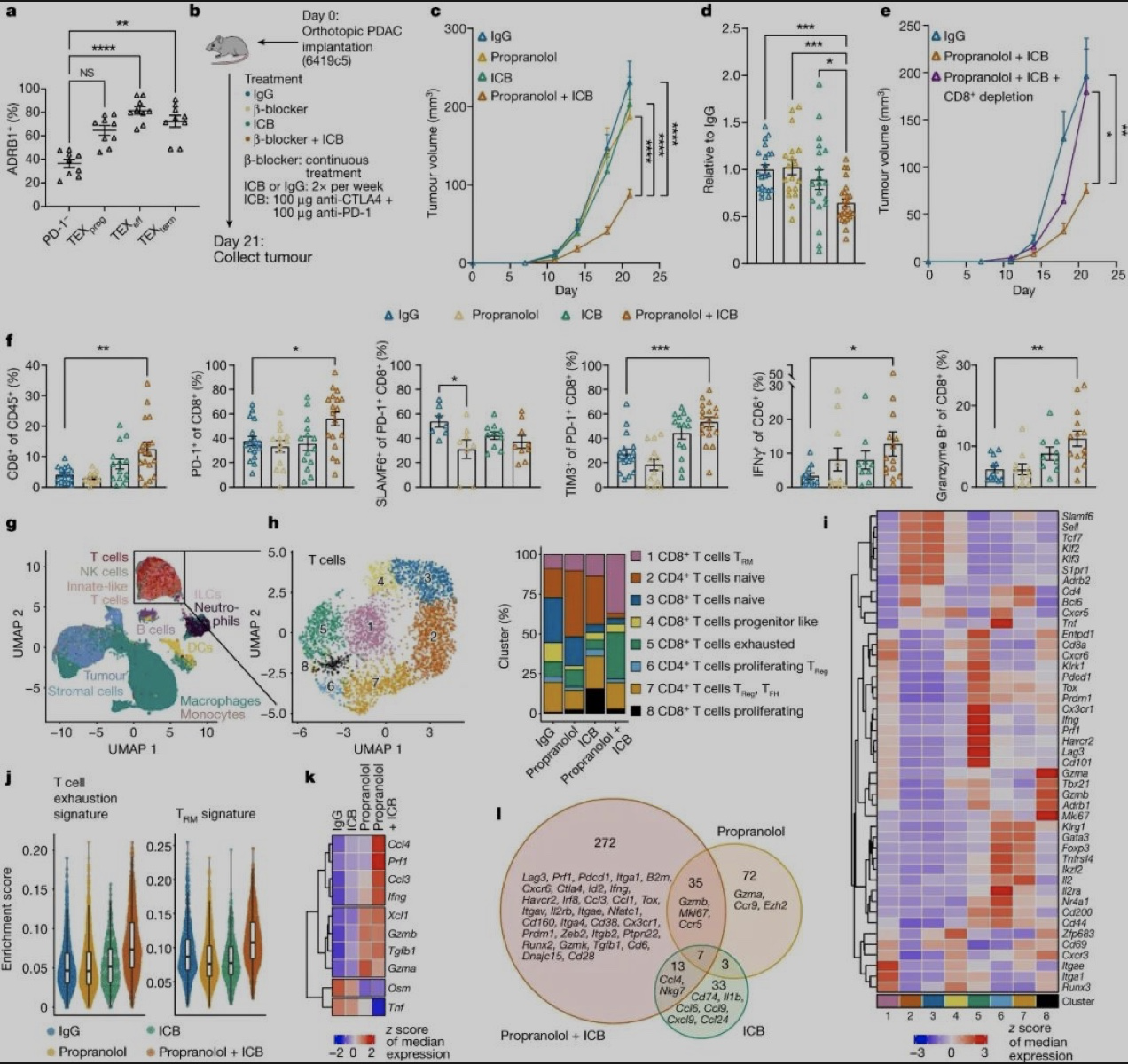
阻断交感神经信号+PD-1抑制剂治疗,才能逆转胰腺癌免疫抑制
参考文献:
[1]Globig A-M, Zhao S, Roginsky J, et al. The β1-adrenergic receptor links sympathetic nerves to T cell exhaustion[J]. Nature, 2023.
[2]Devi S, Alexandre Y O, Loi J K, et al. Adrenergic regulation of the vasculature impairs leukocyte interstitial migration and suppresses immune responses[J]. Immunity, 2021, 54(6): 1219-1230. e7.

