
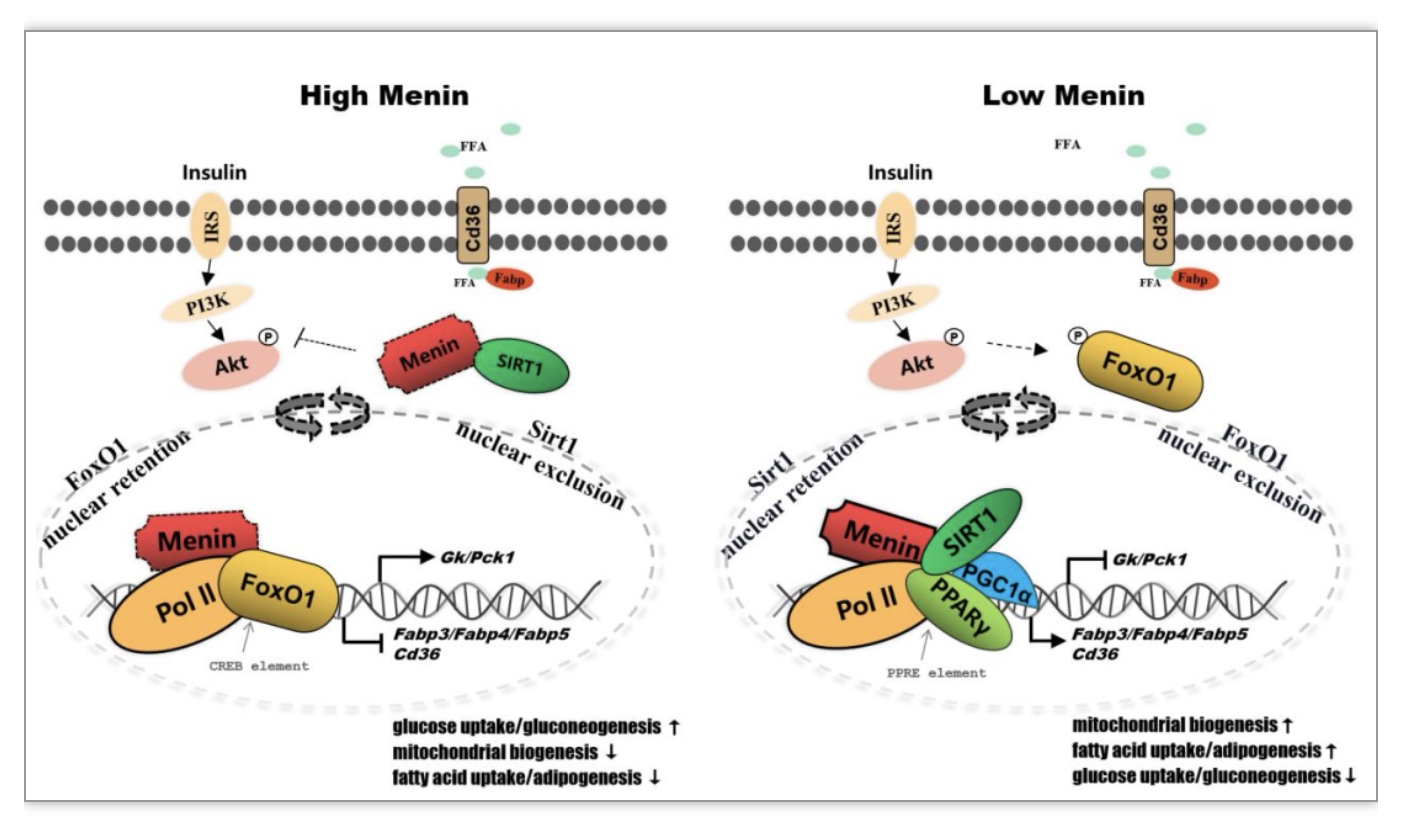
该研究是该课题组继解析了Menin介导乳腺代谢机制之后的新作。近年Menin因其广泛参与细胞的代谢调节活动而作为人类多种疾病的药物研发靶标。在肝脏中,Menin的表达失调是导致肝细胞糖脂代谢紊乱、形成脂肪沉积的重要因素。Menin部署肝细胞中FoxO1/PPARγ/SIRT1上的作用模型,也与美国糖尿病协会提出的最新建议不谋而合——用PPARγ激动剂(吡格列酮)和胰高血糖素样肽-1(GLP1)受体激动剂治疗糖尿病、NAFLD或NASH(非酒精性脂肪性肝炎)。该研究论文为我们理解脂肪肝的发病机制提供新的认识,同时,为靶向Menin治疗脂肪肝(NAFLD、MAFLD)及其它肝病(NASH)提供了理论支撑。

