
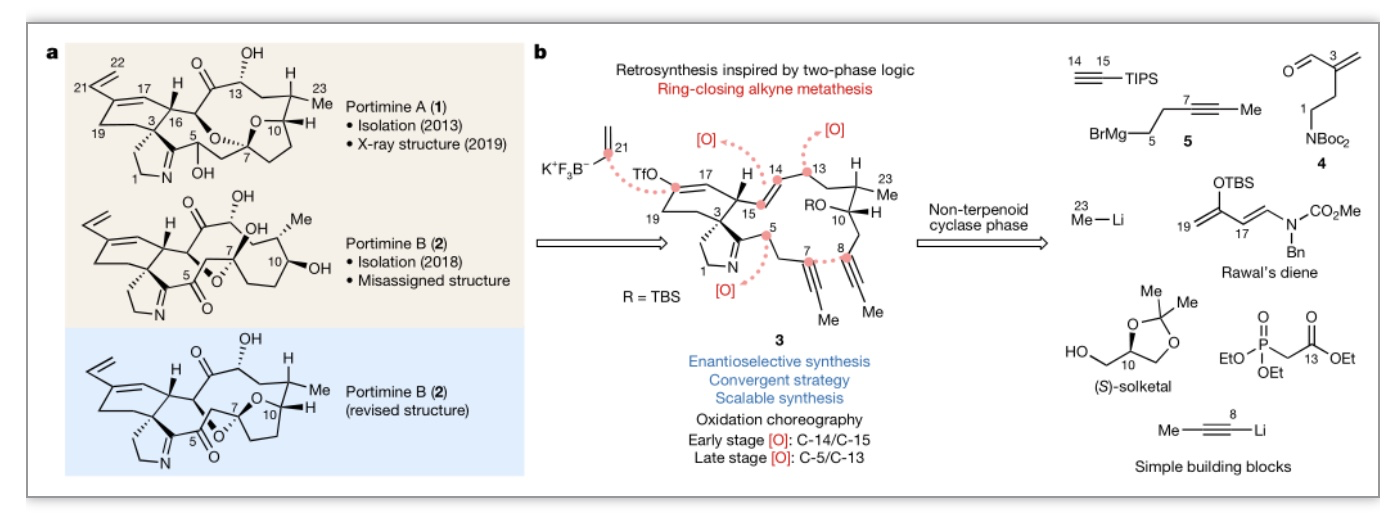
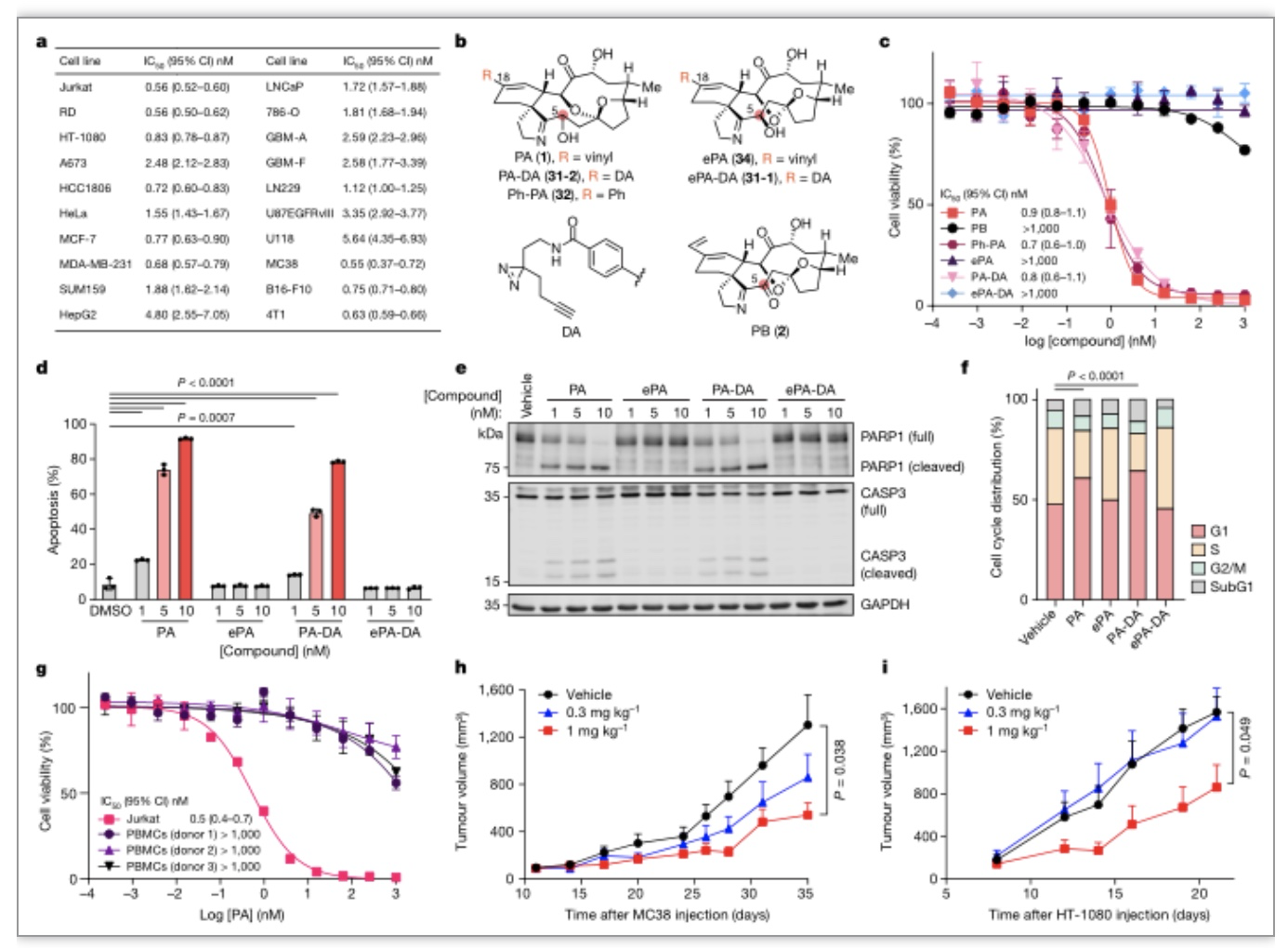
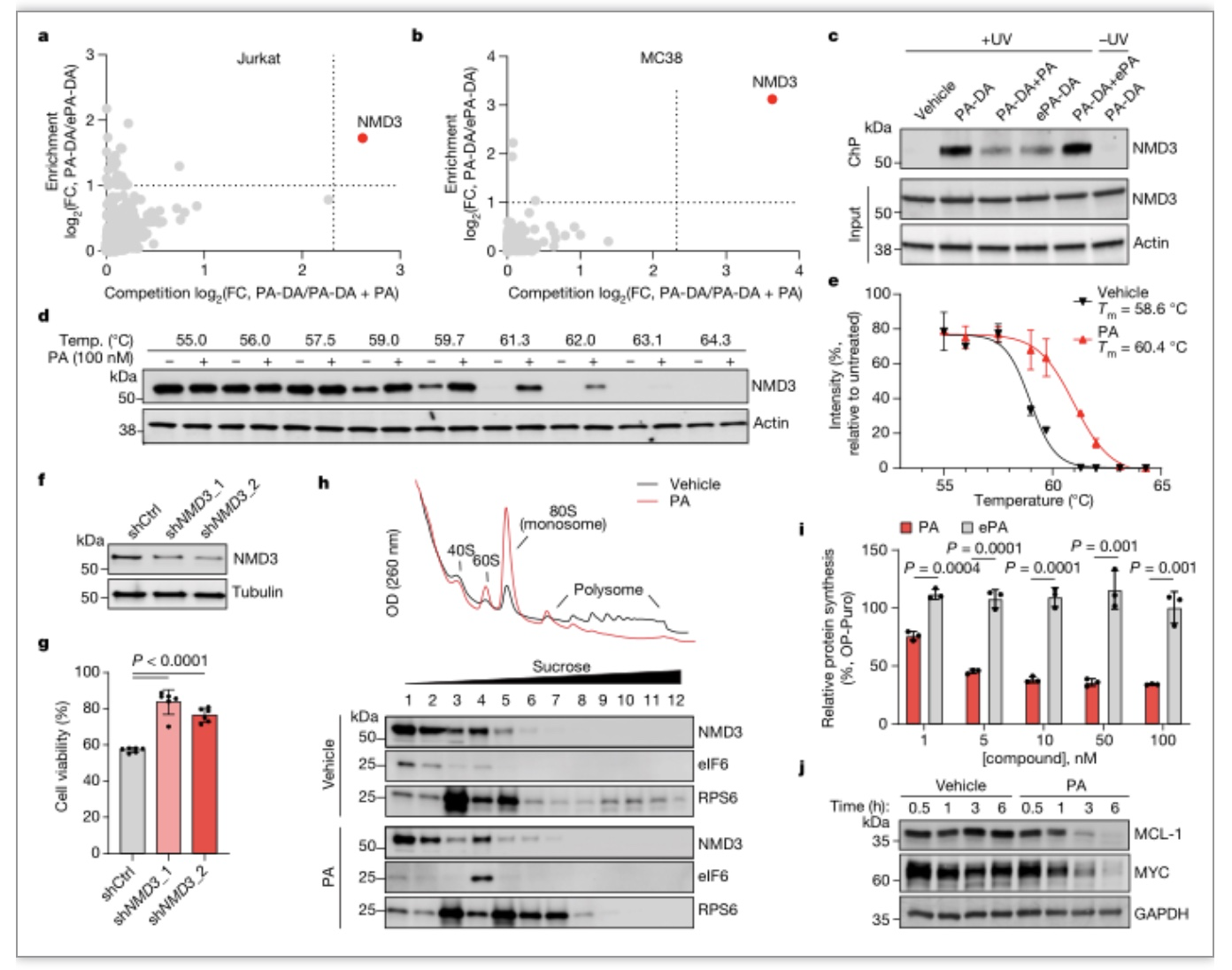
综上,研究者利用萜类化合物的两相合成途径,搭建了一个装饰最少的碳骨架,调整氧化顺序,并通过战略性定时的环链互变异构化实现了大环和亚胺结构的嵌合。最后,引入稳定的三氟甲磺酸乙烯酯,使这种具有生物前景的先导化合物能够灵活多样化,从而构建用于目标识别研究的光学探针。研究者证明全合成的PA对癌细胞具有高度的细胞毒性,但在人类PBMC中不具有细胞毒性,具有显著的选择性。此外,化学蛋白质组学研究表明,NMD3是PA的主要靶标, PA与NMD3的结合导致80S的稳定,随后破坏多聚体的形成和抑制蛋白质合成,导致细胞周期停滞和凋亡。然而,PA与NMD3结合如何诱导这种级联反应的确切分子机制仍有待补充,并将成为未来研究的主题。与其他小分子翻译抑制剂类似,在癌症细胞(而不是PBMC)中观察到的有效作用的一种可能解释是PA阻断了对增殖和存活至关重要的“短寿”蛋白如MYC和MCL-1表达。然而, PA对NMD3和翻译的影响可能还会影响其他多种生存途径,并因细胞类型和相关遗传病变而有所不同。因此,需进一步的研究,评估导致携带此类基因表达失调的恶性肿瘤是否对PA表现出更高的易感性,以及PA是否可能与靶向治疗协同作用,以实现更高的选择性和疗效。总之,该研究证明根据理想性标准设计的全合成路线,结合强大的化学蛋白质组学方法能识别潜在的治疗靶点,为癌症的治疗开辟了一条新途径。

