细胞凋亡(Apoptosis)指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。细胞凋亡与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用,它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。
凋亡是多基因严格控制的过程。这些基因在种属之间非常保守,如Bcl-2家族、caspase家族、癌基因如C-myc、抑癌基因P53等,随着分子生物学技术的发展对多种细胞凋亡的过程有了相当的认识,但是迄今为止凋亡过程确切机制尚不完全清楚。而凋亡过程的紊乱可能与许多疾病的发生有直接或间接的关系。如肿瘤、自身免疫性疾病等,能够诱发细胞凋亡的因素很多,如射线、药物等。
细胞凋亡与坏死的区别
虽然凋亡与坏死的最终结果极为相似,但它们的过程与表现却有很大差别。
坏死(necrosis):坏死是细胞受到强烈理化或生物因素作用引起细胞无序变化的死亡过程。表现为细胞 胀大,胞膜破裂,细胞内容物外溢,核变化较慢,DNA降解不充分,引起局部严重的炎症反应。
凋亡:是细胞对环境的生理性病理性刺激信号,环境条件的变化或缓和性损伤产生的应答有序变化的死亡过程。其细胞及组织的变化与坏死有明显的不同。
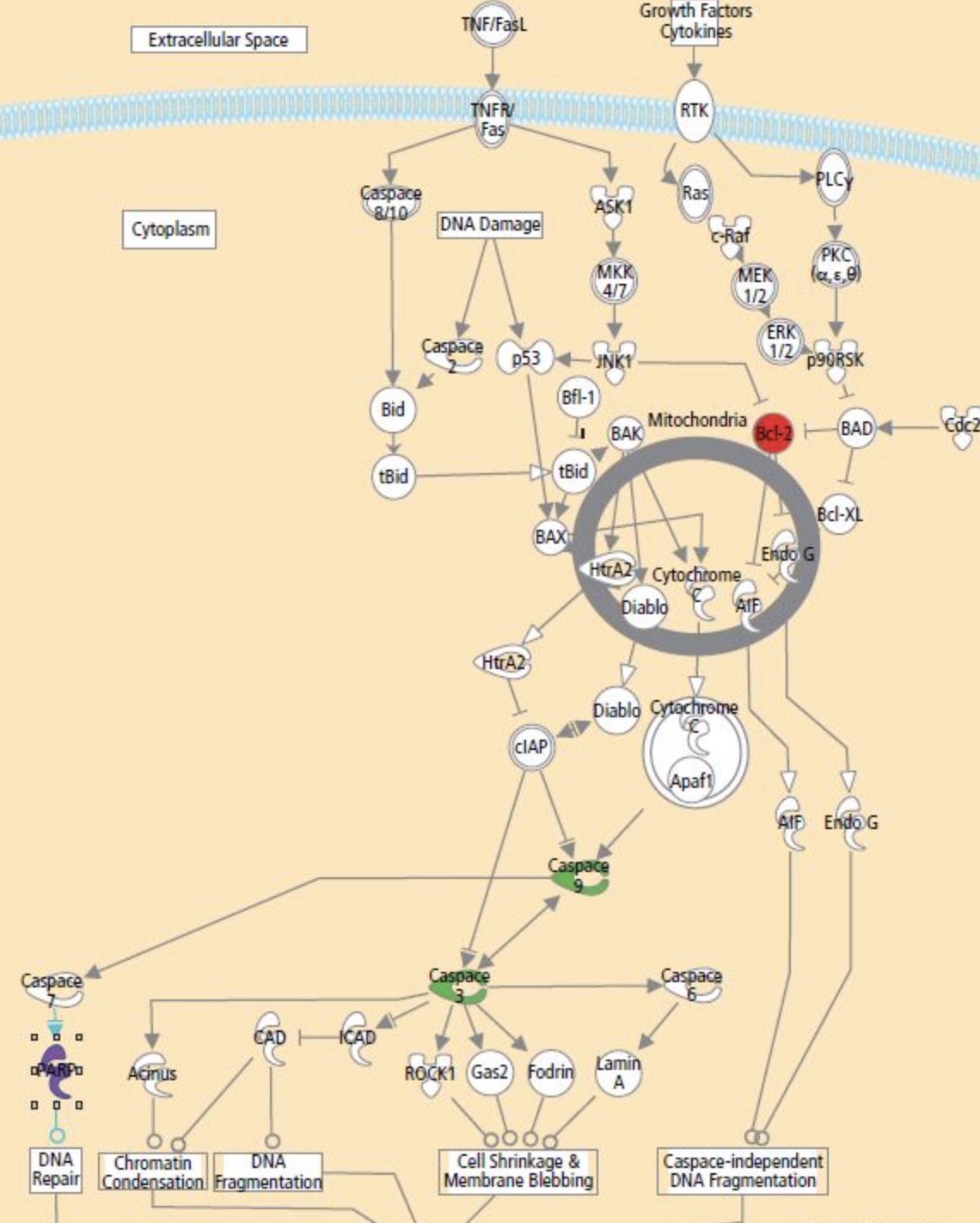
细胞凋亡检测指标和检测方法
NO.1
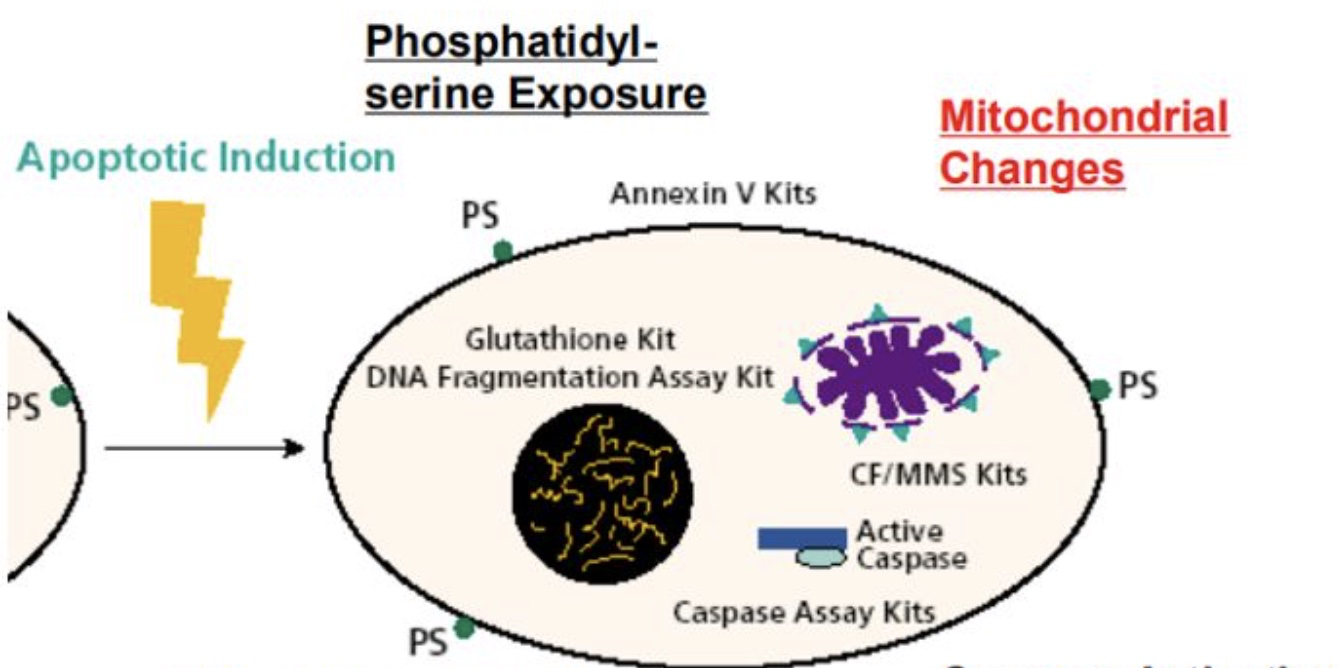
早期检测
(1)磷脂酰丝氨酸(PS)在细胞外膜上的检测:细胞膜外翻-Annexin V;
(2)细胞内氧化还原状态改变的检测:酶活性caspases;
(3)线粒体膜电位变化的检测:线粒体形态检查,Rhodamine 123,DIOC6,TMRM,JC-1;
(4)细胞色素C的定位检测。
NO.2
晚期检测
细胞凋亡晚期,核酸内切酶在核小体之间剪切核DNA,产生大量长度在180-200 bp的DNA片段。
(1)TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记);
(2)LM-PCR Ladder(连接介导的PCR检测);
(3)Telemerase Detection(端粒酶检测)。
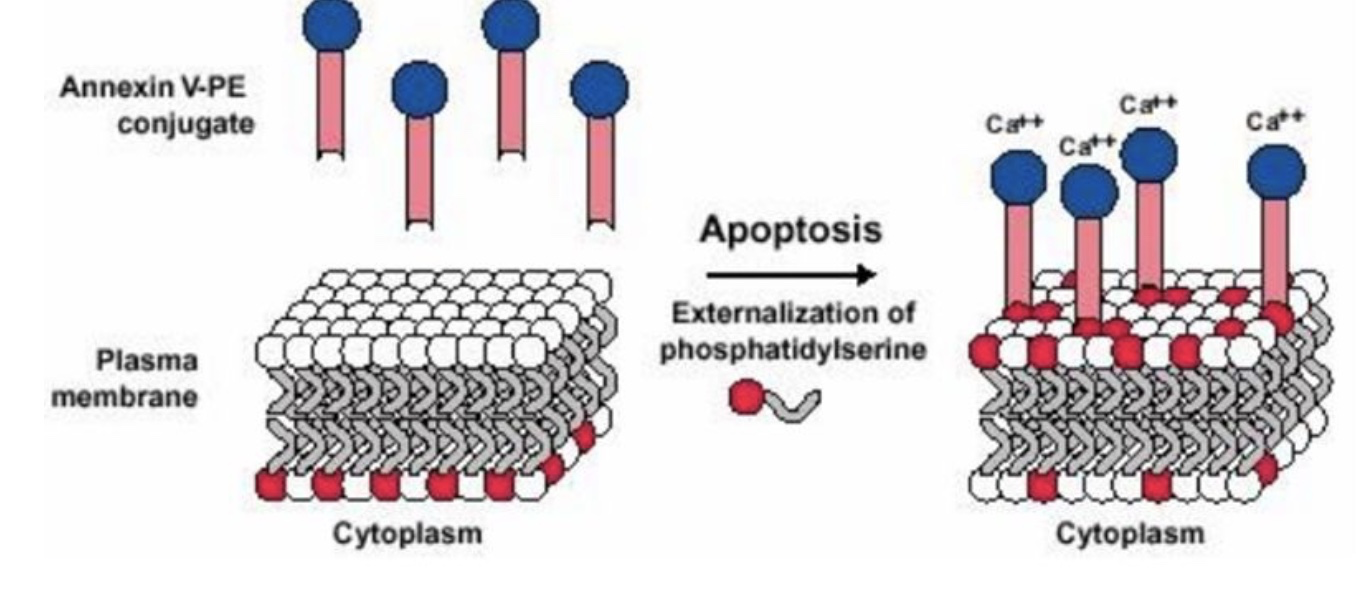
细胞膜外翻,磷脂酰丝氨酸检测(Annexin V法)
磷脂酰丝氨酸(Phosphatidylserine,PS)正常位于细胞膜的内侧,而在细胞凋亡早期,PS可以从细胞膜内侧翻转至细胞膜表面,暴露在细胞外环境中,从而被巨噬细胞识别,从而被清除体外。Annexin-V是一种分子量为35~36 kD的钙离子依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或Biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
碘化丙啶(Propidine iodide,PI)是一种核酸染料,与DNA或RNA的双螺旋结构嵌插结合而产生红橙色的荧光,因为不能透过完整的细胞膜,因此可以用以检测细胞膜的完整性,因而将Annexin-V与PI搭配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。
实验设计:以Annexin V: FITC Apoptosis Detection Kit Ⅰ(Cat.No. 556547)为例(敏泰元生物现货供应)

Tips
1、PI有毒性,能通过皮肤吸收,对眼睛有刺激作用,使用时需戴手套;
2、PI/7-AAD/DAPI高浓度会进入细胞,长时间对细胞有细胞毒性,因此染色时间过长有可能造成检测的凋亡率过高,可上机前5 min再加核酸染料;
3、保证细胞活性:避免用力吹打,避免胰酶消化时间过长,预冷PBS清洗,缩短上机时间;
4、血小板含有PS,能与Annexin V结合,需除去;
5、EDTA作为金属离子螯合剂,能够螯合钙离子,因此对实验有影响;
6、PI单阳象限一般是由于处理方式不当,或处理时间太久导致的非凋亡途径的细胞死亡,左上象限出现大量细胞,需要优化处理的浓度和时间梯度,以及优化细胞培养,细胞消化流程。
药物、病毒、质粒对细胞本底荧光都有影响?

Annexin-V/PI双染如何设置对照组?
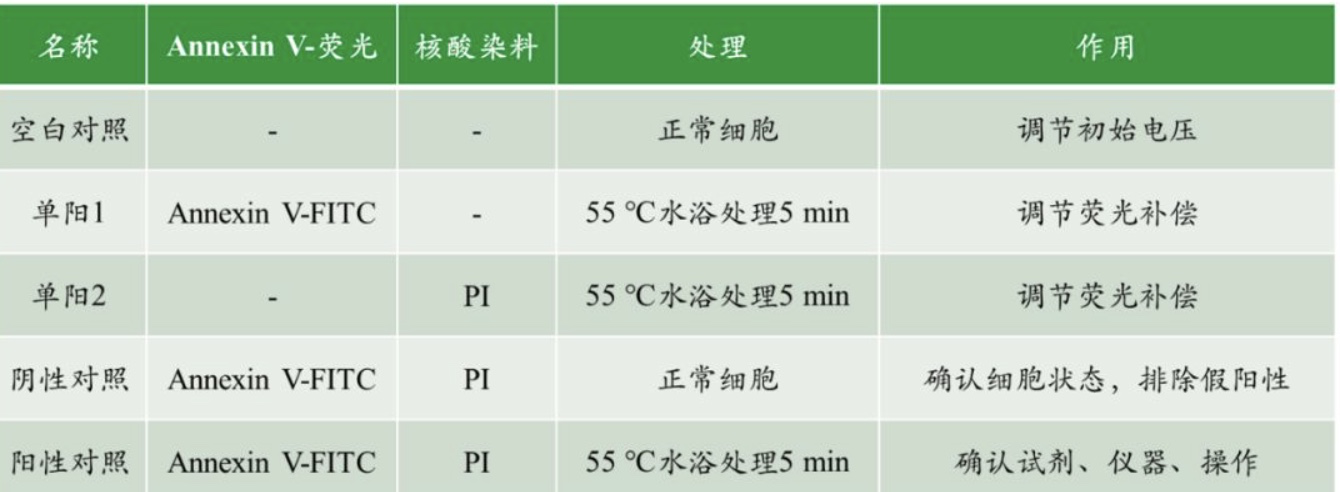
注:需要用新鲜的、非固定细胞
小贴士
1.Annexin V试剂盒可以检测多种属,无种属特异性。
2.固定或冻存的细胞/组织的细胞膜都会一定程度上受到损伤,建议使用免疫荧光技术(Cat.No.550911)。
3.只要钙离子不影响的表面Marker,Annexin V试剂盒可与其他细胞表面标记兼容。
线粒体膜电位的检测
线粒体在细胞凋亡的过程中起着枢纽作用,多种细胞凋亡刺激因子均可诱导不同的细胞发生凋亡,而线粒体跨膜电位的下降,被认为是细胞凋亡级联反应过程中最早发生的事件,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体跨膜电位崩塌,则细胞凋亡不可逆转。
线粒体跨膜电位的存在,使一些亲脂性阳离子荧光染料如Rhodamine 123、DIOC6、TMRM,JC-1等可结合到线粒体基质,其荧光的增强或减弱说明线粒体内膜电负性的增高或降低。
以BD Mitoscreen (JC-1)(Cat.No. 551302)为例:
正常生理状态下:线粒体负电性高,JC-1进入线粒体以多聚体形式存在于胞浆中,红色荧光强;
细胞发生凋亡时:线粒体产生去极化作用,负电性低,JC-1则以单体形式存在于细胞质中,绿色荧光增强。
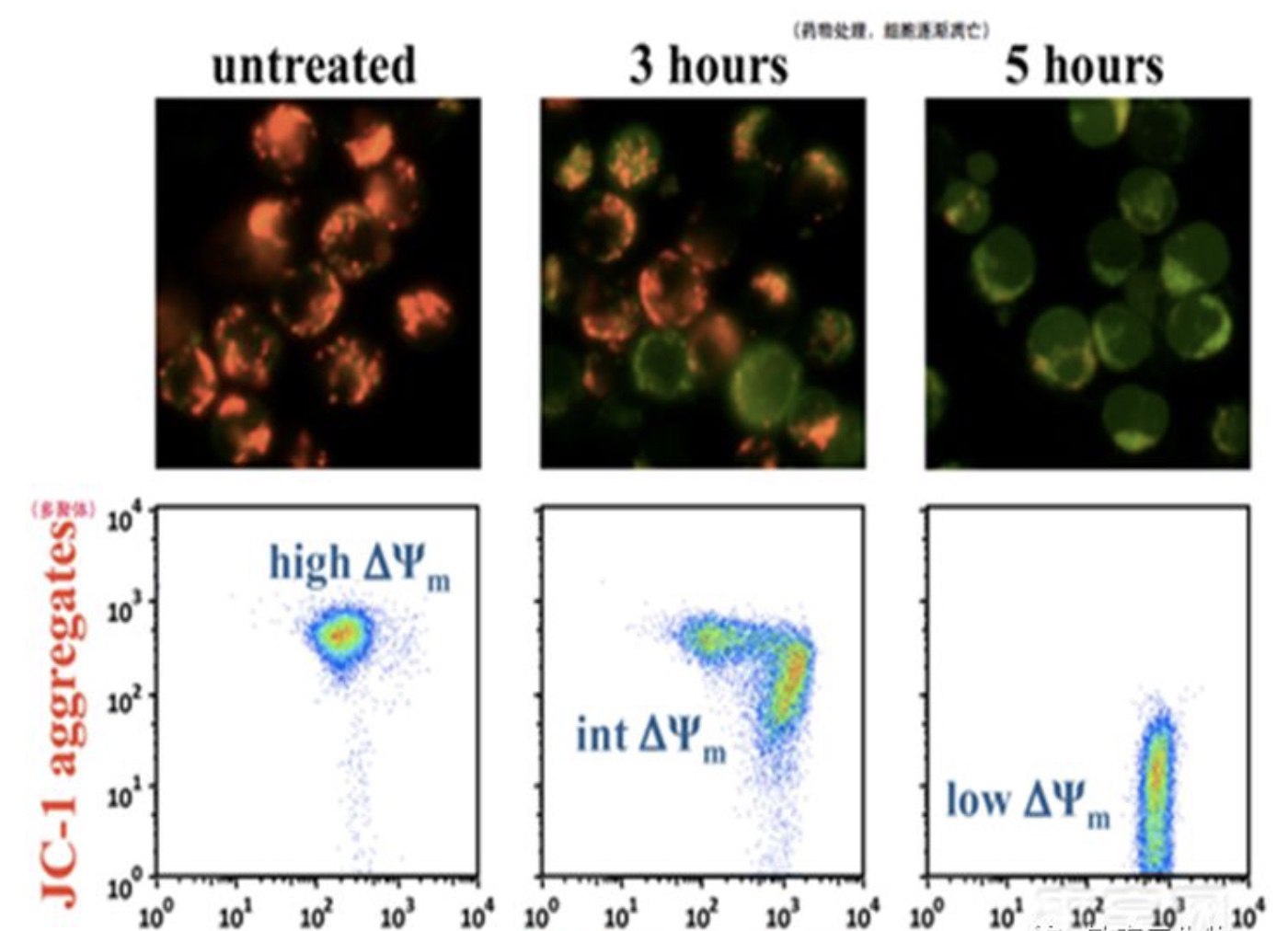
实验设计

Tips
1、37℃ CO2培养箱中孵育;
2、JC-1工作液现配现用;
3、pH的变化影响膜电位,保持平衡染液中pH的一致性;
4、JC-1会与蛋白结合,降低染料的浓度,引起假去极化;
5、用红绿荧光的相对比例来衡量线粒体去极化的程度。
凋亡中晚期:Caspase-3的活化
凋亡蛋白酶是凋亡重要的起始因子。凋亡最早和最常检测的是一系列名为Caspase的胞浆蛋白酶的激活。尤其是Caspase-3,Caspase-8和Caspase-9。Caspase-3在早期凋亡细胞中即被活化,是凋亡程序中的重要蛋白酶,它在调节信号传导的许多途径中发挥功能。Caspase-3正常以酶原(32 kD)的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的Caspase-3由两个大亚基(17 kD)和两个小亚基(12 kD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。
实验设计
以Caspase-3, Active Form, mAb Apoptosis Kit : FITC (Cat.No. 550480)为例。
1、细胞的诱导凋亡处理:细胞加入终浓度4-6 μM Camptothecin(拓扑异构酶Ⅰ抑制剂,用DMSO配制),37 ℃孵育4 h。
2、每管100 μL 1 × Perm/Wash buffer,200 μL抗体,计算抗体和Perm/Wash buffer使用量,并制备1 × Perm/Wash buffer。
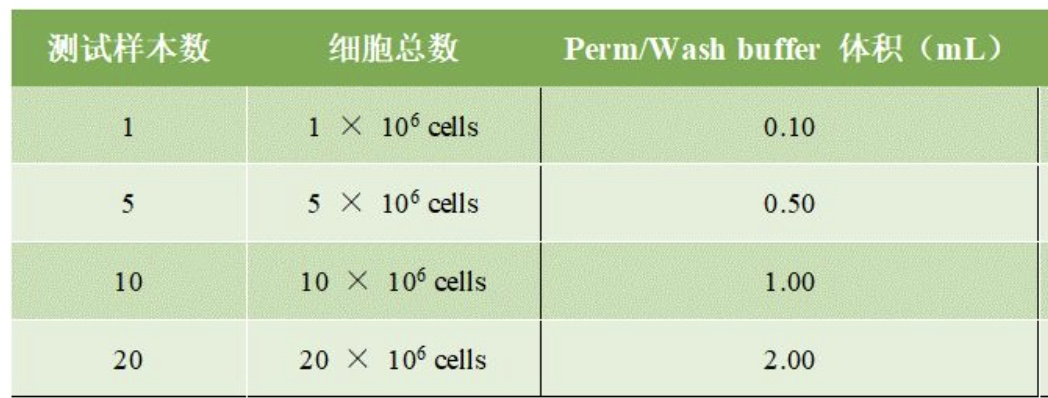
3、收集细胞,冷的PBS洗涤2次,使用1 × Cytofix/Cytoperm 调整细胞密度为1 × 10^6 cells/0.5 mL,冰上孵育20 min。
4、细胞400 g离心5 min,弃去上清,1 × Perm/Wash buffer清洗两次(0.5-1 mL/10^6 cells)
5、按样本数加入1 × Perm/Wash buffer和抗体,混匀,室温避光30 min。
6、1 mL 1 × Perm/Wash buffer清洗一次,0.5 mL 1 × Perm/Wash buffer重悬,上机检测。
DNA片段化的检测
凋亡中晚期会发生核酸内切酶的激活,双链的DNA出现不对称的断裂点,即产生一系列3’-OH端。加入外源性的脱氧核苷酸末端转移酶(terminal deoxynucleotidyl transferase, TdT)能够催化外源性荧光素标记的dUTP连接到DNA的3’-OH端,通过流式检测就能知道DNA断裂片段的多少,这种方法叫做TdT介导的dUTP缺口末端标记法(TdT mediated-dUTP nick end labeling, TUNEL)。
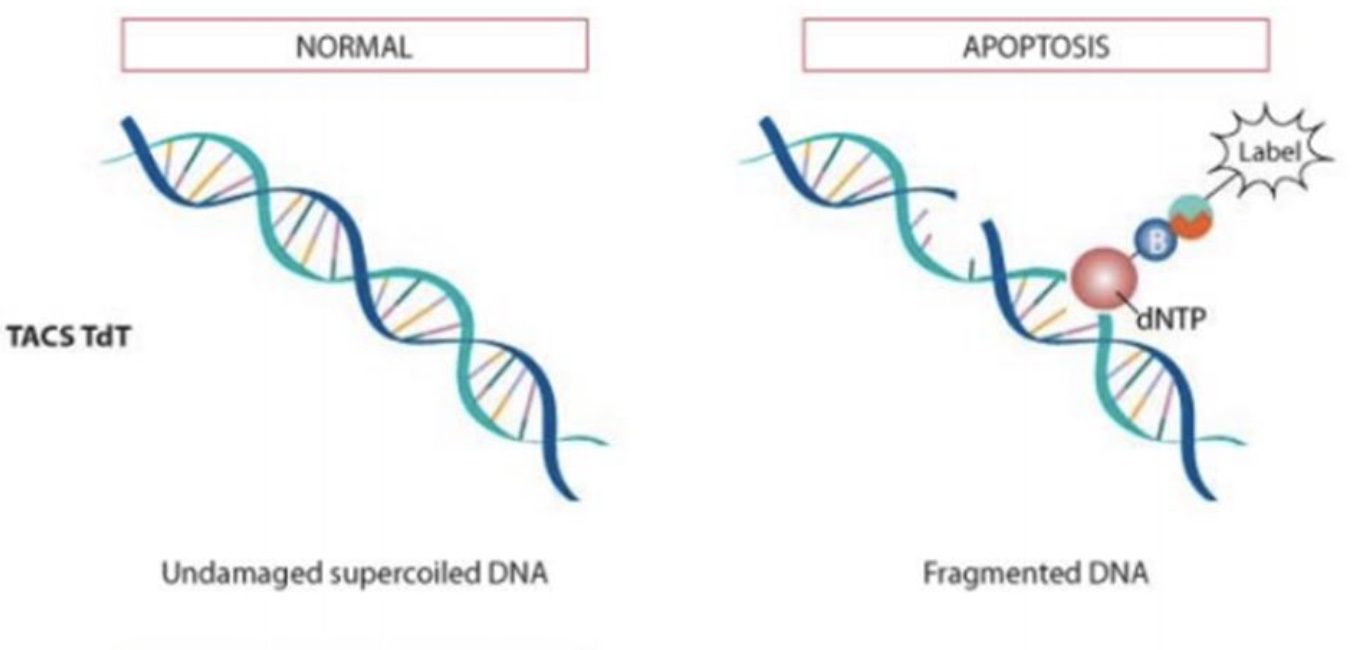
实验设计

检测结果
横坐标为DNA含量,纵坐标为BrdU强度,BrdU阳性的细胞即为发生凋亡的细胞。


