转座子(Transposable elements,TEs)是生物基因组的重要组成部分,对基因表达调控和基因组进化有重要影响[1]。转座子来源的序列占人基因组大小的45%,其介导的DNA重组与血胆固醇过多症、范科尼贫血、希佩尔-林道综合征等多种疾病相关[2]。模式生物酿酒酵母的转座子也称Ty(Transposable yeast elements)元件,平均长度为6-kb,包含TYA和TYB开放阅读框以及两端的同向长末端重复序列(Long terminal repeat, LTR)[3]。完整的Ty元件或LTR序列在酵母染色体同源重组断点处普遍存在,可引发大范围的染色体结构变异并显著改变细胞的适应性,表明Ty元件是驱动酵母基因组进化的关键内源性因素之一。然而,目前对Ty转座子介导染色体重组的遗传调控机制还有待深入阐释。该研究运用CRISPR/Cas9系统在模式生物酿酒酵母转座子保守序列上引入DNA双链断裂(Double stranded break, DSB),结合二、三代DNA测序技术分析基因组全局变异模式,揭示了转座子序列驱动基因组可塑性的规律及调控机制,对转座子在真核生物进化中的作用提供了新的认识。

由于酵母细胞有丝分裂过程中同源重组的主要目的是修复DNA断裂,研究推测Ty介导的染色体重组大多是由Ty元件或附近DNA断裂引发。为证实这一点,作者针对Ty1(酵母Ty转座子可分为Ty1-5,其中Ty1数量最多)的保守序列设计了引导Cas9蛋白切割DNA的gRNA(图1a)。该体系中Cas9基因被整合至酵母15号染色体,受半乳糖启动子pGAL1调控。研究在单倍体酵母细胞中诱导Cas9切断Ty1后筛选URA3报告基因失活的突变株,PCR分析了突变株中DSB修复途径的比例(图1b,c)。结果发现LTR序列介导的单链退火(Single strand annealing, SSA)是修复Ty1断裂的主要机制,其次是基因转换(Gene conversion)。前者导致LTR之间的序列发生缺失,后者可使基因组保留完整的Ty1序列。非等位Ty1之间的易位发生率要比SSA和基因转换少一个数量级(图1c)。研究者通过脉冲场凝胶电泳确认了易位的发生可导致核型的变化(图1e)。虽然前人报道NHEJ途径是单倍体酵母中修复DSB的一种主要途径,研究并未检测到NHEJ引起的少数碱基缺失或插入。
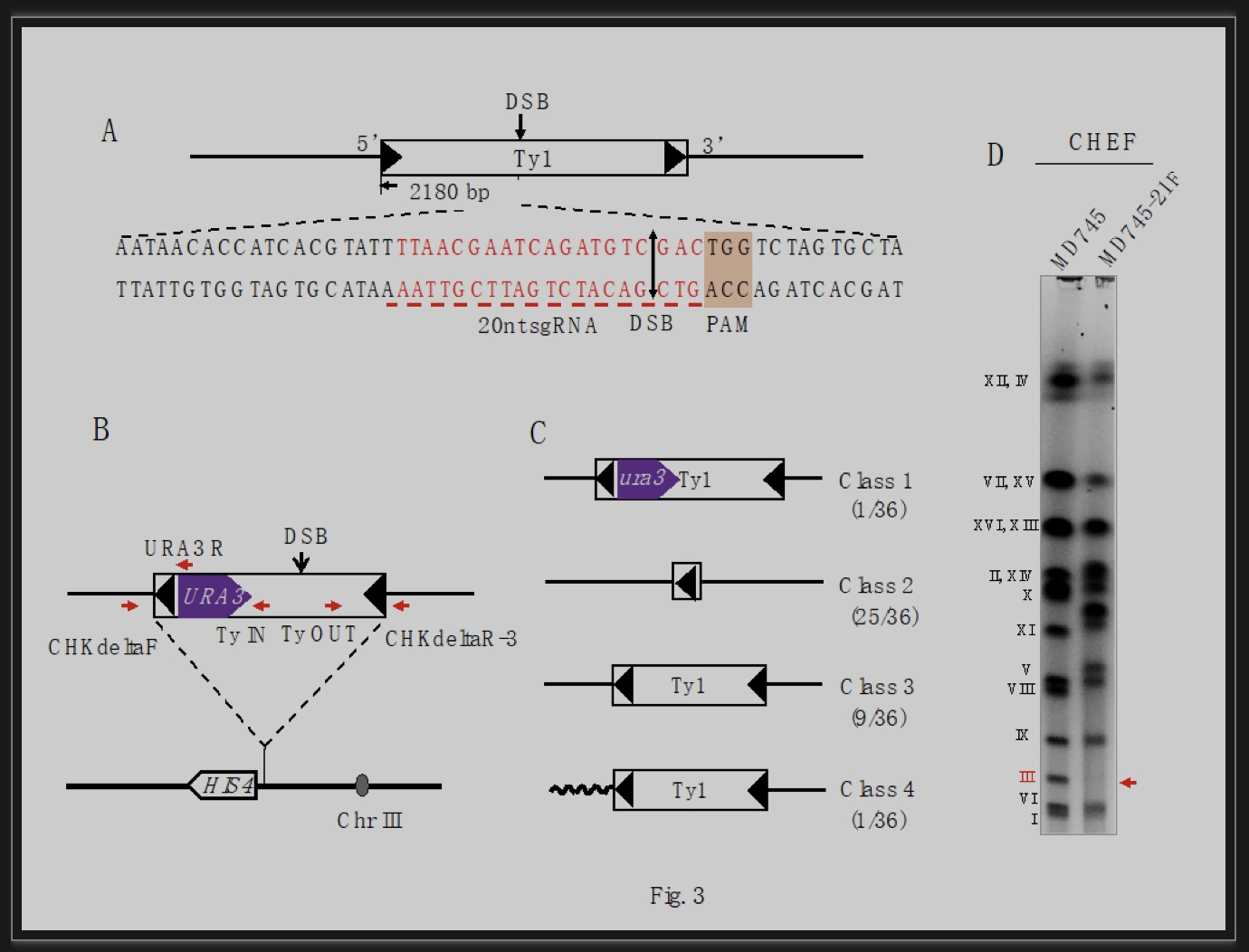
图1 CRISPR/Cas9打断Ty1保守序列及重组子筛选
(图源:Qi, et al., PLoS Genet, 2023)
有趣的是,二倍体酵母细胞修复Ty1断裂的机制与单倍体明显不同。作者通过杂交两株不同遗传背景的单倍体酵母(W303-1A和YJM789),获得一株基因组上存在5万多个SNP位点的杂合二倍体菌株。利用二代DNA高通量测序分析这些SNP位点的测序深度,可以高分辨率地检测染色体交换(Crossover)、基因转换、大片段扩增/缺失和染色体畸变[4,5]。研究采用短时间半乳糖液体和长时间固体平板生长两种诱导Cas9的方式获得突变株,结果均发现:(1)二倍体中Cas9诱导DSB的能力要弱于单倍体,但基因组变异形式更为丰富,其中染色体大片段扩增/缺失和染色体易位发生频率提高3个数量级以上。成对的大片段DNA扩增/缺失最为常见,这类事件可以通过核型和SNP拷贝数分析发现(图2a,b)。其发生机制是Ty1上的DSB以非同源染色体的Ty1为模版进行修复进而发生染色体交换(图2c),根据染色体分配的方式不同引起成对的扩增/缺失或染色体相互易位(DNA拷贝数无变化)。由于二代DNA测序reads短无法跨过Ty区域,研究者借助Nanopore测序来确认Ty-Ty重组(图2e)。(2)几乎所有的染色体重组事件断点处都存在Ty1序列,染色体上成簇的Ty元件是重组热点。(3)二倍体基因组中染色体内重组比染色体间重组更普遍;(4)Ty1两端LTR序列介导的SSA极少发生,表明该途径是二倍体酵母中修复DSB的次要机制。
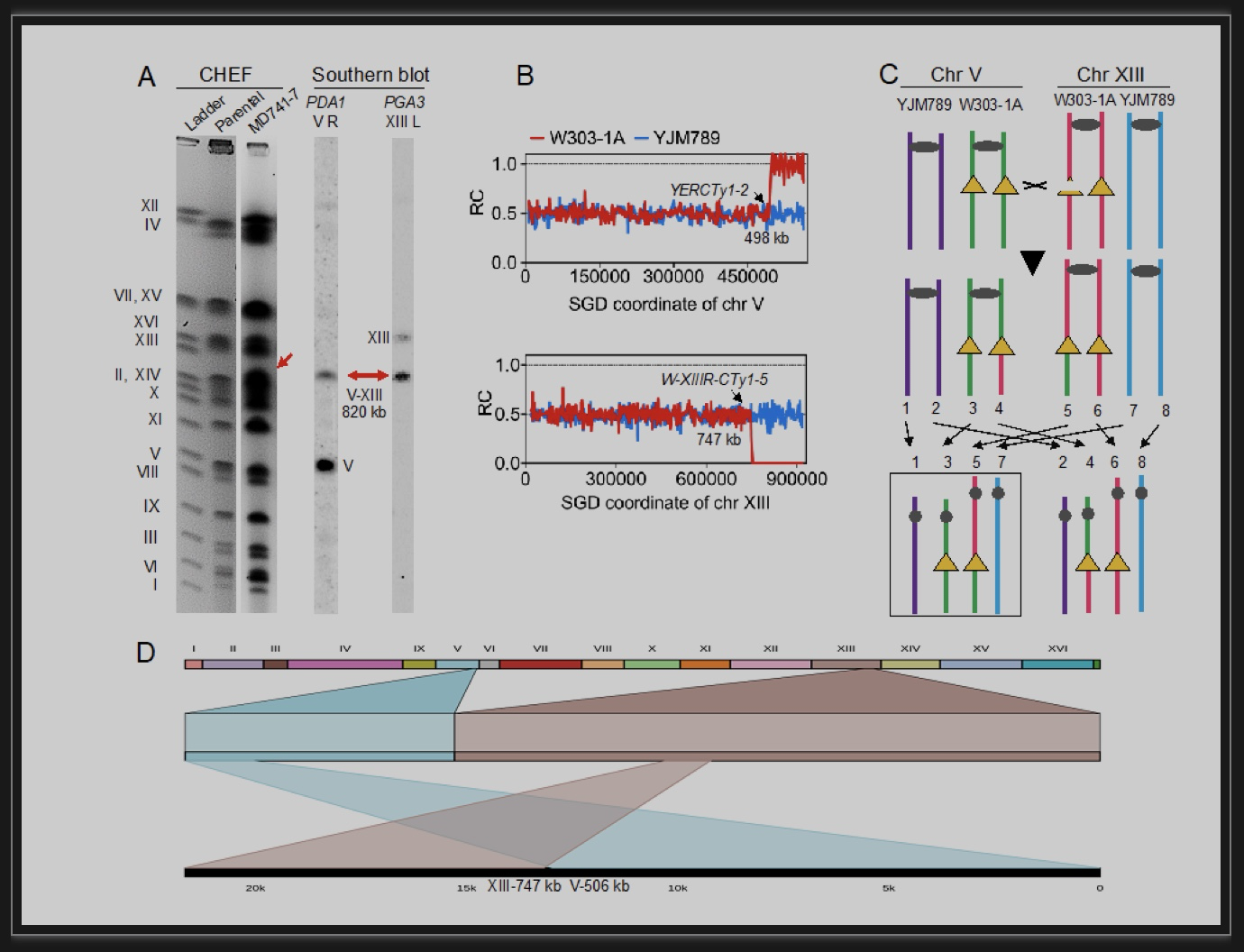
图2 CRISPR/Cas9诱导二倍体酵母发生染色体易位
(图源:Qi, et al., PLoS Genet, 2023)
同源重组造成的杂合性丢失(Loss of heterozygosity, LOH)是二倍体生物基因组变异的一种重要形式。依据LOH区域是否延伸至染色体末端分为末端LOH(T-LOH)和内部LOH(I-LOH)。T-LOH由染色体交换(图3a)或断裂诱导修复(Break-induced replication, BIR)(图3b)引起,I-LOH主要由基因转换导致(图3c)。研究发现较野生型细胞相比,表达Cas9的二倍体细胞中LOH发生率也大幅提高,部分LOH与染色体扩增/缺失事件相互重合,呈现了更为复杂的变异模式。令人意外的是,大部分LOH事件断点处均没发现Ty1序列。这个现象一个可能的原因是Ty1上频繁地断裂会间接引起基因组其它区域的不稳定。然而,作者发现T-LOH事件中大多都是W303-1A的序列被YJM789的序列替代,具有极强的偏好性。由于W303-1A中的Ty1元件要远多于YJM789,W303-1A染色体上部分Ty1断裂不能利用同源染色体的等位Ty1进行修复。因此,作者提出这些LOH事件同样是由Cas9打断W303-1A染色体上的Ty1引起,只不过细胞对断点进行了长距离的3’到5’端的切割,断点再入侵YJM789的非Ty1序列通过BIR途径修复。
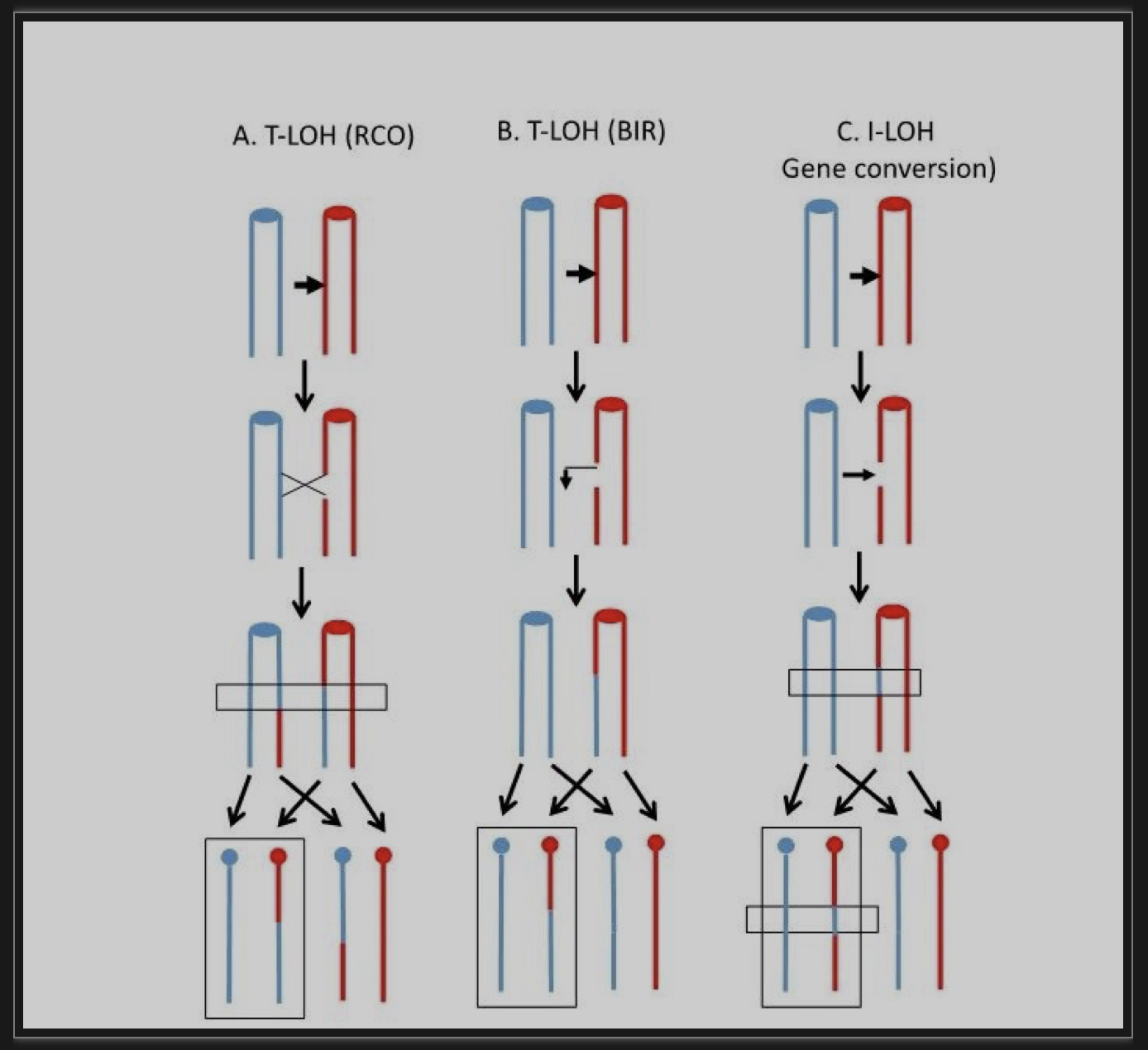
图3 二倍体细胞发生LOH事件的分子遗传机制
(图源:Qi, et al., PLoS Genet, 2023)
总的来说,该研究基于CRISPR/Cas9在Ty序列上引入DSB揭示了转座子驱动基因组变异进化的潜能和规律,厘清了不同DSB修复途径对转座子断裂引发酵母细胞基因组不稳定的相对贡献。同时,研究者拓展了长reads测序技术在检测长同源序列介导染色体重组中的能力,对溯源复杂基因组变异的发生过程提供了方法支撑。Cas9靶向基因组重复序列诱导基因组大范围结构变异的技术也可用于微生物菌株工业生产相关性状的遗传改进。事实上工业酵母菌株中也普遍存在非整倍体和大片段DNA拷贝数变化,是菌株发酵性能和胁迫耐性分化的重要机制[6]。值得注意的是,酿酒酵母属中不同菌种染色体基因排列具有很高的保守性,这个现象表明Ty介导的染色体重组在自然进化中受到负选择。此外,虽然生物细胞中DSB修复途径具有很高的保守性,不同生物对修复途径的选择偏好性存在差异,高等生物中转座子序列断裂对基因组变异模式的影响还需要深入探究。

