自然界中近70%的植物病毒需要依靠介体昆虫传播,这些介体昆虫对植物病毒的持久性传播是导致病害暴发流行的关键。病毒对寄主植物具有很强的致病性,但对介体昆虫几乎不具有致病性[1]。自噬通过降解病毒颗粒及其蛋白在病毒侵染寄主中起着重要的防御作用,而病毒也可以劫持或破坏自噬途径以达到其在寄主内侵染和复制的目的[2]。然而植物病毒是否激活介体昆虫的自噬,以及如何逃避和调控自噬维持其在介体昆虫内的持续侵染和增殖还需要进一步研究。
该研究揭示了我国一类农作物病害南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus, SRBSDV)是如何诱导介体白背飞虱不完全自噬,同时病毒进一步利用未融合的自噬体在肠道上皮细胞中积累增殖的机制,这一发现为阻断病毒利用介体昆虫持久传播提供了新思路。

作者通过比较带SRBSDV和不带SRBSDV的白背飞虱中自噬相关基因(Atg)的相对表达量,发现带病毒介体昆虫体内Atg3、Atg5、Atg8、Atg9、Atg12的mRNA水平明显上升(图1A)。此外,与不带毒的相比,带毒的昆虫体内Atg8-II蛋白水平上升(图1B),且中肠上皮细胞中自噬体数目显著增加,说明SRBSDV感染介体昆虫能够激活细胞自噬(图1C-E)。
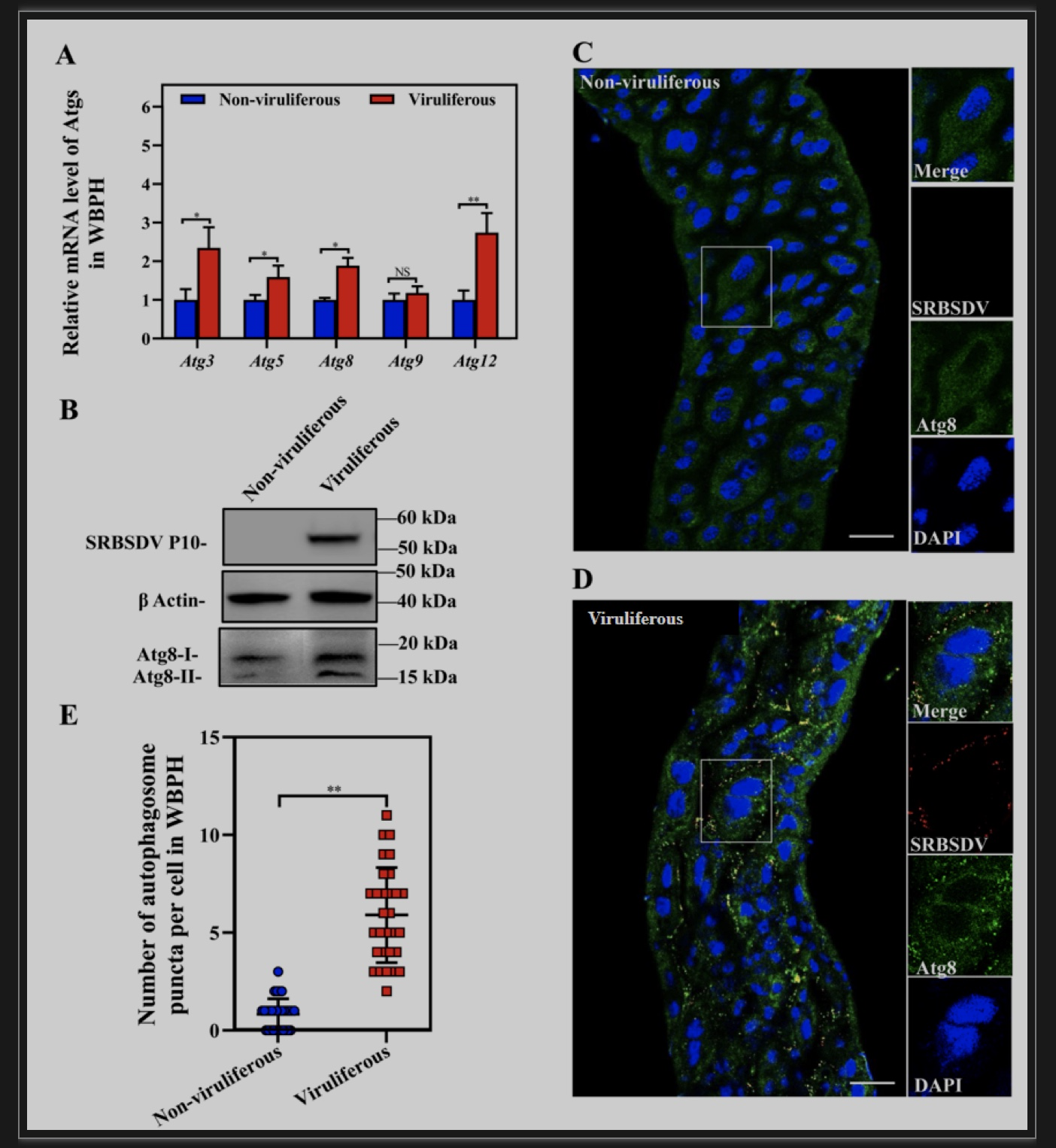
图1 无毒和带SRBSDV病毒的白背飞虱自噬水平的评估
(图源:Zhang L, et al., Plos Pathog, 2023)
为了探讨SRBSDV激活白背飞虱细胞自噬的途径,作者通过分析带毒昆虫中表面受体ITGB3和P-JNK的表达水平发现带毒昆虫中二者表达水平升高,且干扰ITGB3的表达能够抑制JNK的激活(图2A-C)。RT-qPCR、WB和LSCM等检测发现激活JNK后自噬相关基因的mRNA水平上升,随后自噬水平上升;抑制JNK后自噬相关基因的mRNA水平下降,自噬水平下降(图2D-L)。这些结果表明:ITGB3与SRBSDV结合后,激活了JNK信号通路,通过促进自噬相关基因的表达,诱导了细胞自噬。

图2 激活JNK途径诱导细胞自噬
(图源:Zhang L, et al., Plos Pathog, 2023)
为了进一步探索病毒与自噬体的关系,作者将检测带SRBSDV的白背飞虱肠道解剖,通过LSCM观察发现自噬体与病毒粒子和双链RNA共定位(图3)。且经免疫电镜观察发现中肠上皮细胞中含有双层膜结构包裹着病毒粒子,膜内呈空壳状,膜外排列着未成熟和成熟两种形式的病毒粒子(图4),说明病毒的积累增殖与自噬体的双层膜结构有关。
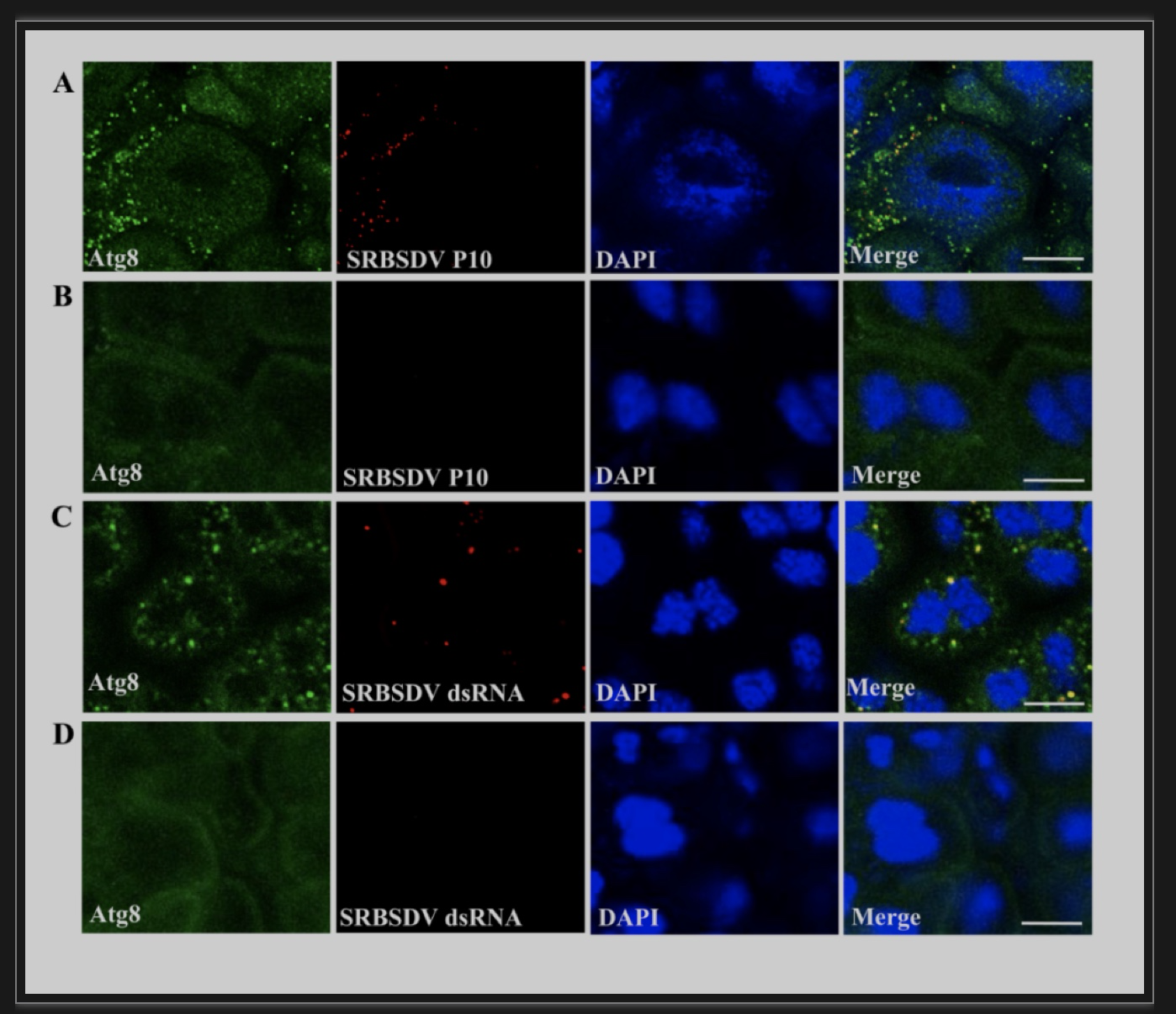
图3 SRBSDV与自噬体在白背飞虱中肠上皮细胞中共定位
(图源:Zhang L, et al., Plos Pathog, 2023)
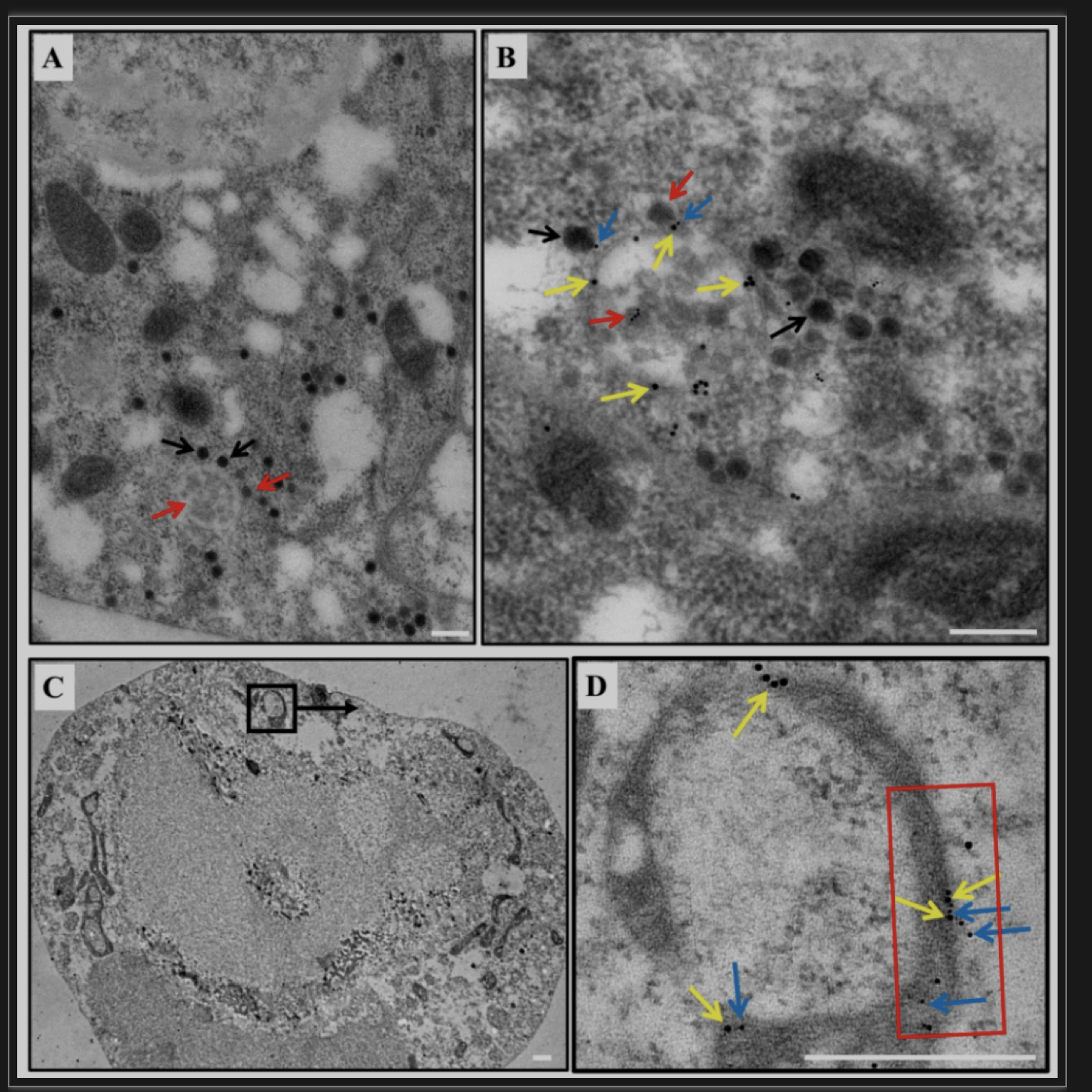
图4 SRBSDV定位在自噬体膜上
(图源:Zhang L, et al., Plos Pathog, 2023)
由于自噬和病毒积累增殖都是动态变化的过程,作者检测了白背飞虱在获毒后不同时间自噬水平的变化情况。通过对中肠上皮细胞中自噬体斑点的统计发现在0-1天自噬体斑点数目升高,1天达到一个小高峰后迅速下降并随着时间的推移逐步升高直至稳定;在饲毒后0 天、0.5 天、1 天、2 天、5 天、8 天、12 天和14 天检测发现自噬相关基因Atg3、 Atg5、Atg8、Atg12的mRNA水平和自噬水平先升高,在1天时达到小高峰后迅速下降,随着时间的推移逐步上升直至稳定(图5)。说明病毒在进入细胞的过程中诱发了介体昆虫中肠细胞的自噬,在病毒进入细胞后自噬水平迅速下降,随着病毒的复制增殖,自噬水平逐渐上升,这说明病毒增殖需要进一步激活和维持自噬。
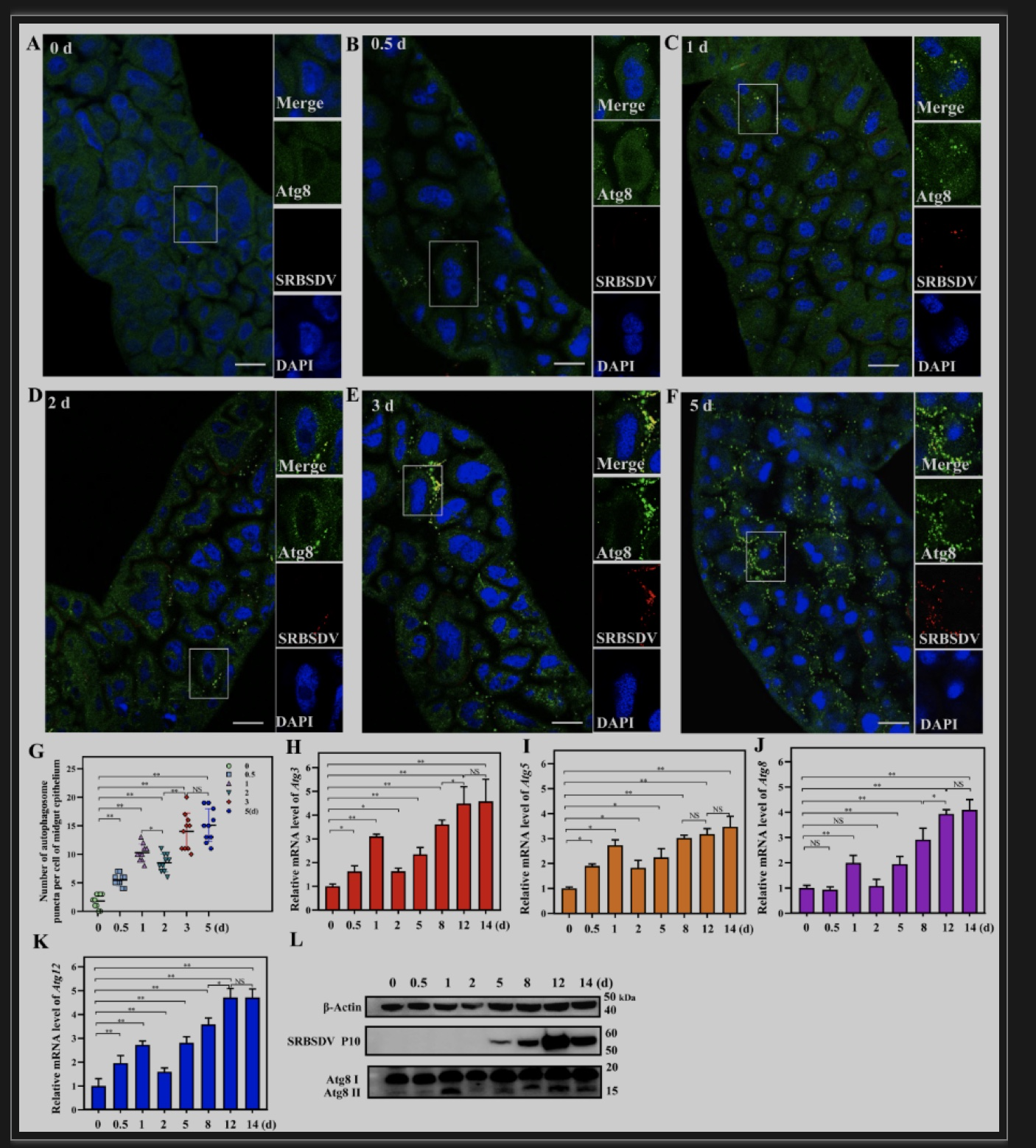
图5 自噬水平随病毒含量增加而上升
(图源:Zhang L, et al., Plos Pathog, 2023)
为了探索自噬的激活和抑制对病毒的影响,作者将白背飞虱获毒后分别饲喂3-MA(自噬抑制剂)、Rapamycin(自噬激活剂)和蔗糖稀释液(对照),随后检测不同处理病毒的外壳蛋白P10在mRNA水平和蛋白水平的相对含量。结果显示自噬抑制和激活后,白背飞虱的持毒率不变(图6A),说明自噬抑制和激活不会影响白背飞虱的持毒。但饲喂3-MA或干扰自噬基因抑制自噬后,病毒相关基因的表达水平显著降低、传毒率下降;饲喂Rapamycin激活自噬后,病毒相关基因的表达水平显著上升、传毒率升高(图6B-H),说明自噬有利于SRBSDV的增殖和传播。为了进一步验证自噬对病毒的影响,经透射电镜观察发现,干扰Atg8后损害了自噬体的形成,病毒呈空壳状(图6J,K),说明病毒在没有自噬体双层膜结构存在的情况下,难以形成成熟的病毒粒子,病毒增殖受阻。
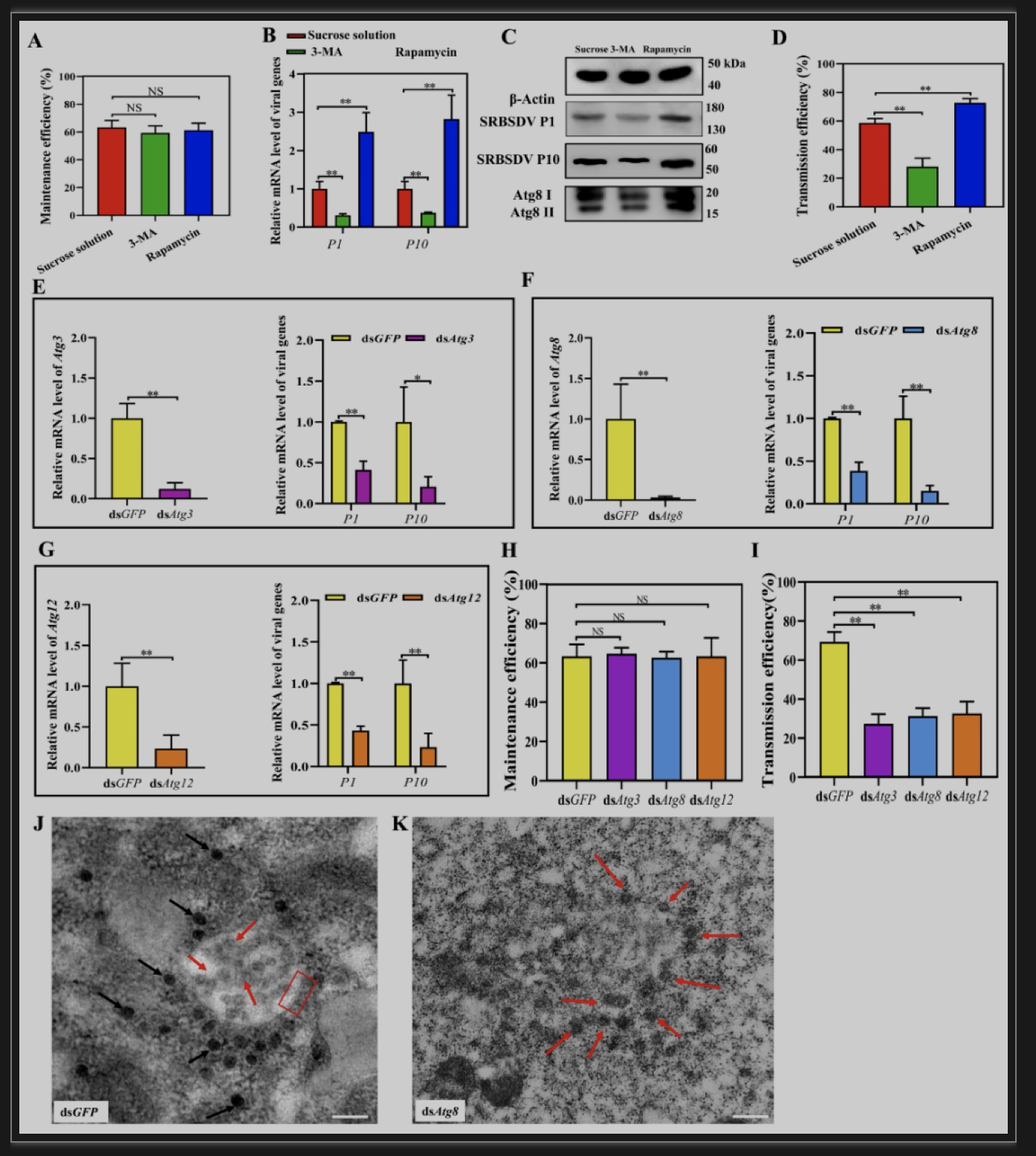
图6 抑制自噬阻碍病毒增殖;激活自噬促进病毒增殖
(图源:Zhang L, et al., Plos Pathog, 2023)
随后作者利用酵母双杂交和免疫共沉淀验证了自噬体膜蛋白Atg8与SRBSDV主要外壳蛋白P10存在相互作用(图7A,B)。并用LSCM进行观察发现SRBSDV P10与Atg8共表达时,Atg8的荧光信号聚集成点状,且SRBSDV P10能够与Atg8共定位;当在培养基里加入自噬激活剂Rapamycin处理Sf9细胞时,Atg8标记的膜系统连成片状,且SRBSDV P10沿着自噬体膜系统内、外侧分布(图7C),说明自噬体膜为病毒蛋白P10的大量聚集提供了场所。有趣的是,作者通过构建pFastHTB-mcherry-EGFP-Atg8双荧光表达载体发现只表达mcherry-EGFP-Atg8的细胞自噬体多呈红色,绿色信号减弱;mcherry-EGFP-Atg8与SRBSDV P10 共表达时,自噬体呈黄色,且与SRBSDV P10共定位(图7D),说明P10的表达,阻止了自噬体的成熟。随后作者检测发现P10能够与溶酶体的膜蛋白LAMP1相互作用(图8A,B)。为了进一步验证P10是否阻碍自噬体与溶酶体的融合,利用Sf9细胞表达了 P10,LAMP1-mcherry和EGFP-Atg8,发现三者在同一细胞内表达时,P10既能与自噬体共定位也能与溶酶体共定位,但是自噬体和溶酶体不能结合(图8C-F),说明分布在自噬体膜外的P10阻隔了自噬体和溶酶体的融合,使病毒逃避了溶酶体的降解。
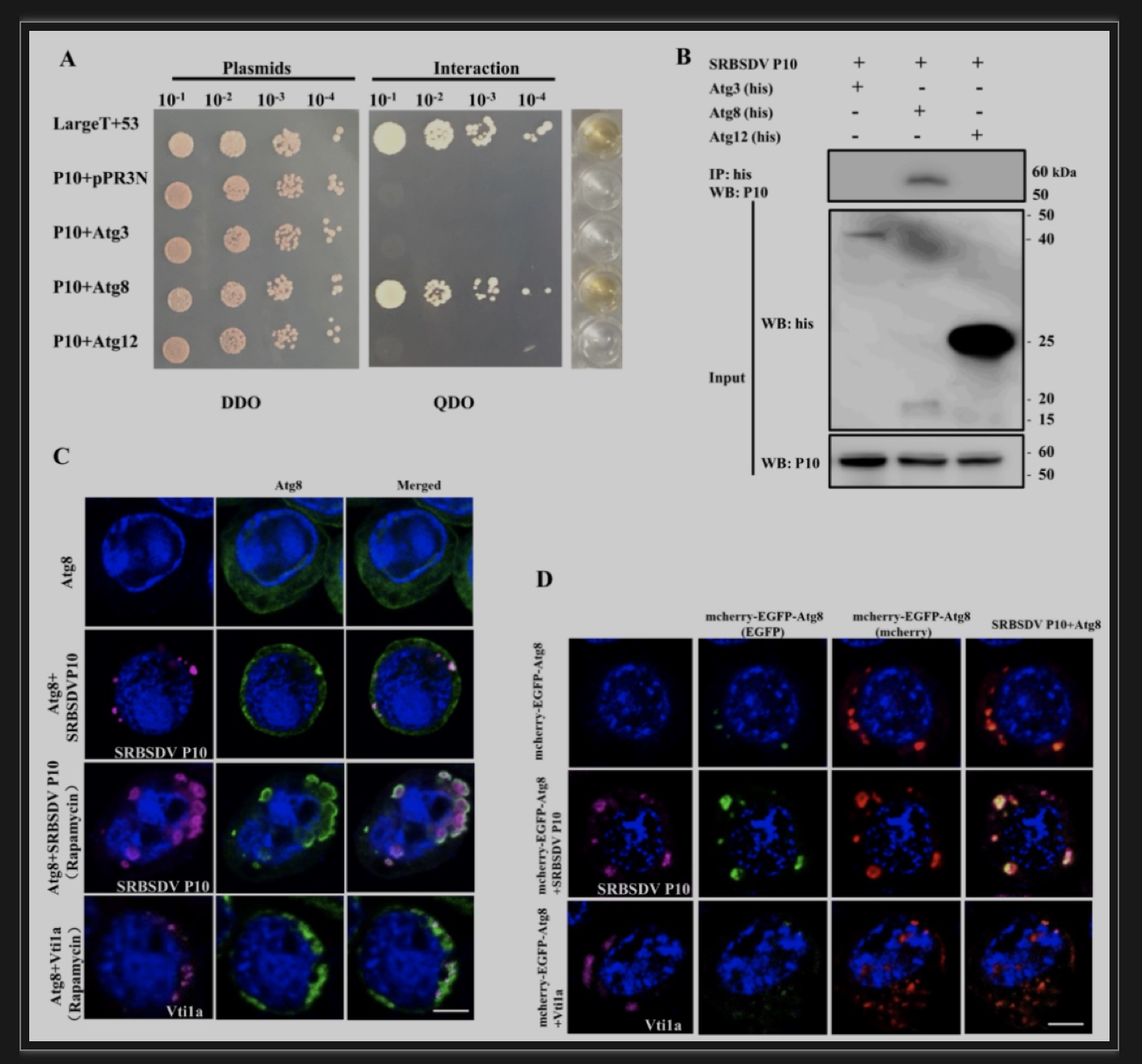
图7 自噬体膜为病毒蛋白聚集提供有利场所
(图源:Zhang L, et al., Plos Pathog, 2023)
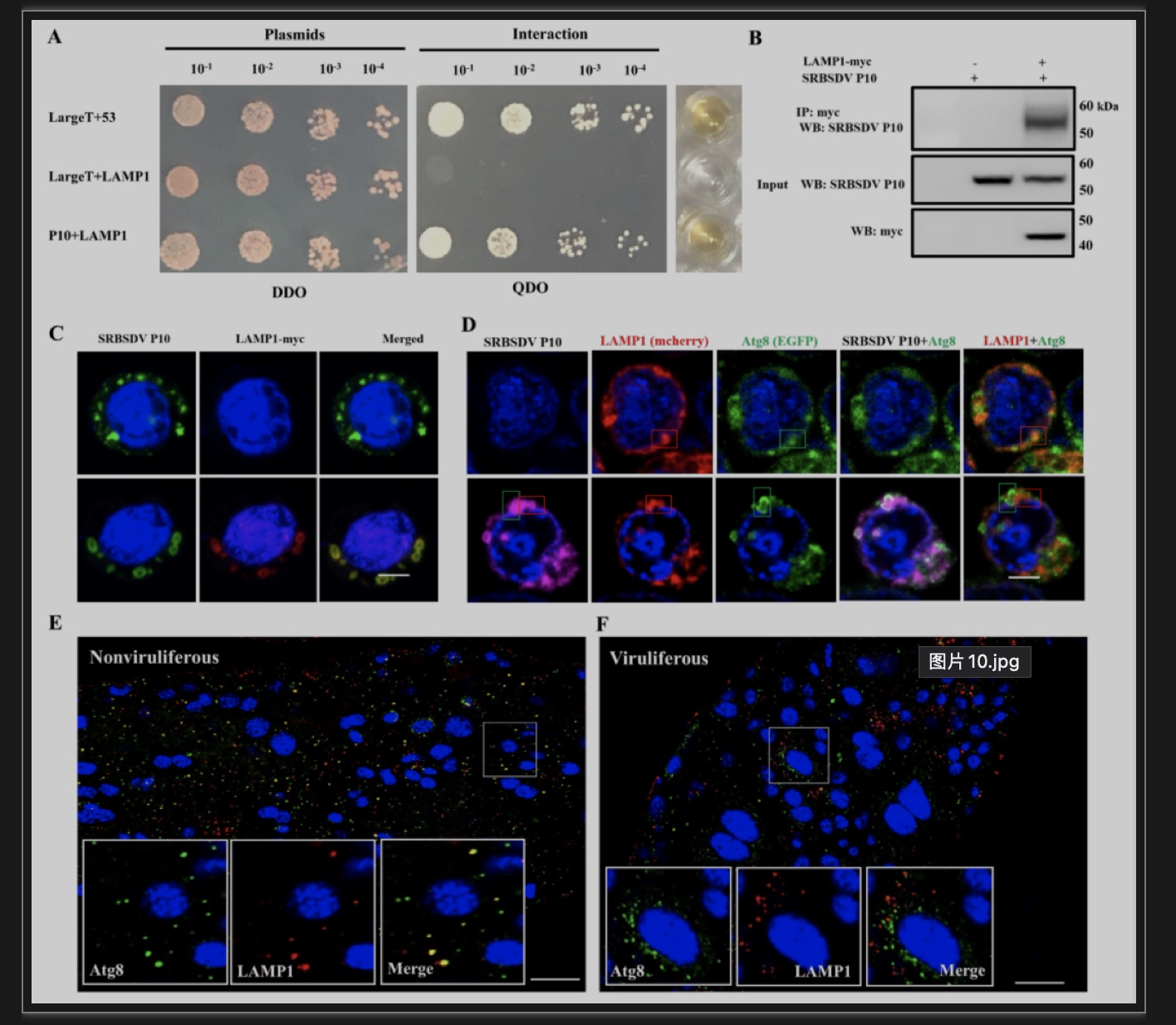
图8 P10起了空间屏障,阻止自噬体和溶酶体融合
(图源:Zhang L, et al., Plos Pathog, 2023)
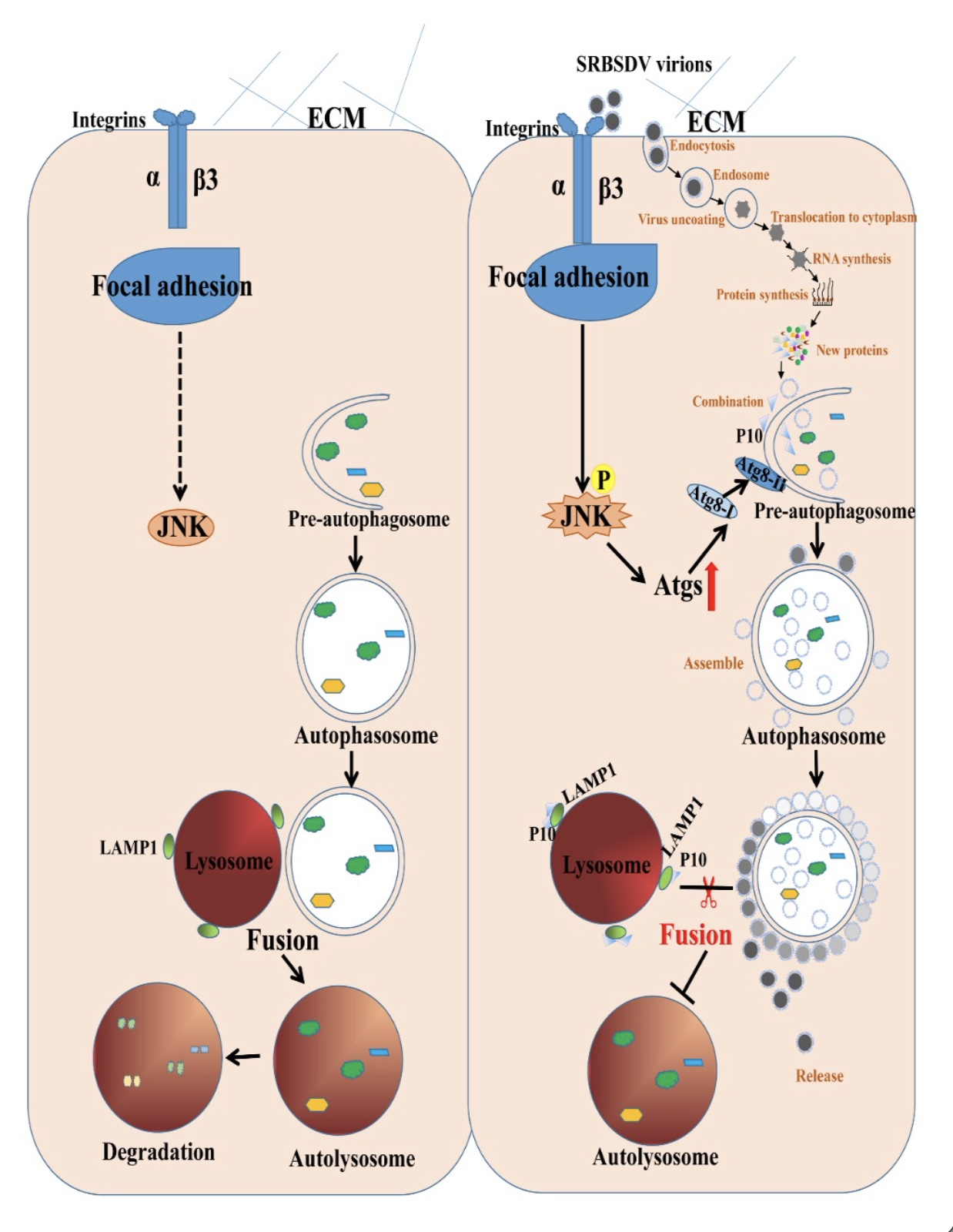
图9 SRBSDV激活介体白背飞虱不完全自噬的模式图
(图源:Zhang L, et al., Plos Pathog, 2023)

