超重和肥胖是一种由多因素引起的以体内脂肪过度蓄积为特征的慢性代谢性疾病,其发病机制包括遗传、代谢、环境和行为因素等,除少数由于疾病导致的肥胖外,绝大多数的超重和肥胖是能量的摄入超过能量消耗以致体内脂肪过多蓄积的结果。超重和肥胖可显著增加心脑血管、呼吸、内分泌、消化、运动、生殖及神经等多系统疾病风险并且严重影响生活质量[1-2]。
根据世界卫生组织发布的数据,截止至2016年,18岁及以上的成年人中约有19亿人超重,其中超过6亿人肥胖,而5-19岁的儿童和青少年中,有超过3.4亿人超重或者肥胖。截止2019年,5岁以下儿童中,有约3800万人超重或肥胖[3]。而预计到2030年,将有超过21.6亿人超重,11.2亿人肥胖。近年来,随着经济快速发展和人们生活水平的改善,我国肥胖患者数量显著增加,据《中国居民营养与慢性病状况(2020)》[4]报告显示,有超过50%的成年居民超重或肥胖,6-17岁、6岁以下儿童超重/肥胖率分别达到19%和10.4%。肥胖已经被认为是全球公共健康的明显威胁。因此,对于超重和肥胖患者的体重控制成为迫切的临床需求。他们设计了一种新型双靶点长效GLP-1/GDF15融合蛋白,并证明其在肥胖小鼠模型和肥胖食蟹猴模型中可以通过降低能量摄入进而实现减轻体重同时改善代谢指标的的疗效,为肥胖症的治疗提供了全新选择。

质肽生物团队利用蛋白质工程策略,结合体外药效实验和体内药效动物模型最终筛选出候选化合物QL1005,该分子是采用多肽连接体融合了GLP-1和GDF15类似物,并结合脂肪酸链修饰以延长其在体内的半衰期。QL1005在肥胖小鼠模型中显示出体重、食物摄入量、空腹血糖和血浆甘油三酯剂量依赖性地降低并改善胰岛素抵抗,药效作用显著强于单靶点司美格鲁肽或长效GDF15。QL1005在肥胖食蟹猴模型中同样可以剂量依赖性地降低体重、食物摄入量和血糖并改善胰岛素抵抗,同时胃肠道副作用的发生率与单靶点上市药物司美格鲁肽相当,预示着其在临床上的安全性。在食蟹猴上的药代动力学研究证实其半衰期长达41小时,有望实现临床上每周一次的给药频率。
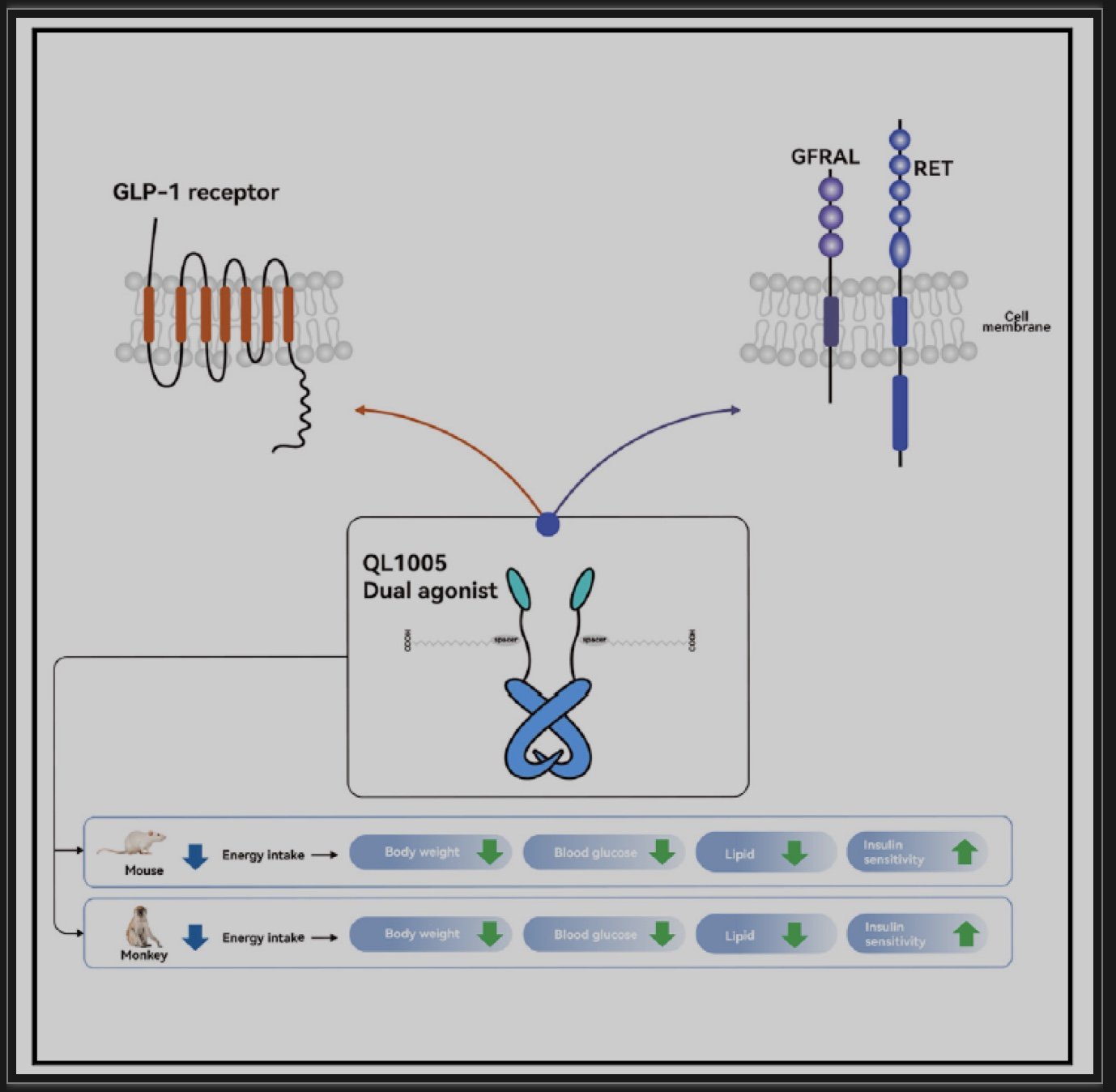
图1 活性平衡的GLP-1/GDF15双激动剂降低小鼠和非人类灵长类动物的体重和代谢障碍
(图源:Zhang Y, et al., Cell Metab.2023)

