染色体不稳定性(chromosome instability,CIN)是有丝分裂过程中染色体频繁错误分离的状态,可促进非整倍性的发展并使肿瘤更具侵袭性[1]。染色体碎裂是染色体不稳定的一个极端现象,涉及局部染色体区域内的密集碎裂和重排。目前,据估计60% - 80%的人类肿瘤显示CIN相关的染色体异常[2]。然而,诱导对肿瘤发生至关重要的染色体碎裂的驱动因素和潜在机制尚不清楚。骨肉瘤(osteosarcoma,OS)作为青少年和儿童中起源于快速生长的骨骼的最普遍的恶性肿瘤,是研究CIN在肿瘤发生中的作用的绝佳模型,其特征是高非整倍性和高染色体重排率,包括染色体碎裂[3-7]。该研究首次揭示了RanGAP1丢失会导致染色体不稳定和骨肉瘤的快速发生,阐述了RanGAP1缺失驱动染色体不稳定的机制,并开发了一种治疗方案来预防染色体碎裂和由此产生的肿瘤发生。

研究人员首先对公共数据库GEO中的微阵列数据进行了筛选,结果显示在OS形成过程中RanGAP1的表达显著减少(图1 A)。为进一步验证RanGAP1是否在骨肉瘤的形成中发挥重要作用,研究人员通过对青少年的OS临床病例以及部分其他肿瘤的临床病例的实验研究,提示RanGAP1的表达降低是OS特异性的(图1 B-E)。
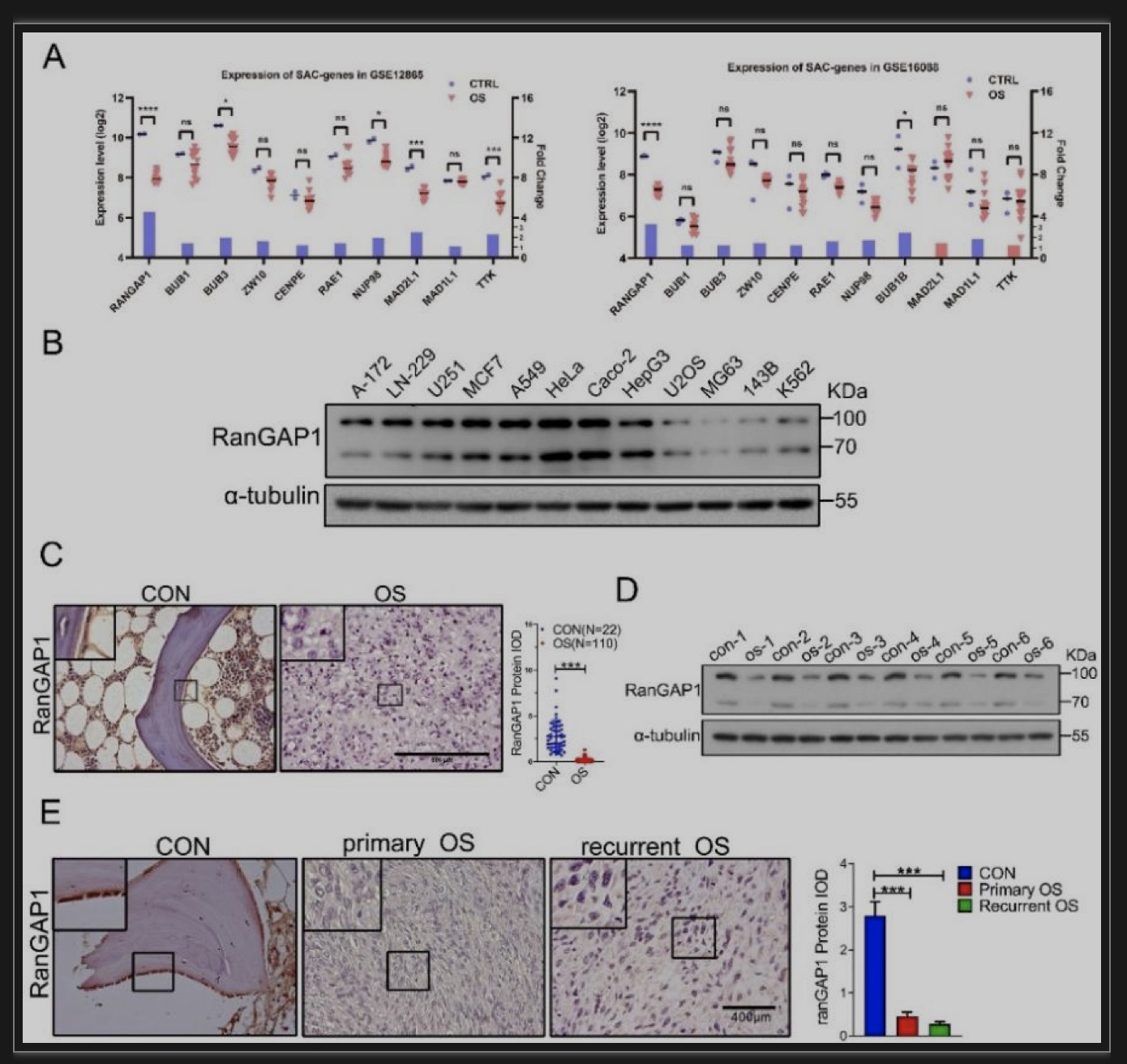
图1 人的骨肉瘤组织而非其他肿瘤组织中RanGAP1表达显著降低
(图源:Yan G, et al., Dev Cell, 2023)
为了了解RanGAP1和OS肿瘤发生的因果关系,研究者构建了成骨谱系敲除ranGAP1小鼠。有趣的是,研究者发现成骨前体细胞敲除RanGAP1的小鼠(sp7-Cre,RanGAP1fl/fl; RanGAP1OP KO)在出生后7-10天,RanGAP1OPKO小鼠都自发地出现了OS(100%显性)(图2),重现了人类儿童骨肉瘤的发病年龄和骨骼部位。
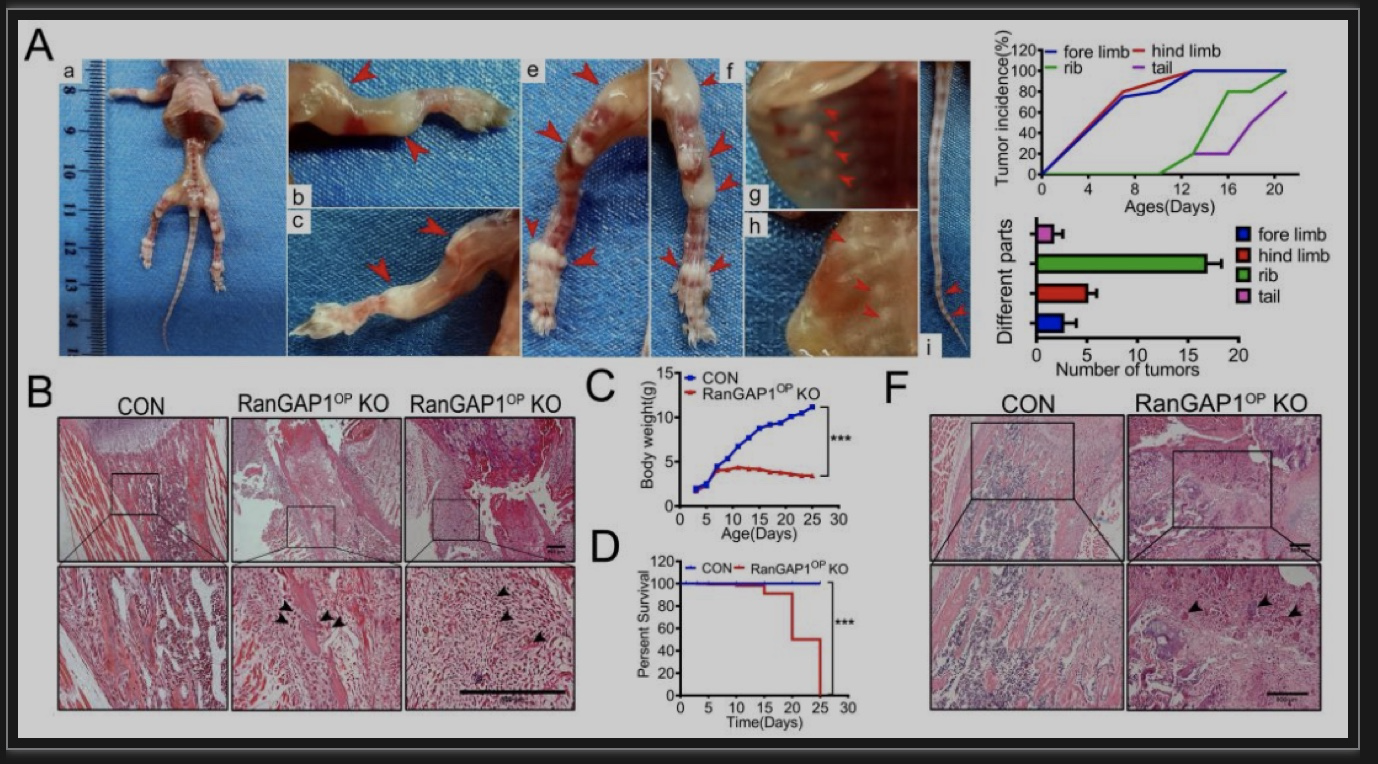
图2 成骨前体细胞中敲除RanGAP1驱动骨肉瘤发生
(图源:Yan G, et al., Dev Cell, 2023)
接着,研究者利用核型分析和全基因组测序等实验,发现在小鼠成骨前体细胞中RanGAP1的缺失会触发染色体错误分离,导致染色体碎裂并伴有严重的非整倍性(图3),进一步灭活DNA损伤检查点(DDC),从而激活致瘤途径。那么,RanGAP1缺失是如何驱动CIN和异倍体的机制呢?
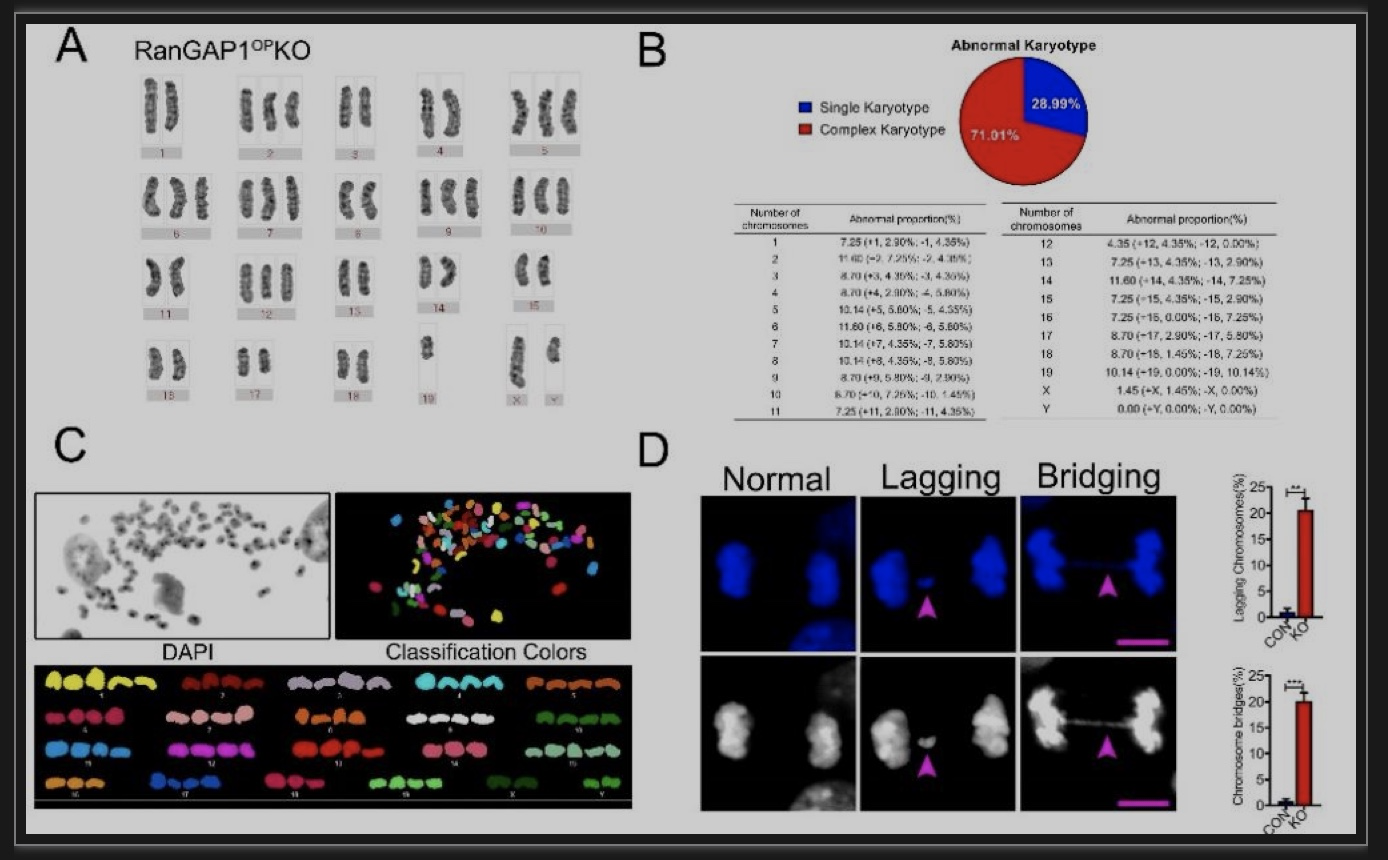
图3 RanGAP1OP KO小鼠骨肉瘤细胞的染色体不稳定
(图源:Yan G, et al., Dev Cell, 2023)
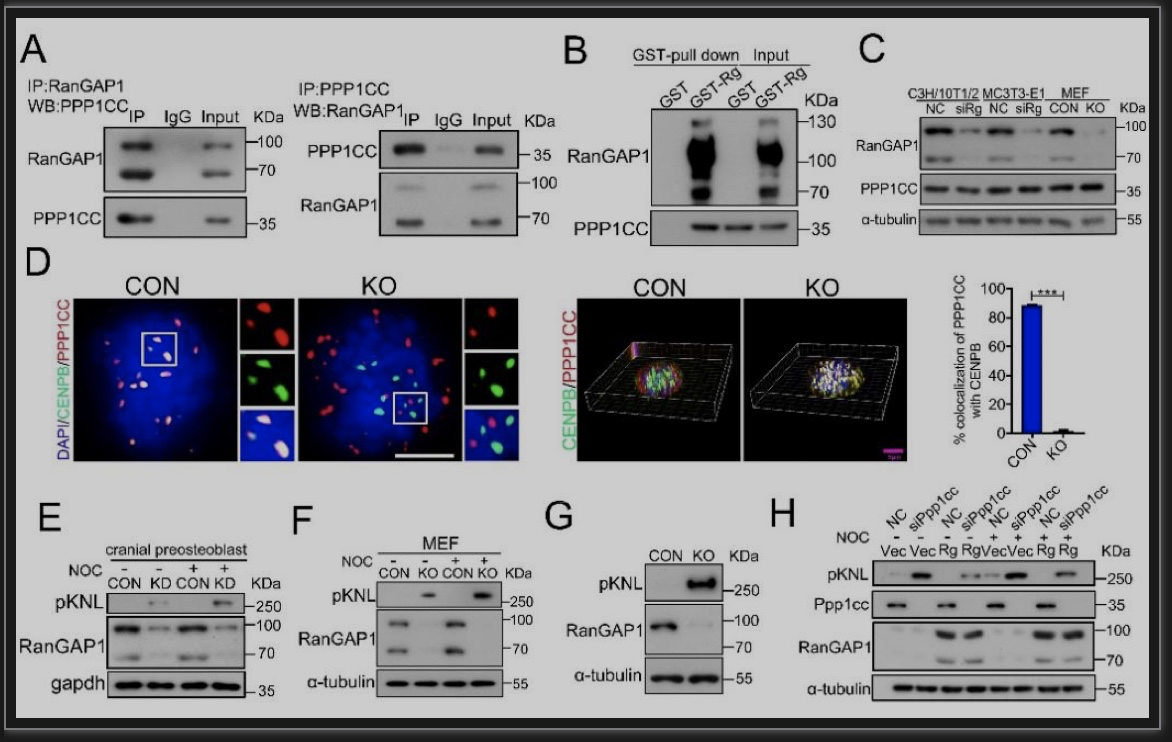
图4 RanGAP1的缺失会引起KNL过度磷酸化
(图源:Yan G, et al., Dev Cell, 2023)
CIN主要源于有丝分裂后期染色单体的错误分离。其中,纺锤体装配检查点(spindle assembly checkpoint,SAC)失控是有丝分裂后期染色单体错误分离的重要原因。SAC通过监测染色体的动粒与其动粒微管的正确配对结合,从而维持染色体稳定性。RanGAP1作为诱导激活Ran GTPase活性的蛋白21,与RanBP2复合后能调控染色体与动粒微管的配对结合。于是,研究者推测RanGAP1是维持染色单体的精确分离的必要条件,其缺失则引起SAC失控,促进异倍体的形成,从而驱动骨肉瘤的肿瘤发生。为验证这一假设,研究人员进行了蛋白组学和免疫共沉淀等实验,结果显示在快速增殖的成骨前体细胞,RanGAP1的缺失通过KNL过度磷酸化(图4)和TOP2A的降解(图5)引起SAC失控和CIN。也就是说,RanGAP1可以作为一种支架蛋白来招募参与控制有丝分裂保真度和染色体稳定性的因子。最后,研究者针对RanGAP1及其SAC靶标对源于OS病人的移植瘤和RanGAP1OP KO骨肉瘤小鼠进行了治疗。
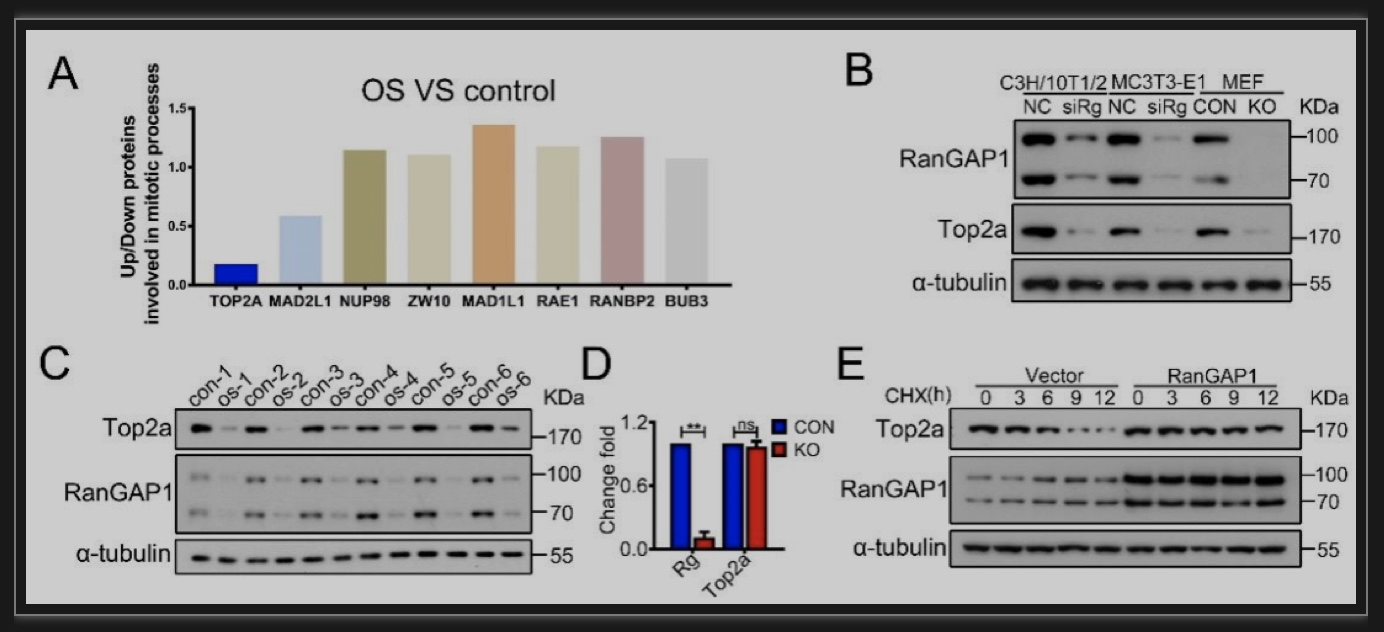
图5 RanGAP1的缺失会引起TOP2A的降解
(图源:Yan G, et al., Dev Cell, 2023)
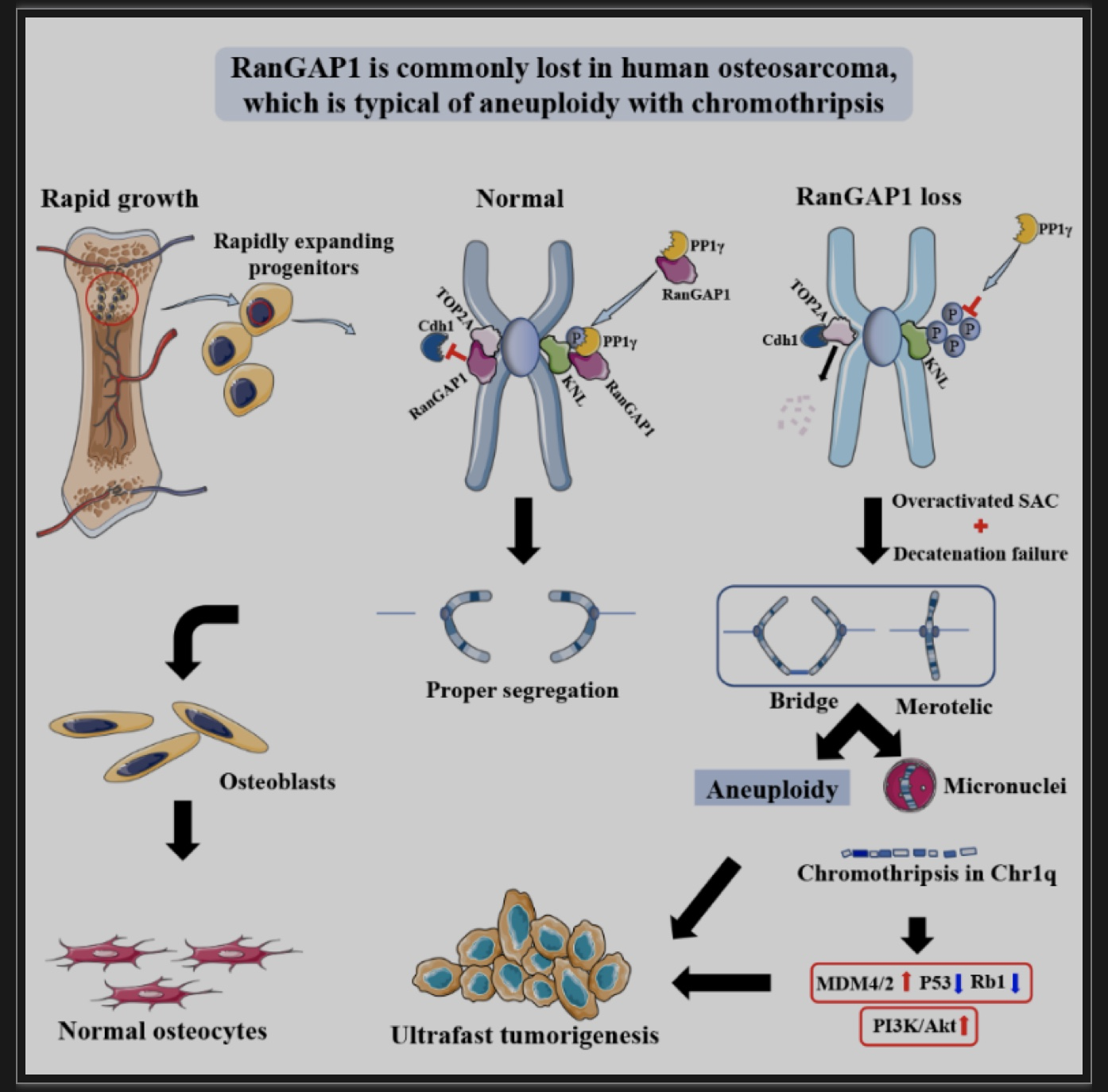
图6 机制图
(图源:Yan G, et al., Dev Cell, 2023)

