荚膜是许多细菌和部分真菌最外层的多糖结构,携带荚膜多糖的细菌病原体是造成人类重大感染性疾病,尤其是肺炎、脑膜炎、腹膜炎和败血症的主要元凶[1]。早在1944年,Avery等人利用肺炎链球菌荚膜多糖在细菌毒力中的重要作用,发现了DNA是生命的遗传物质,成为20世纪生命科学领域最伟大的发现之一[2]。最近,清华大学医学院张敬仁课题组发现了细菌荚膜在血流感染中特有的免疫逃逸功能,即抵抗肝脏巨噬细胞——枯否细胞的免疫清除。反之,作为宿主天然免疫的一部分,枯否细胞能够利用特异性受体识别特定的细菌荚膜多糖,从而介导了这些病原细菌的免疫清除[3, 4]。然而,细菌的荚膜多糖具有高度可变性,这意味着宿主体内可能存在丰富的免疫识别受体,如何发现这些荚膜多糖受体仍然具有一定的挑战性。该文章提出了一整套针对荚膜多糖识别受体的高通量筛选和功能验证方法,并且以肺炎链球菌14型荚膜多糖为例,展示了发现首个枯否细胞表面荚膜受体ASGR的流程。该系统的优势在于能够从大批量蛋白质样品中筛选高亲和力的特异性荚膜多糖受体或结合蛋白,同时从生物学功能角度明确了所鉴定的荚膜多糖受体的免疫功能。该工作打破了以往仅能局限于单一配体-受体互作的限制,为今后研究宿主针对细菌荚膜多糖的天然免疫识别机制提供了有力工具。

除了荚膜多糖以外,细菌表面的其他组分例如磷壁酸、肽聚糖、表面蛋白等都是天然免疫识别的靶点,为了排除这些细菌因子的干扰,研究者首先利用乙醇沉淀技术纯化了肺炎链球菌的荚膜多糖(capsular polysaccharide, CPS),随后基于羟基修饰将CPS共价偶连到带有羧基的聚乙烯微球(直径2 μm)表面,获得了与细菌大小相似的CPS微球,作为高效亲和筛选特异性受体的“诱饵”。同时,作者利用流式细胞术分选获得了高纯度的肝脏枯否细胞,制备了枯否细胞的膜蛋白样本,作为筛选荚膜多糖受体的“猎物”。
随后,研究团队设计了基于配体-受体亲和互作的高通量筛选模型。作者选择低毒力14型肺炎链球菌的荚膜多糖(CPS14)为代表,将CPS14微球和枯否细胞表面蛋白文库混合孵育,通过洗涤去除未结合到微球上的杂蛋白,然后利用蛋白质谱技术鉴定CPS14微球所结合的蛋白质信息。同时,作者选择了高毒力8型肺炎链球菌的荚膜多糖(CPS8)作为阴性对照,通过比较蛋白组学和生物信息学分析获得了CPS14微球高度富集的蛋白,即潜在的CPS14的免疫识别受体(图1)。
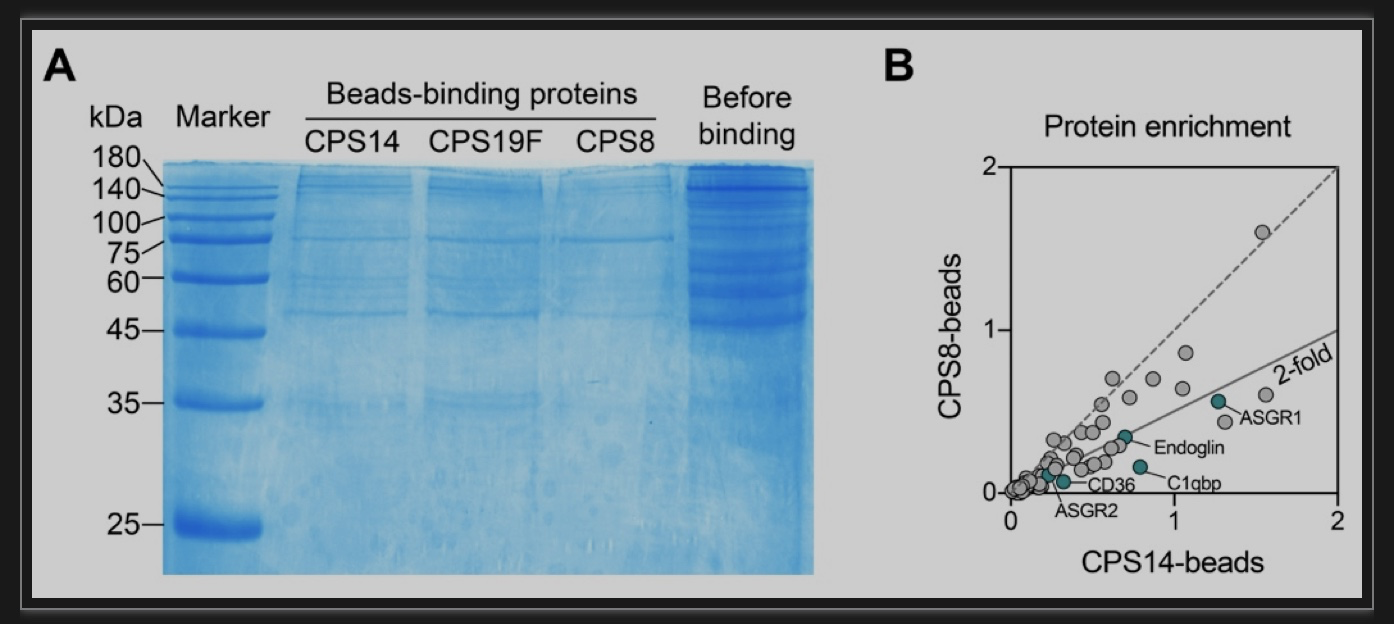
图1 基于比较蛋白组学筛选的潜在CPS14结合蛋白
(图源:An H, et al., STAR Protoc, 2023)
最后,研究团队设计了体外细菌-细胞结合模型,用以验证候选荚膜多糖受体的功能。作者将富集水平最高的5个蛋白借助慢病毒侵染方法稳定整合到中国仓鼠卵巢细胞(CHO细胞)中,检测了表达靶蛋白后CHO细胞对14型肺炎链球菌的结合水平,发现去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGR)能够显著提高CHO细胞结合7F和14型菌株的能力,并且该结合能够特异性被相应的CPS7F和CPS14抑制,从而确定了ASGR识别7F和14型肺炎链球菌荚膜多糖的免疫学功能(图2)。
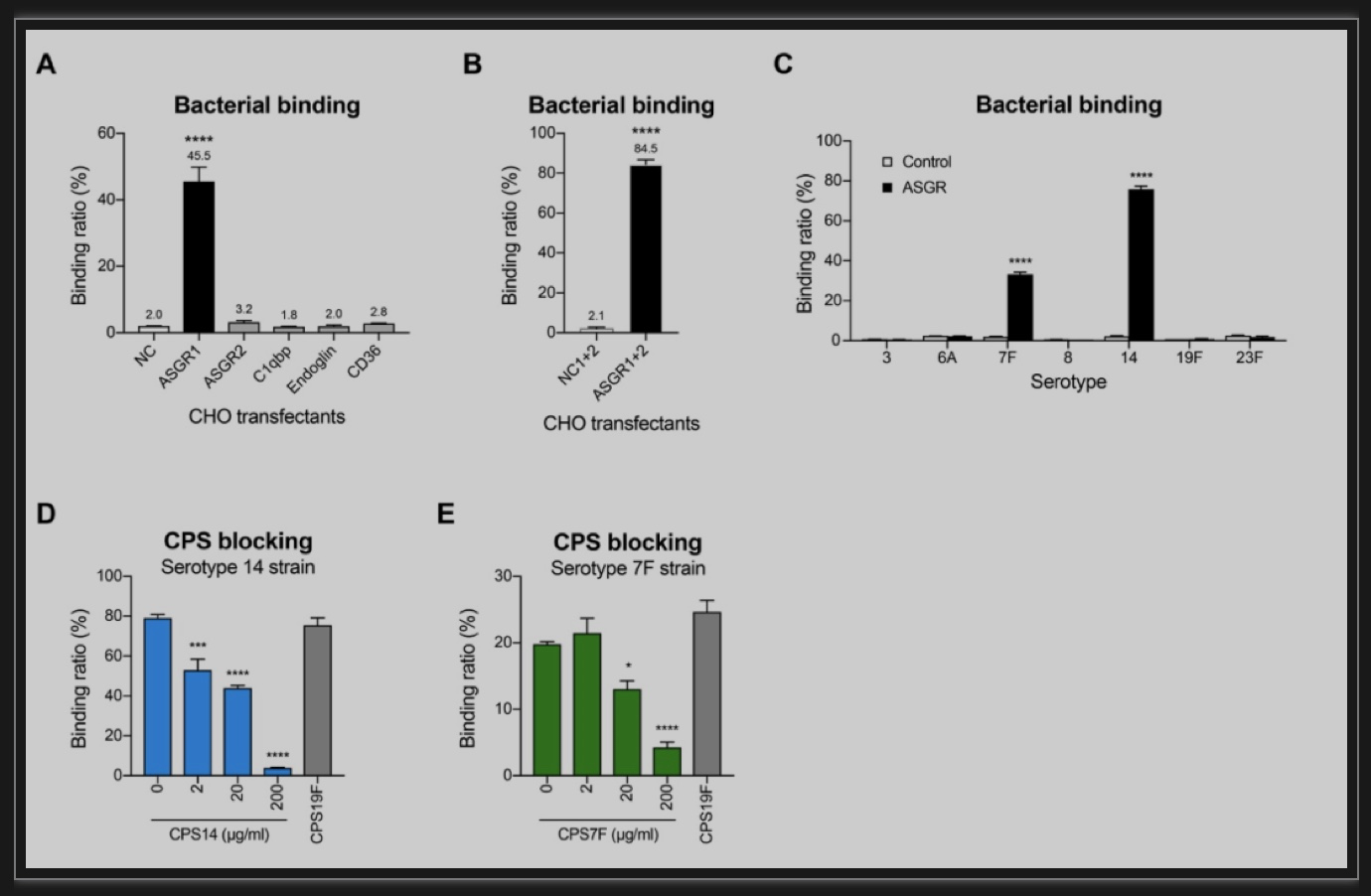
图2 体外细菌结合实验验证ASGR的免疫学功能
(图源:An H, et al., STAR Protoc, 2023)
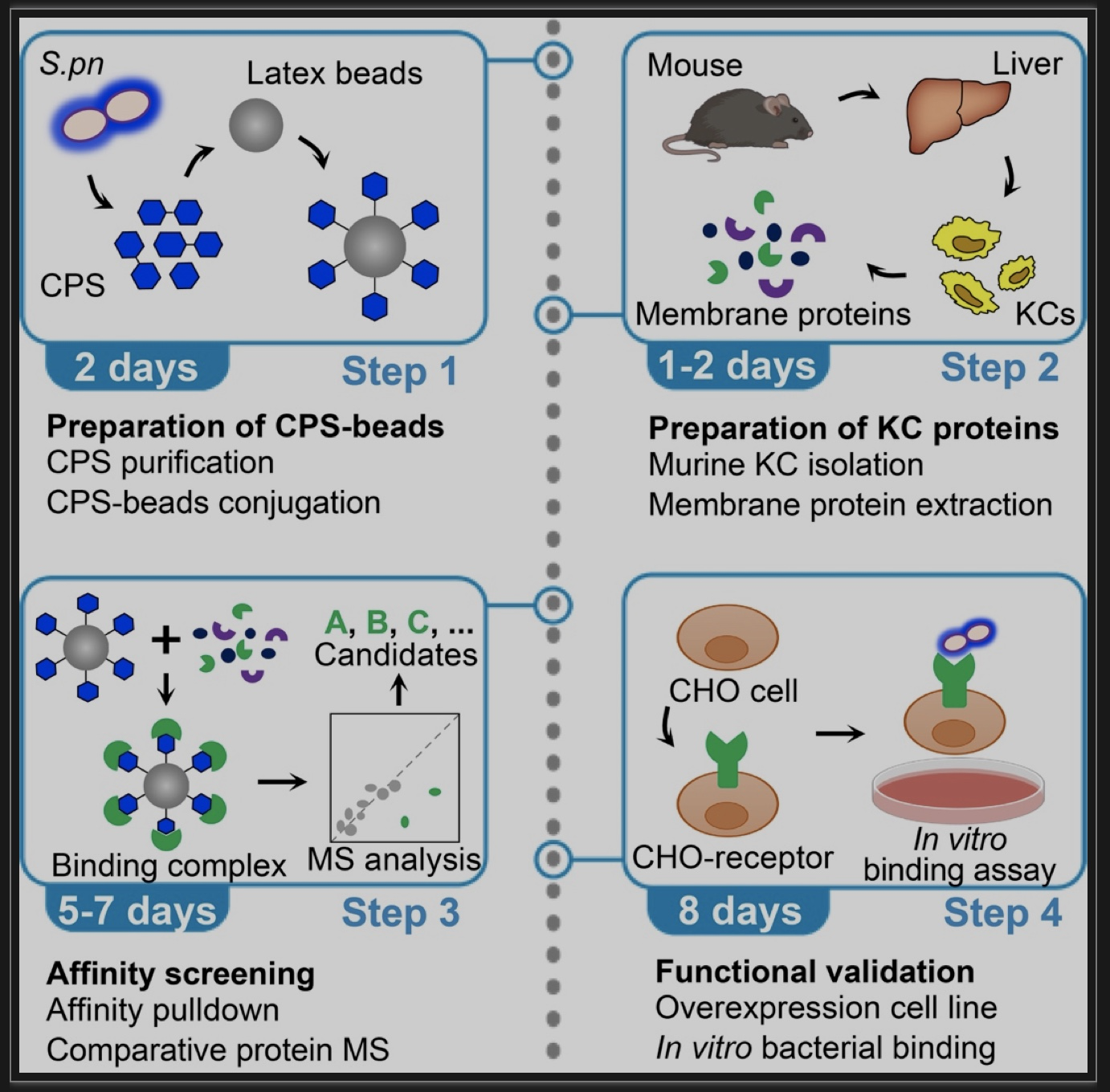
图3 利用亲和筛选鉴定细菌荚膜多糖识别受体的实验方案
(图源:An H, et al., STAR Protoc, 2023)

