二甲双胍(metformin)是临床一线抗高血糖药物,也是一个多靶点药物,不断有新靶点被证实介导二甲双胍的生物学效应[1]。随着二甲双胍被广泛使用,越来越多的临床研究发现,使用二甲双胍的病人其患癌风险会下降。例如,研究人员发现二甲双胍与结直肠癌、胃癌的患癌风险下降有关[2-4]。但是,这一现象并非具有普遍性,例如在乳腺癌中,二甲双胍降低或者预防肿瘤发生就存在争议[5,6],而在膀胱癌中,二甲双胍并未表现出降低患者癌症发生率[7],提示双胍类预防或治疗肿瘤的效果可能与癌细胞类型有关。不仅如此,研究中使用的剂量也可能与二甲双胍抗肿瘤效果存在差异相关。因此,揭示二甲双胍在细胞中新的作用靶点对理解其抗癌机制具有重要意义。该研究发现双胍类药物可以时间依赖性和浓度依赖性地下调多种癌细胞中磷脂酶D1(phospholipase D1, PLD1)的蛋白表达,并从磷脂酶D1的生物合成的各个环节展开研究,发现双胍类药物通过抑制mTOR信号通路,从而选择性地降低PLD1和其他基因如天门冬酰胺合成酶(asparagine synthetase, ASNS)的mRNA翻译效率,抑制其后续的蛋白合成。该研究发现PLD1作为双胍类药物在细胞内的新作用靶点,为理解双胍类药物抗癌作用机制提供了新的理论依据。

PLD1一方面可以通过催化生成第二信使磷脂酸(phosphatidic acid, PA)调节癌细胞增殖和迁移等[8],另一方面也可以通过其特定结构域与其他蛋白互作,参与细胞生理病理活动的调控[9],是潜在的癌症治疗靶点。作者通过生信分析,发现PLD1表达水平与肺腺癌、脑低级别胶质瘤、膀胱尿路上皮癌和胃癌的癌症患者生存期相关,并在这些癌症的代表性细胞系中,敲低PLD1蛋白表达,发现癌细胞迁移能力显著下降,提示抑制癌细胞内PLD1蛋白表达对癌症治疗具有积极意义。作者随后利用二甲双胍和苯乙双胍处理癌细胞,发现在HeLa、A549、MCF-7、TR146、HepG2、HCT116、HGC-27、PC3和TCCSUP等九种癌细胞(图1B),PLD1蛋白表达响应双胍类药物处理而下调,且临床剂量下的双胍类药物延长处理时间依然可以显著抑制PLD1蛋白表达(图1E)。
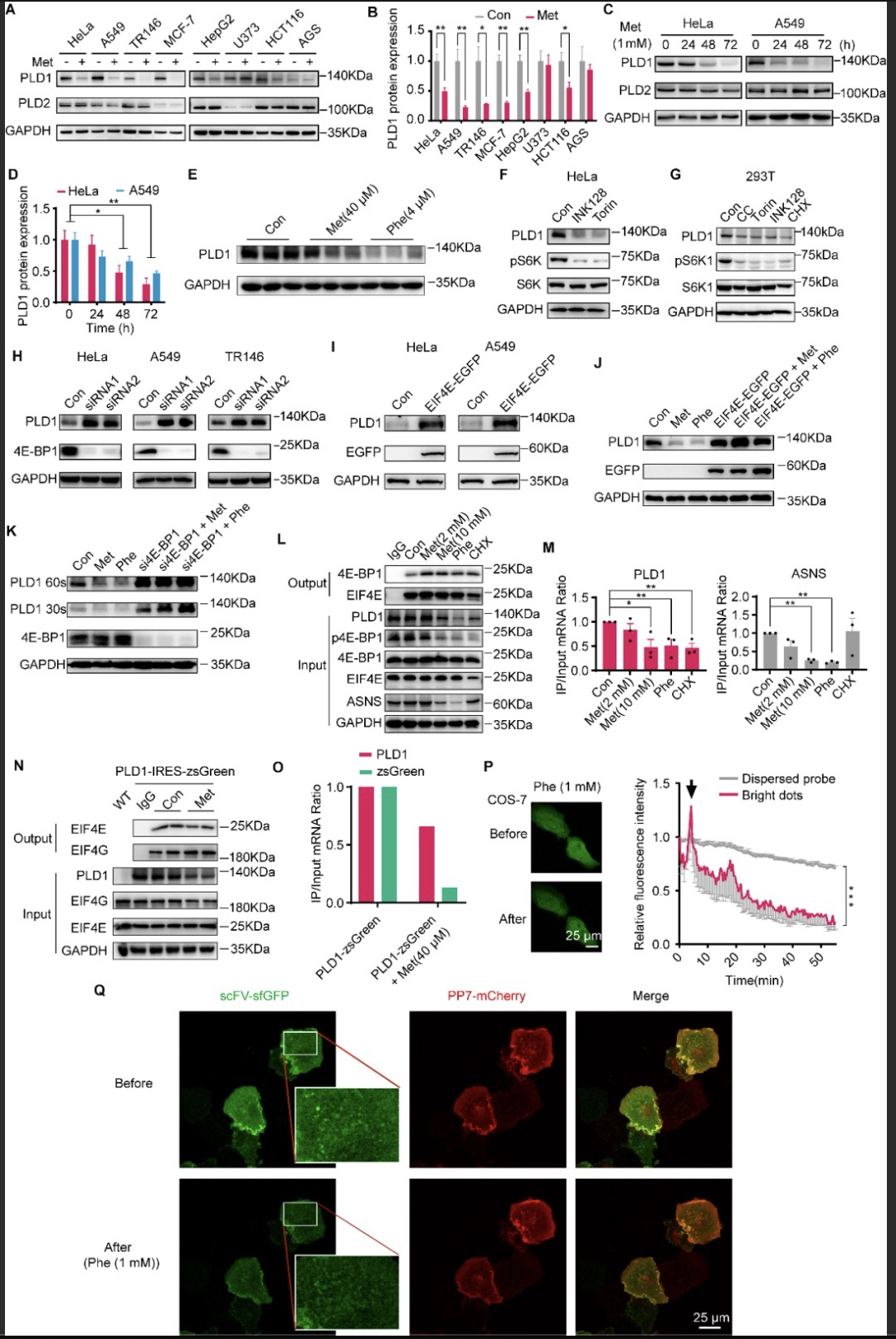
图1 双胍类药物下调PLD1蛋白表达及其机制
(图源:Yao Y,et al., Genes & Diseases, 2023)
进一步研究发现,双胍类药物并未抑制PLD1基因转录,且分别与泛素化抑制剂和溶酶体抑制剂共处理并未逆转PLD1蛋白表达的下调。随后研究发现,抑制mTOR信号通路亦可导致PLD1蛋白表达下调,过表达mRNA翻译相关的蛋白EIF4E或敲低4E-BP1(mRNA翻译负性调控因子)蛋白表达均会导致PLD1蛋白表达水平升高(图1H, I),且在这两种条件下,双胍类药物对PLD1的调节作用减弱或消失(图1J, K),提示mTOR信号通路以及mRNA翻译过程与双胍类药物诱导的PLD1蛋白表达下降有关。进一步通过RNA-IP实验,结合qPCR和RNA-seq技术,分析细胞内处于翻译状态和mRNA总量的比值,结果显示双胍药物处理后,EIF4E与4E-BP1的结合减少,处于翻译状态的PLD1和阳性基因ASNSmRNA比率下降(图1L, M)。最后,利用mRNA翻译成像技术[10]发现苯乙双胍处理后,PLD1mRNA翻译所形成的新生肽减少,再次证明双胍类药物通过抑制PLD1mRNA翻译效率,减少其蛋白合成(图1P, Q)。
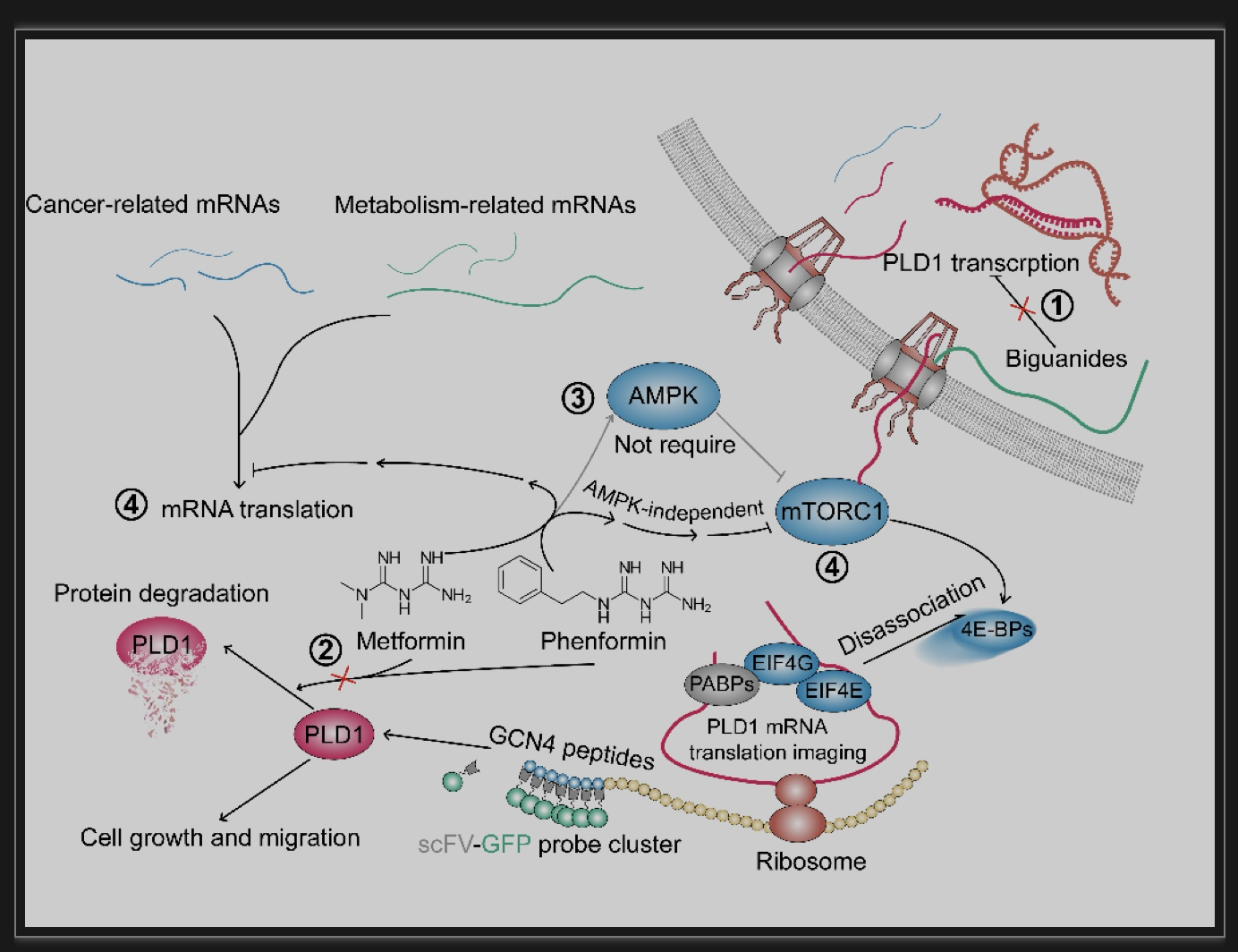
图2 双胍类药物下调PLD1蛋白表达的分子机制总结
(图源:许迎科教授团队)

