
一、ASIC1a概述
每个ASIC1亚单位的结构特征是结构域排列类似于直立的前臂和紧握的手。值得注意的是,手掌、球、手指和拇指区域的残基结合在一起,在细胞外区域产生一个酸性口袋,带极大的负电荷。至关重要的是,在天冬氨酸或谷氨酸残基的侧链之间发生的两对羧基-羧酸相互作用异常紧密,使分子能够感知pH[1]。

图1 ASIC1a结构图、横断面图和ASICs的活化pH
二、ASIC1a电生理
ASIC可以在不经历激活过程的情况下实现稳态脱敏和从闭合状态到脱敏状态的转变(图1B和图2)。在环境中质子浓度略有增加的情况下,通道不会被激活,但会对随后的强酸刺激做出反应,这种刺激可能较弱或根本不存在。ASIC1a脱敏开始于pH值略低于7.4的水平,持续的酸化导致所有通道在pH值低于7.1时完全脱敏。因此,ASIC1a由于完全脱敏而无法编码连续的酸性,尽管它可以在几秒钟内从脱敏中恢复。值得注意的是,ASIC1a可以在没有明显激活的情况下进行脱敏;其半脱敏的pH最大值为7.15[4](图2)。

三、ASIC1a的分布

四、ASIC1a在细胞凋亡机制调控中的作用
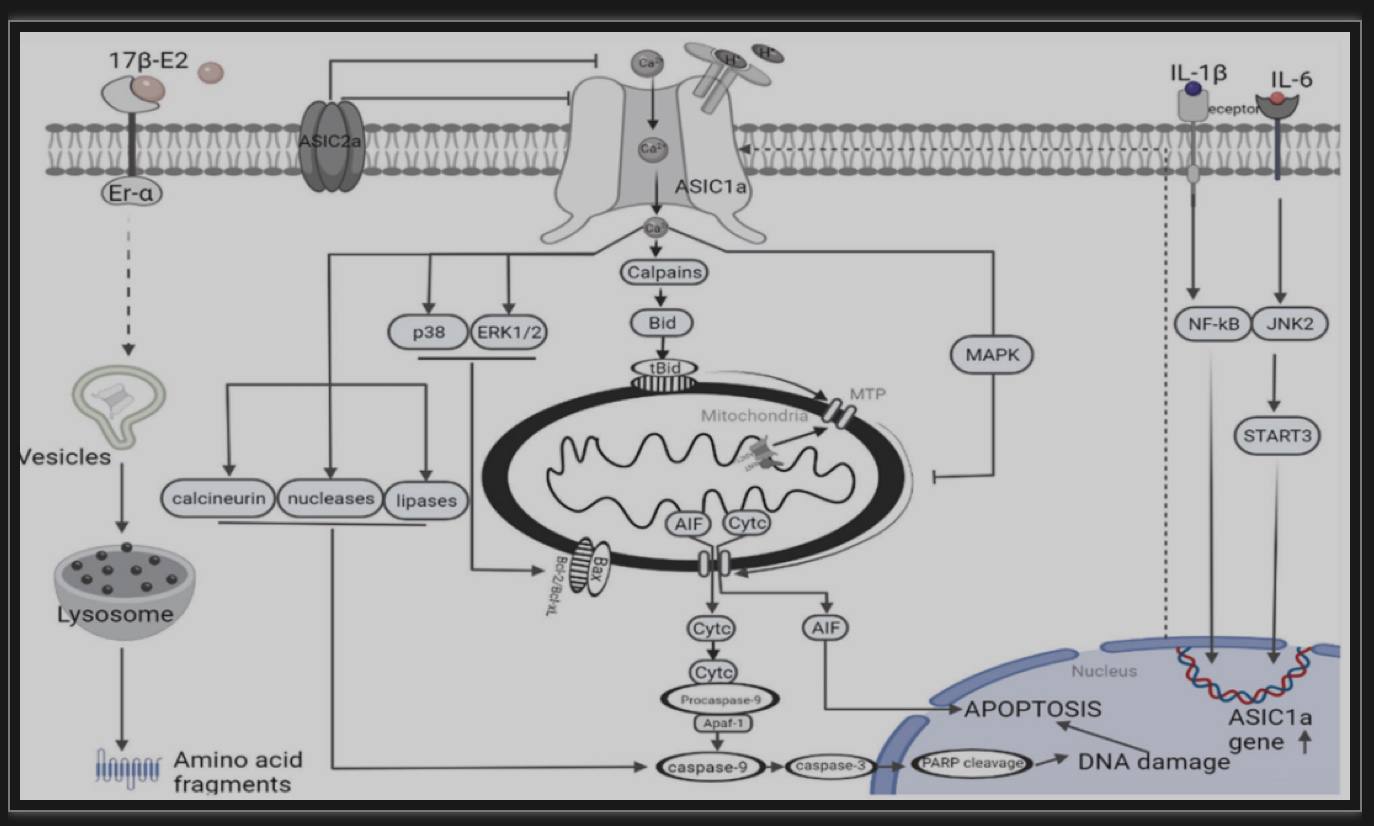
学习、记忆和大脑活动只是涉及ASIC离子通道家族的几个生理活动。ASIC还对几种疾病有重要影响,包括RA、胶质瘤、中风和神经细胞凋亡,是ASIC家族的重要成员,因为它们通过诱导多种细胞类型的凋亡来加速疾病的发展。例如,在缺氧或缺血条件下,ASIC1a的激活可以引起细胞外钙内流,并诱导RGCs、肾小管上皮细胞和神经元的凋亡。ASIC1a还通过同源或异源亚基调节不同癌症的抗凋亡通路,包括胶质瘤、黑色素瘤、肺癌和肝癌。使用MANBALGIN-2抑制ASIC1a可以显著促进癌细胞凋亡和减缓疾病进展。相反,ASIC1a强烈促进RA期间软骨细胞的凋亡。IL-1β、肿瘤坏死因子-α和IL-6通过多种途径激活ASIC1a,包括钙蛋白酶或ASIC2,导致钙内流和软骨细胞凋亡。此外,ASIC1a可以通过自噬调节软骨细胞的凋亡。在降解的椎间盘的酸性微环境中,由于ASIC1a激活促进了凋亡相关蛋白的水平增加,EP软骨细胞经历了凋亡。此外,ASIC1a的激活也导致BMSCs的钙依赖性凋亡[6]。
五、总结与展望
细胞凋亡作为细胞的基本生物学过程之一,关系到细胞的凋亡和抗凋亡过程之间的平衡。简单地促进或抑制细胞凋亡一直是研究的焦点,它将在生物体内导致各种毒副作用。很少有研究考虑调节细胞凋亡和抗细胞凋亡过程之间的平衡。离子通道是细胞和外部环境之间沟通的非常重要的障碍。离子通道的靶向调节或竞争性结合是调节细胞过程的重要方法。例子包括开发各种人造亚纳米孔、亚纳米通道和亚纳米狭缝,具有良好的离子选择性和渗透性,用于信号通信和生物传感。除了人工合成通道外,开发不同于PCTX-1的新型竞争性特异性通道阻滞剂是另一种调节细胞凋亡平衡的策略。这一领域的研究主要集中在寻找一种可靠、便捷的手段来研究细胞凋亡的平衡。最近关于ASIC1a的数据为其在不同细胞类型的细胞凋亡中的机制和功能提供了新的见解。这些知识可以为诊断和治疗多种疾病提供科学依据。然而,需要进一步的研究来探索ASIC1a在未被研究的组织或疾病中的表达和作用,并了解其作用因组织环境而异的原因。研究者认为,科学技术和实验技术的进步将给ASIC1a的研究带来机遇和挑战[7]。

