脂酶属于水解酶家族,由于其骨架所具有的不对称性,两个对映体与酶蛋白空腔结合的能力、在空腔中心的反应速率会呈现差异,所以脂酶非常适合用于分离外消旋体。
又因为脂酶的骨架结构及亲脂性,它在有机溶剂中也能保持活性,所以其通常被用于动力学拆分。
作用原理
在水解反应过程中,处于脂酶催化中心的亲核性丝氨酸,能够与酰胺或酯类化合物形成酰基-酶复合物。随后,通过丝氨酸上的羟基,蛋白质自身能够转变成一个所谓的“酰基”模式,这个复合物能够与另一分子亲核试剂发生反应,比如说,胺类化合物。
胺类化合物进攻酶上的酯基,随后丝氨酸上的氧原子键断裂形成新的酰胺键。正因为左旋或右旋的胺与复合物发生反应的优先性不同,所以脂酶能够用来拆分外消旋化合物。
实例解析
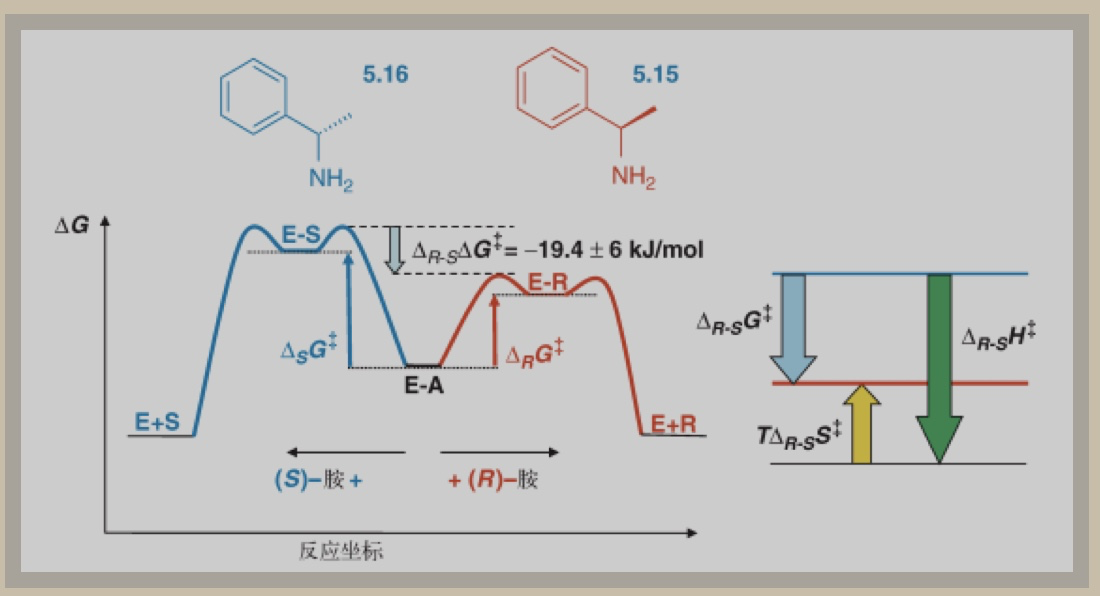
通过考察(R)-苯乙胺5.15和(S)-苯乙胺5.16与南极假丝酵母脂酶的反应,研究人员发现了酶是如何区分胺类化合物对映异构体的原理,如图1。
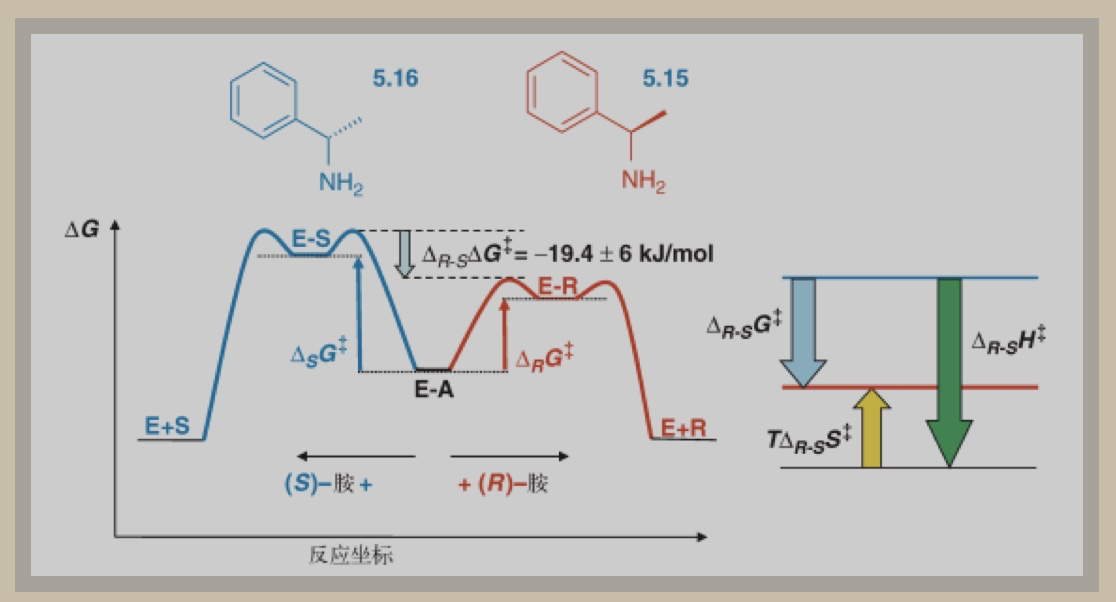
图1 (R)-苯乙胺5.15和(S)-苯乙胺5.16与南极假丝酵母脂酶先形成酰基-酶复合物E-A
动力学参数研究显示,焓更稳定的R-型胺与S-型胺相比,反应速率更快、能垒更低。虽然S-型胺的熵更稳定,但综合两种因素来看, R型的自由能(△G)更低,如图1。
如何理解这种区别呢,研究人员通过在原化合物中的四面体碳原子处引入磷原子(5.17和5.18,如图2)合成了新的过渡态衍生物。该衍生物比带有碳原子的过渡态稳定性更好。同时研究人员合成了该化合物的对映异构体及其与脂酶的复合物。
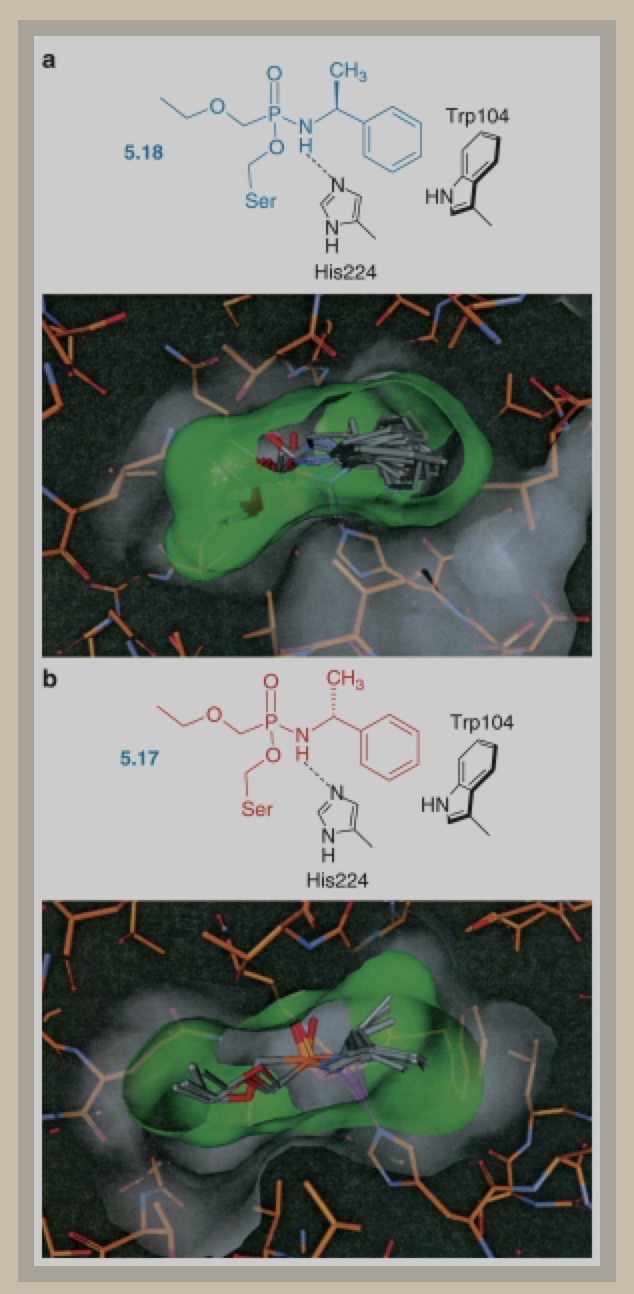
图2 复合物5.18模拟了含磷脂酶与S-型胺(a图)的过渡态结构
Marco Bocola尝试培养了这两个复合物的晶体结构并研究其过渡态,发现反应速率更快的R-型复合物与蛋白质空腔的结合更好,而反应速率较慢的S-型复合物与蛋白质空腔的结合则较为疏松,如图2。
通过计算机模拟和分子动力学研究都证明了在脂酶催化的反应中,与蛋白质结合更好的R-型复合物的空间构型更有利于反应,而结合能力较弱的S-型复合物较难反应,脂酶催化反应效率更低。
另外, R-型复合物被固定在一个类似钳子的狭窄空腔中,与酶形成一个优势的焓接触,而这使得R-型复合物相对S-型复合物就具有了较大的焓优势,但也付出了熵值上的代价。R-型复合物立体中心上的甲基能够嵌人结合口袋中的狭小空腔。
由于S-型复合物甲基空间结构与R-型呈镜面异构,导致化合物无法很好地固定在蛋白质空腔中,与催化中心结合较疏松,所以无法与脂酶紧密地结合。对熵值来说这是优势,但对焓值来讲,因为失去了与底物良好的相互作用导致复合物无法与蛋白质空腔很好地结合。
最终焓值起到了更关键的作用,所以R-型的胺转化速率更快,由此可以确信,在实际应用中R型的胺产率更高。如果将脂酶负载在固相载体并灌装在玻璃柱中,那么只要在柱中制备好酰基化合物,随后倒人外消旋的胺类化合物,R-型的胺和S-型的胺溶液就能简单地通过不同的容器收集。只要溶剂得当,相应的酰胺化合物就能通过重结晶直接得到。
有趣的是,温度升高和酶结合口袋的增大会导致动力学拆分的选择性降低。通过把催化口袋边缘的色氨酸替换为组氨酸,或者升高温度都会将使结合口袋的空腔变大,导致酯酶与两个底物的结合变得疏松。在这些条件下,原来反应较快的R-型复合物就失去了它的焓优势,R-型和S-型之间熵值的差别也趋于平衡。
结语
这个例子从分子水平上解释了脂酶如何参与完成动力学拆分。研究人员同样也可以通过一系列结构信息和能量参数分析,将脂酶应用到其他化学反应中。
因此,具有高度选择性的酶催化反应在新药手性合成砌块中所扮演的角色日益重要。

