水通道蛋白(Aquaporins, AQPs)是人体内负责水和甘油转运和调控的重要膜蛋白,此外AQPs也被报道在胞内信号,细胞迁移和黏附中发挥重要作用[1]。水/甘油通道蛋白7 (Aquaglyceroporin 7, AQP7) 主要表达在脂肪组织中,在其中介导甘油的跨质膜流动,这样在营养代谢,糖尿病及相关疾病中发挥重要的生理作用。在啮齿动物胰岛β细胞中,AQP7介导甘油的快速跨膜流动并促使胰岛素分泌 [2-3], 然而关于AQP7在人类胰岛细胞中的功能研究却是极为稀少的。在结构方面,与其他水通道蛋白相似,AQP7也被广泛认为是由四个同源单体组成的四聚体,而由四个单体形成的中间通道被称作中心孔道 (central pore)。在四聚体中,每个单体是一个独立的甘油通道,然而关于中心孔道的功能一直被讨论但却是未知的。因此深入研究AQP7在胰岛细胞中的作用以及阐明中心孔道的功能对于理解AQP7相关的代谢性疾病具有重要的生理意义。该研究分析了AQP7在188个人体胰岛样本中的基因表达并展示了2.55 Å分辨率的 AQP7冷冻电镜结构。作为AQP家族在蛋白质数据库中唯一有效的冷冻电镜结构,研究人员在该结构中发现两个四聚体通过胞外环相互黏附形成一个八聚体,并在每个四聚体所形成的中心孔道中观察到完整的电子密度并结合气相色谱质谱显示了3-磷酸甘油存在于中心孔道中的可能性。总的来说,该研究展示了AQP7独特的八聚体组装,也显示出AQP7除了作为水甘油通道,也可能在胰腺组织中作为连接蛋白发挥作用。

之前的研究已经显示AQP7表达在啮齿动物胰岛中并且在II型糖尿病模型中这一表达下调[3-4]。为了研究是否AQP7在人类胰岛中表达,研究人员采用免疫组化的方法对来自于血糖正常的人胰腺组织切片进行染色,结果显示AQP7与胰岛素,胰高血糖素和生长抑素共表达 (图1a)。相似的表达形式也在单细胞转录组分析中观察到,这也证实了AQP7被表达在人胰岛α, β和δ细胞中(图1b)。接下来研究人员评估了AQP7在II型糖尿病患者胰岛中的表达,通过对188人体样本进行RNA测序分析显示出AQP7基因表达水平在II型糖尿病患者胰岛中是减少的 (图1c)。此外,AQP7在胰岛中的表达被检测出与人体体重指数(body mass index, BMI)呈现负相关(图1d),这也暗示着AQP7的表达与行使正常的胰岛功能以及机体代谢是相关的。
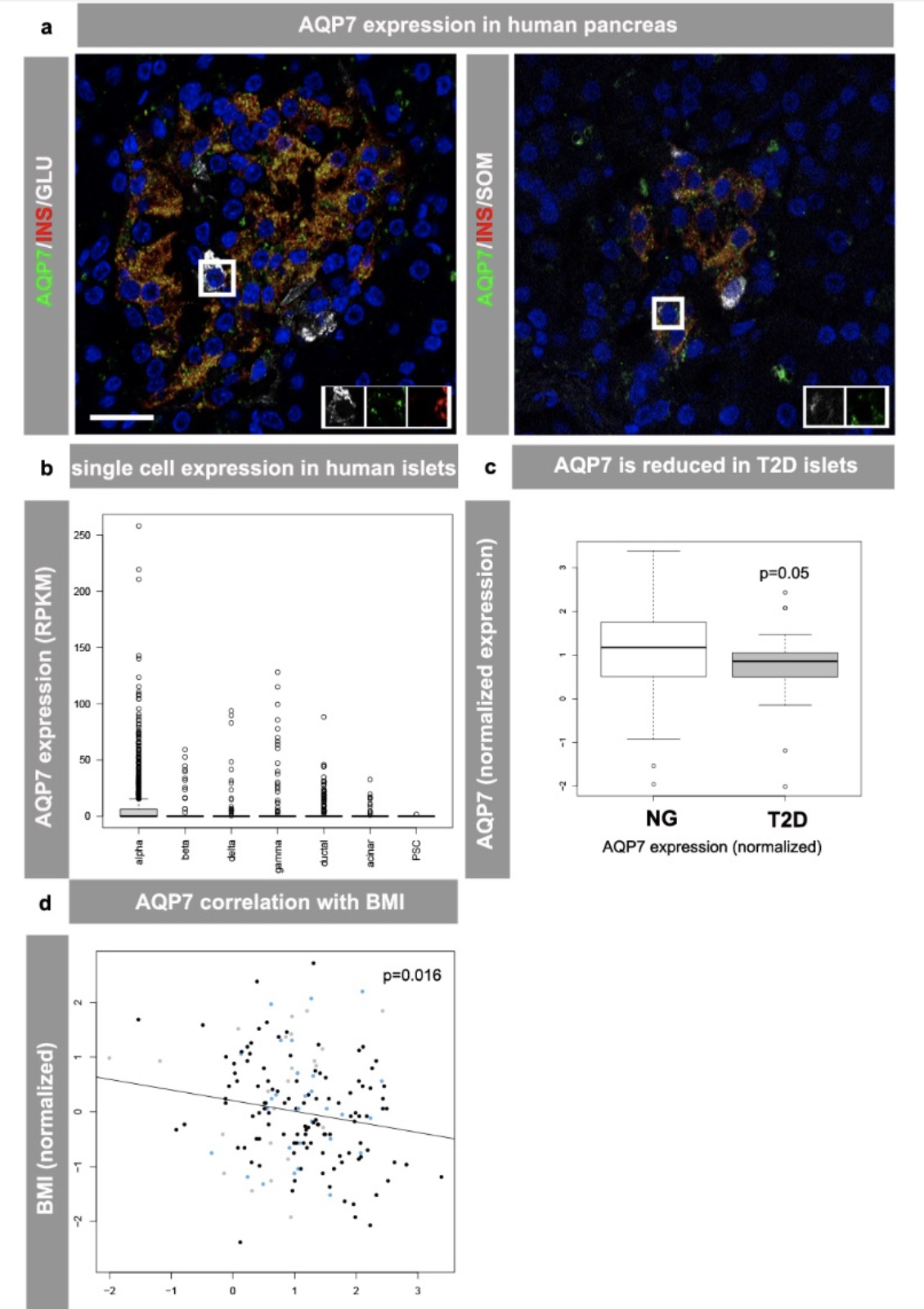
图 1 AQP7在人胰腺组织中的表达
(图源: Huang P, et al., Nature Communications, 2023)
鉴于AQP7的重要生理功能,为从结构水平指导功能分析,人源AQP7被异源表达于酵母细胞中并经过去垢剂的溶解和纯化以应用于单颗粒冷冻电镜结构解析。经过一系列数据分析和计算,研究人员获得了带有对称性的2.55 Å和不带对称性的3.0 Å的两个AQP7高分辨率结构。从整体上看,AQP7冷冻电镜三维结构图展现出对应两个四聚体的双层密度,并且两个四聚体在其中呈现背靠背的组装模式(图 2a-b)。有趣的是,这两个四聚体展现出一个相对于中心轴的45°的扭转分布,这致使一个稳定的八聚体的形成(图2c)。
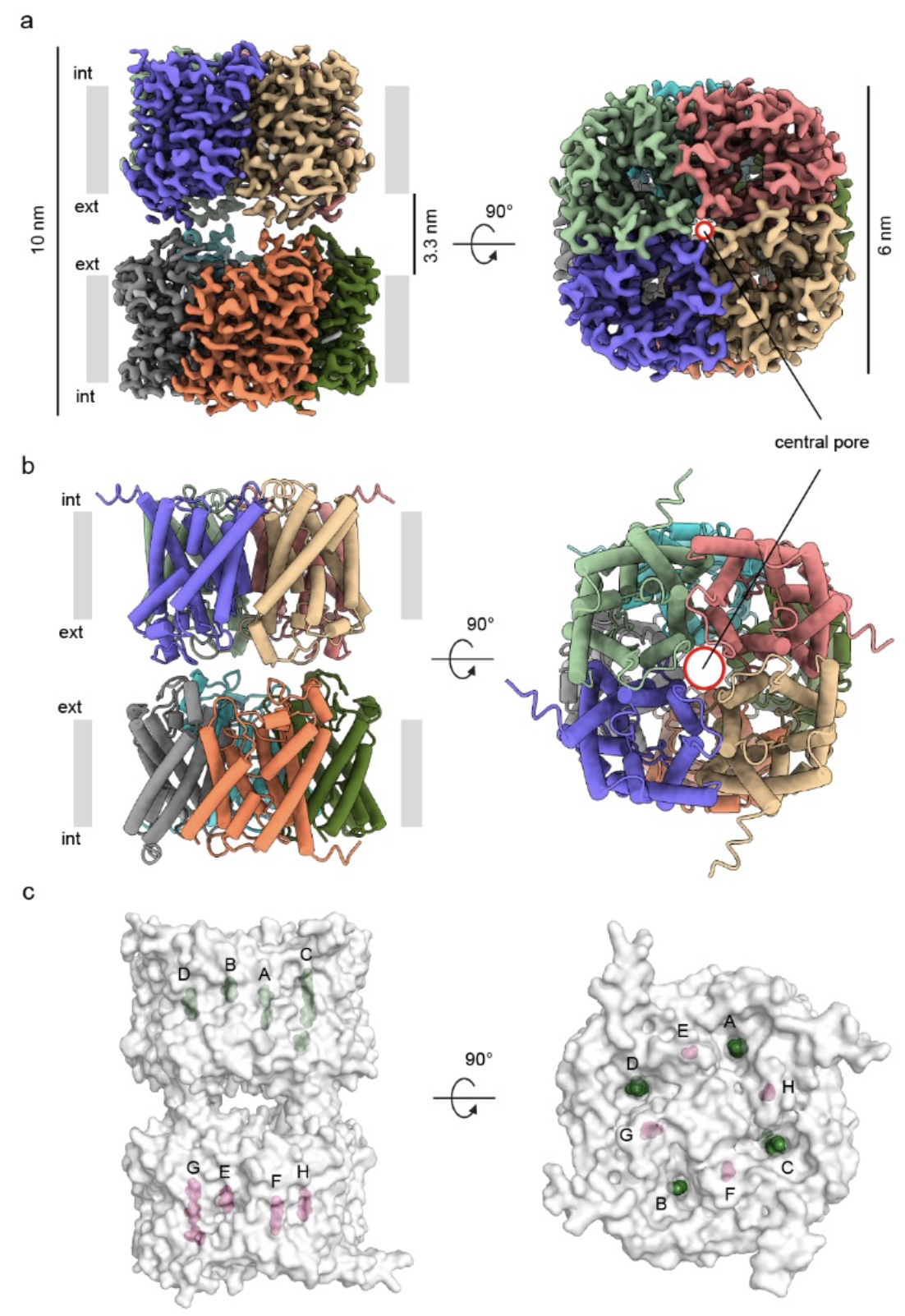
图 2 AQP7冷冻电镜结构采取两个黏附的四聚体配置
(图源: Huang P, et al., Nature Communications, 2023)
正如从三维结构图和模型中所观察到的,两个AQP7四聚体通过每个单体向上突起的胞外环相互关联 (图2a-b, 3a)。与严格意义上的水通道(不具甘油转运活性)相比,在AQP7第三和第四跨膜区之间有一个延长的胞外C环。在本文所展示的冷冻电镜结构中,每一个单体的C环向上突起并与相反方向另一单体的C环相互作用以促使八聚体的形成(图 3a),而在C环上贡献这一相互作用的是151位的脯氨酸 (P151)和152位的缬氨酸 (V152),此外145位的谷氨酰胺 (Q145)也通过氢键提升了八聚体的稳定性(图 3a)。值得注意的是,尽管所有的人源水甘油通道 (AQP3, AQP7, AQP9 和AQP10) 都拥有一个延长的胞外C环,然而P151,V152和Q145在水甘油通道蛋白家族中却不是保守的(图 3b)。为了进一步研究这些氨基酸对八聚体形成的重要性,研究人员分析了AQP3形成八聚体的倾向,因为AQP3在152位氨基酸位置拥有的是天冬酰胺而不是缬氨酸(图 3b)。最终冷冻电镜二维分类结果表明,在同样的样品制备条件下,AQP3并不形成八聚体,这也反映出V152对于AQP7八聚体形成的重要性。
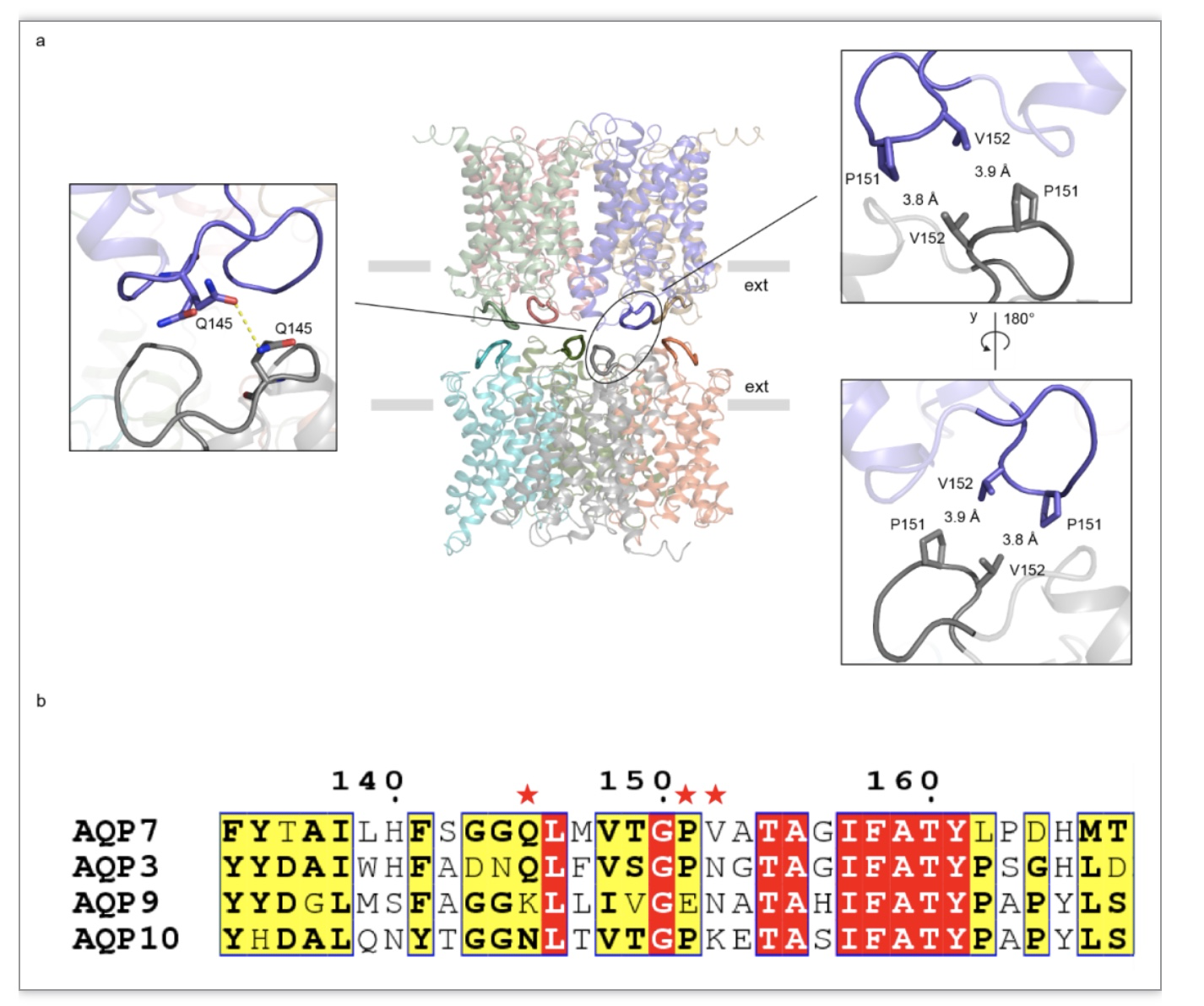
图 3 两个AQP7四聚体通过胞外C环相互黏附
(图源: Huang P, et al., Nature Communications, 2023)
每一个AQP7单体是一个独立的甘油通道,这也意味着在AQP7冷冻电镜结构中存在着八个甘油通道,并且研究人员也在每个单体中分别发现了甘油分子密度 (图 4)。尽管这些甘油分子密度在每个单体中存在的位置和数量并不相同,但是在天冬酰胺-脯氨酸-丙氨酸模型 (NPA motif,在AQP家族中保守存在)附近研究人员总能发现甘油分子的存在,这也表明了甘油分子与NPA motif的紧密结合 (图 4)。此外研究人员也对八个AQP7单体以及其晶体结构的通道半径进行了计算,结果显示出甘油通道的动态性能 (图 4)。
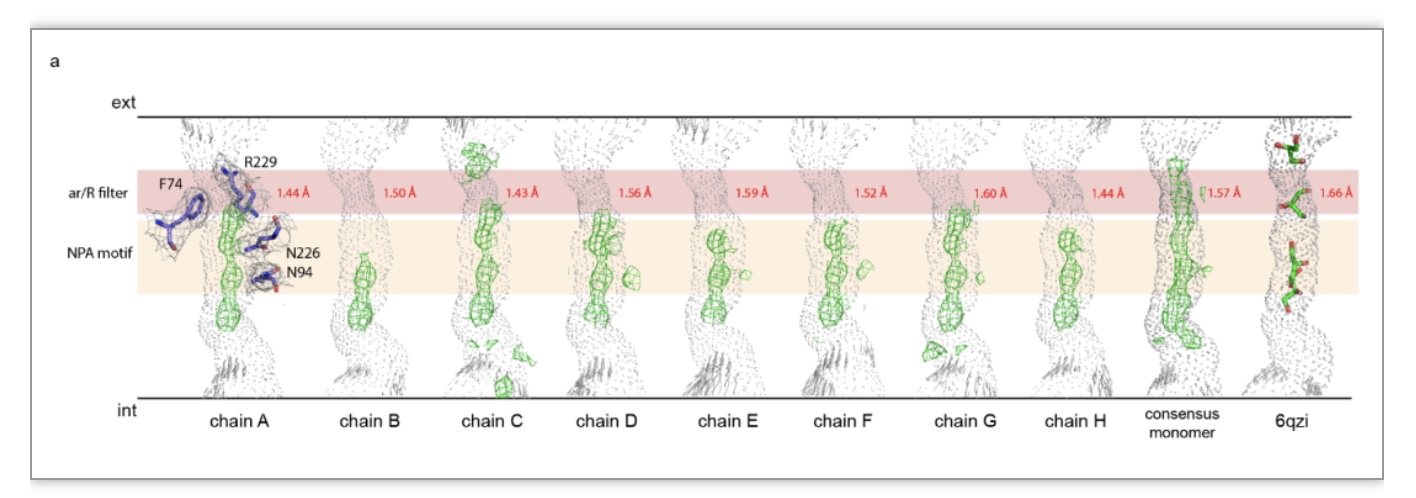
图 4 AQP7冷冻电镜结构中八个独立的甘油通道以及通道内甘油电子密度
(图源: Huang P, et al., Nature Communications, 2023)
水或者水甘油通道的渗透性和选择性已经被很多科学家研究并阐明,然而关于其中心孔道是否具有生理功能却是未知的。AQP中心孔道是由第二和第五跨膜螺旋中的非极性氨基酸所形成,经计算显示两个四等份的亮氨酸残基 (L68 和L204) 分别在中心孔道的胞外和胞内位置对其进行限制,这样形成了两个高度大约为18 Å的空腔 (图 5a-b)。有趣的是,研究人员在两个四聚体的中心孔道中清晰地观察到非蛋白性质的密度特征 (图 5a)。为进一步阐明这些电子密度的本质,科研人员对AQP7八聚体进行了表面电性分析,结果显示出一个整体正电性的环境(图 5c)。接下来他们又对AQP7样品进行了气相色谱质谱分析,结果暗示了甘油以及多个18碳长链脂肪酸存在于蛋白样品中 (图 5d), 此外,代谢中间产物3-磷酸甘油和2-磷酸甘油也被从样品中检测出来,并且这两个分子与中心孔道中的电子密度大小相似而且也符合中心孔道的两性特征,然而只有3-磷酸甘油与中心孔道中的电子密度相匹配 (图 6a)。
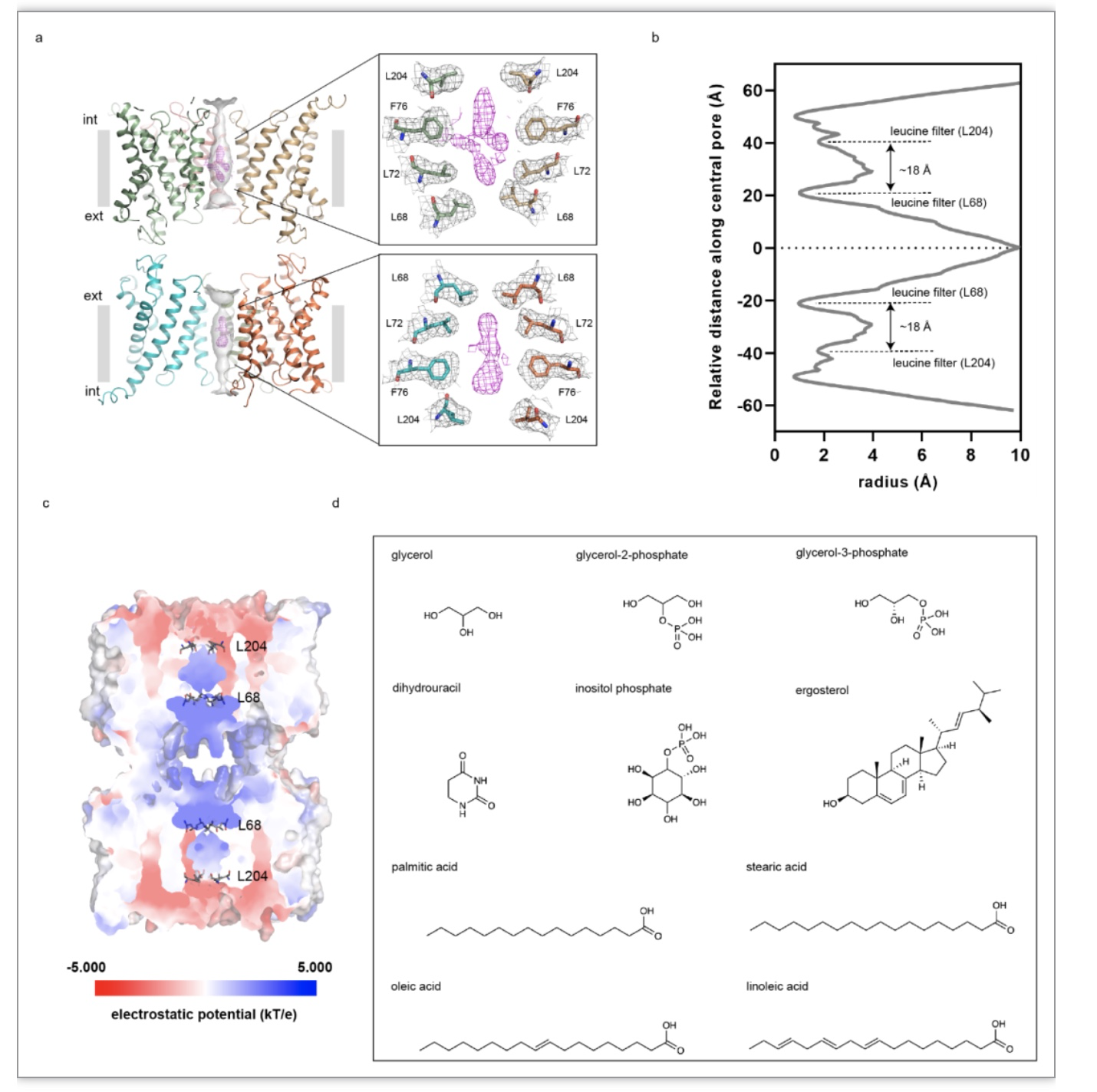
图 5 AQP7中心孔道特征以及气相色谱质谱识别的存在于蛋白样品中的分子
(图源: Huang P, et al., Nature Communications, 2023)
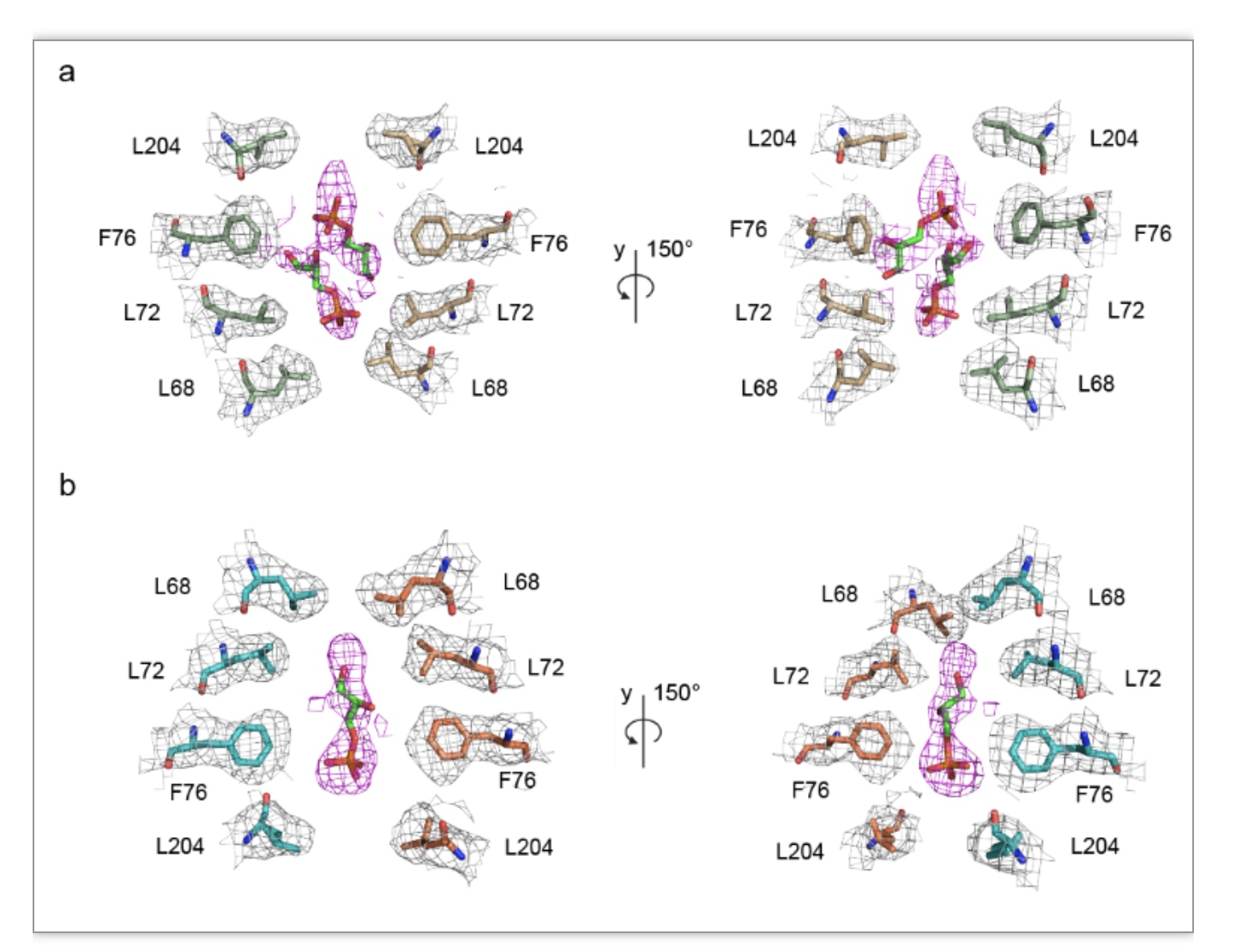
图 6 气相色谱质谱识别出的3-磷酸甘油分子与AQP7中心孔道内密度相互匹配
(图源: Huang P, et al., Nature Communications, 2023)

