近年来,CRISPR-Cas基因编辑技术的出现,对经济社会发展产生了重大影响。生命科学的研究已经从“基因组时代”向“基因组编辑时代”迈进。碱基编辑技术是基于CRISPR-Cas系统发展起来的新型靶基因修饰技术,目前依据碱基修饰酶的不同可分为胞嘧啶碱基编辑器 (Cytosine base editor,CBE) 和腺嘌呤碱基编辑器 (Adenine base editor, ABE)。碱基编辑技术因其高效、不依赖DNA双链断裂产生、无需供体DNA参与等优势,已经成功应用于各种动物、植物及其他生物中,为基因治疗及精准动植物育种等领域提供了重要技术支撑。四种腺嘌呤碱基编辑器:ABE7.10, ABE 6.3, ABE 7.8和ABE 7.9 [1]。2020年合作[2]通过噬菌体辅助持续进化技术开发了新型腺嘌呤碱基编辑器,ABE8e[3]。但这些编辑器仍然存在比较窗口较宽、脱靶率较高,无法实现精确编辑的问题该研究发现在TadA8e脱氨酶中引入一个关键位点的氨基酸突变 (F148A),构建的新型碱基编辑器SpRY-ABE8eF148A在HEK293T, Hela等细胞中展现出极高的编辑效率,无PAM的限制,扩大了基因组的编辑范围,缩小了编辑窗口以及降低了脱靶编辑效率。SpRY-ABE8eF148A是一款兼具高效率与低脱靶率的碱基编辑工具,有望提高未来临床应用的安全性。

本研究将脱氨酶TadA8e的48位的Phe突变为Ala氨基酸,构建了基于nSpRY-Cas9的新型碱基编辑器,SpRY-ABE8eF148A。通过构建具有NAN, NCN, NGN, and NTN PAMs的内源编辑的sgRNA表达载体,在HEK293T与Hela细胞中,验证新碱基编辑器的编辑性能。实验结果显示,SpRY-ABE8eF148A几乎可以靶向几乎所有PAM,在绝大多数位点中都展现出较高的编辑效率。相较于前期报道的SpRY-ABE8e编辑器,SpRY-ABE8eF148A编辑效率更高且具有更窄的编辑窗口,提高了编辑的精确性,是一款更加精确的DNA单碱基编辑工具 (图1)。
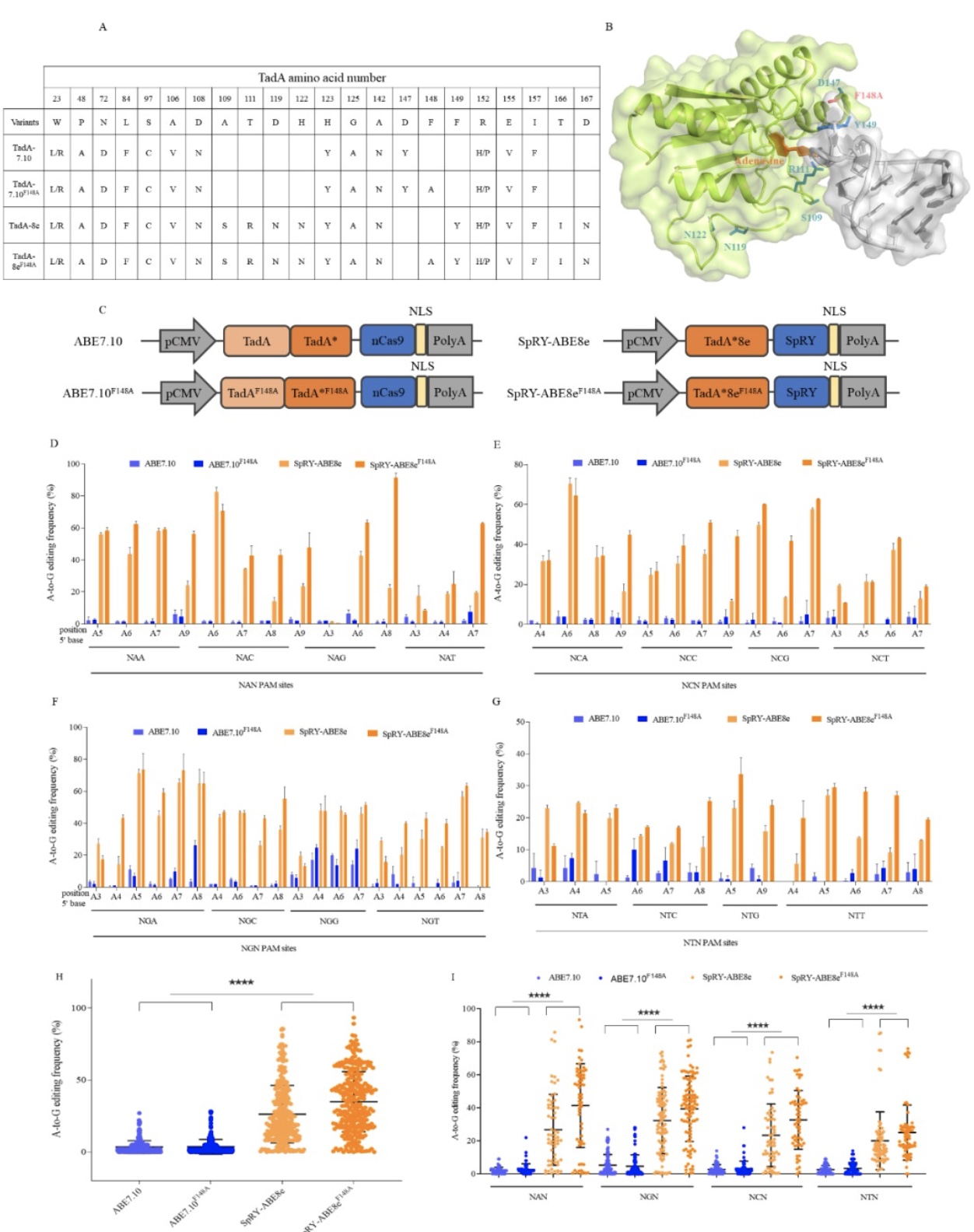
图1 SpRY-ABE8eF148A在人类细胞中的单碱基编辑效率结果图
(图源:Li G, et al., Mol Ther Nucleic Acids, 2022)
同时,高通量RNA-Seq的数据分析结果显示,相较于SpRY-ABE8e编辑器,SpRY-ABE8eF148A显著降低了A > G脱靶编辑效率,减少了脱靶效应。SpRY-ABE8eF148A在单碱基致病位点修复的应用研究中也展现出了其优势,本研究成功将SpRY-ABE8eF148A应用于APOC3(D65N), SCN9A(R896Q) 与SLC30A8 (M50I) 等疾病细胞模型的精确修复。
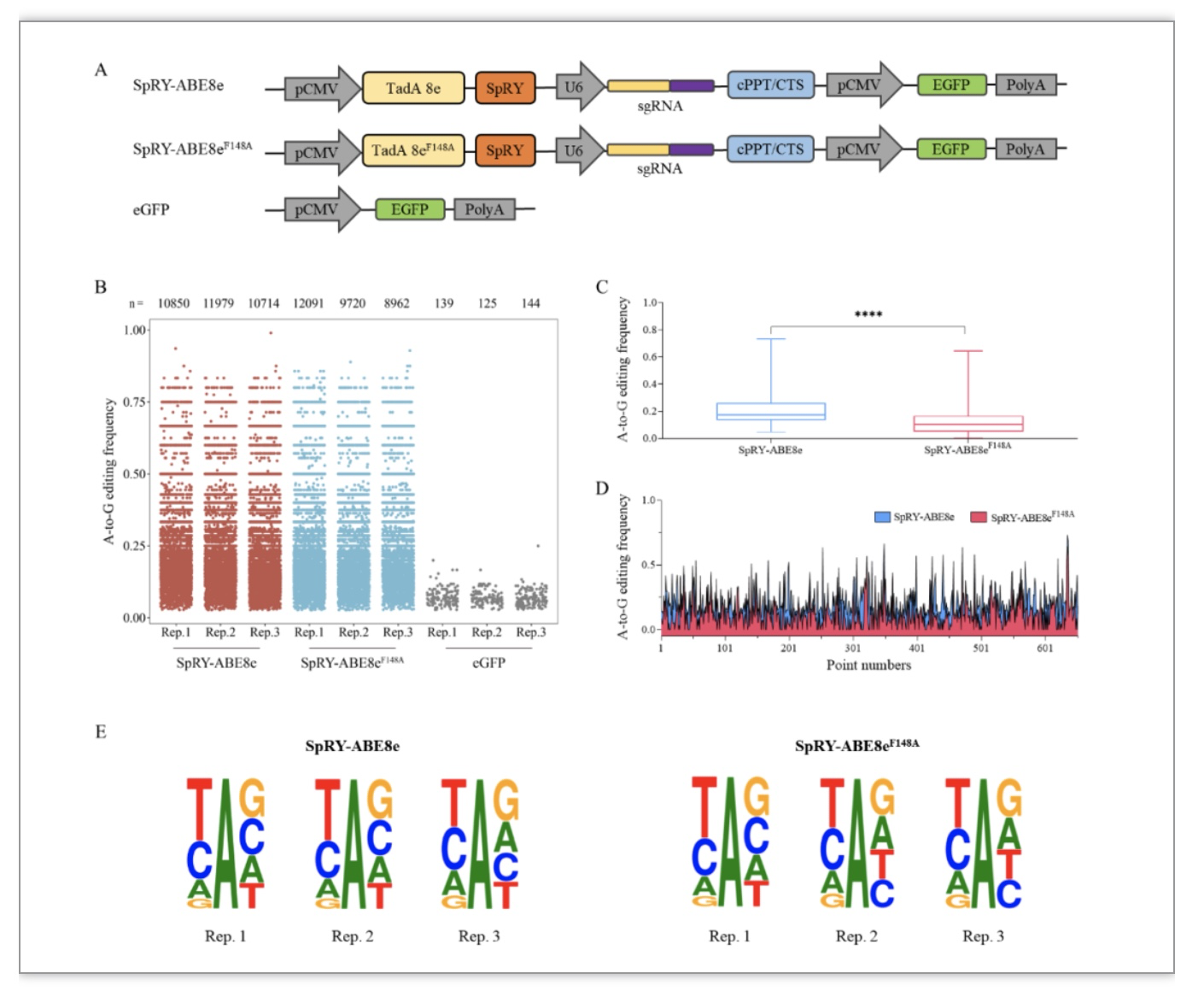
图2 SpRY-ABE8eF148A的脱靶分析结果图
(图源:Li G, et al., Mol Ther Nucleic Acids, 2022)
本研究对ABE碱基编辑器中的脱氨酶TadA8e进行了工程化处理,通过引入关键氨基酸位点的突变,构建了一款兼具高效性与高精确性的碱基编辑器,SpRY-ABE8eF148A。SpRY-ABE8eF148A在人源细胞中可实现G•C-to-A•T型致病位点的精确修复,且可靶向基因组的任何范围。但目前该编辑器仍存在脱靶效应未完全去除,个别位点的编辑效率偏低等局限,未来的方向仍然是通过PACE (Phage-assisted continuous evolution) 或计算机辅助蛋白进化(Artificial Intelligence- driven, AI-driven) 等方式,对碱基编辑器中的核心蛋白进行功能的定向进化,改善旁系编辑、编辑的普适性等问题。

