肝纤维化通常被认为与持续慢性肝损伤息息相关,在多种危险因素的刺激下,如肝炎感染、血吸虫病、酒精、某些药物、毒物以及糖尿病和肥胖等,可以诱导静止期肝星状细胞(HSCs)活化为肌成纤维细胞, 而肌成纤维细胞会生成细胞外基质(ECM),从而促进纤维蛋白沉积和瘢痕形成。肝损伤导致的纤维化发生涉及一个复杂的相互作用组,包括对慢性炎症、组织再生、ECM重塑和纤维化发生做出反应的各种类型的免疫细胞的相互作用,如Th17,Th9, Th22, 调节性T细胞(Treg),固有淋巴样细胞(ILCs),黏膜相关恒定T细胞(MAIT)和γδT细胞,以及它们的相关细胞因子。在肝纤维化过程中,Treg也发挥着重要作用。Treg被人所熟知的是在适应性免疫应答发挥免疫抑制作用,促进免疫自身耐受和内环境稳定,而研究者发现在不同因子介导下,Treg在肝纤维化过程可以发挥出截然相反的作用。此外,Treg/TH17比值在肝内免疫调节过程也中起关键作用。作者首先介绍了肝纤维化和Treg细胞的相关概念和研究背景。随后综述了Treg细胞促进肝纤维化的通路,以及抑制肝纤维化的通路,最后总结了Treg和Th17之间的平衡对于肝纤维化的影响,总的来说,Tregs在不同的免疫微环境和分子途径的条件下发生的效应是复杂的,如果要将其运用到治疗肝纤维化,就需要对其进行更加深入的研究。

Treg细胞最早由GERSHON等人于20世纪70年代发现,因其在免疫调节中的作用被称为“抑制细胞”。1995年的一项研究表明,CD25的表达是这些抑制性细胞的标志,而这些抑制性细胞也首次被标记为Tregs。这项研究还证明了在裸鼠模型,引入CD4+CD25+ Treg缺陷T细胞可以诱发自身免疫性疾病。相反,当引入CD4+ CD25+Treg细胞时,自身免疫效应被抑制[1]。目前流行的观点是由细胞来源决定,将Tregs分成两种亚型,即由骨髓来源的祖细胞在胸腺中分化而来的天然Tregs(nTregs) 和由外周幼稚T细胞(naïve T细胞)分化而来的可诱导Tregs(iTregs)。除了nTreg和iTregs,各种研究发现了其他具有调节特性的T细胞,包括辅助性T细胞(Th)样Treg、CD8+Treg、Tr1细胞和Th3细胞。此外,许多研究者根据Treg细胞表面分子表达的不同,将Treg细胞细分为不同疾病中的不同亚群。叉头框转录因子蛋白3 (FoxP3)是Treg细胞最特征性的标志物,在Treg发育和免疫调节中发挥重要作用。Tregs主要分泌IL-10、TGF-β、IL-35等细胞因子,通过抑制NKT细胞、巨噬细胞、B细胞等的分化和增殖,使机体获得免疫耐受[2]。虽然Treg细胞仅占外周血CD4+ T淋巴细胞总数的5% ~ 10%,但其对维持免疫耐受和内环境稳定的作用不容忽视。
接种猴免疫缺陷病毒(SIV)后7天,可以在感染的恒河猴的淋巴组织中观察到I型胶原沉积和TGF-β1+Treg细胞平行增加[6]。这些结果表明,Treg细胞对免疫激活具有两方面的反应;一方面可抑制病毒免疫应答,另一方面可诱导淋巴组织胶原沉积,导致器官纤维化。
分布于Disse间隙的肝星状细胞(HSCs)通常被认为是肝纤维化的标志细胞和肌成纤维细胞的主要来源,一方面,在炎症刺激的存在下,静息状态的HSCs常被激活并转化为肌成纤维细胞样细胞,产生大量ECM和细胞因子。另一方面,活化的HSC可以分泌MMPs来降解ECM[6],Tregs可以通过TGF-β途径激活HSCs转化成肌成纤维细胞从而促进纤维化。
值得注意的是,HBV作为导致肝纤维化的主要致病因素之一,可通过免疫抑制级联反应诱导Tregs、MDSCs和NK-REG细胞等免疫抑制细胞的产生,过度诱导可导致肝纤维化甚至HCC等不良结局[7],HBV诱导的Tregs可能通过IL-8、TGF-β1和CTLA-4信号通路的作用,直接抑制NK细胞的脱颗粒作用。Tregs还可以通过TGF-β1和IL-8抑制HSCs表面MICA/B的表达,从而间接保护HSCs免受NK细胞的攻击。通过切断Treg对NK细胞的作用途径,恢复抗病毒T细胞应答,可以限制炎症和损伤的发展,减少作为肝纤维化关键成分的HSCs,从而限制肝纤维化的发展。
在慢性HCV感染的患者中,也可以看到Treg的增殖,并且富集在肝纤维化区从而保护HSCs免收NK细胞的攻击[8]。有趣的是,在HCV肝组织中发现了大量具有IL-8+ CD4+Foxp3+的T细胞(主要在纤维化和α SMA区域),有研究表明,敲除IL-8可以抑制HSCs的活化,但不影响Treg细胞的免疫调节功能,表明IL-8+ Treg细胞可能会促进纤维化[9](图1)。
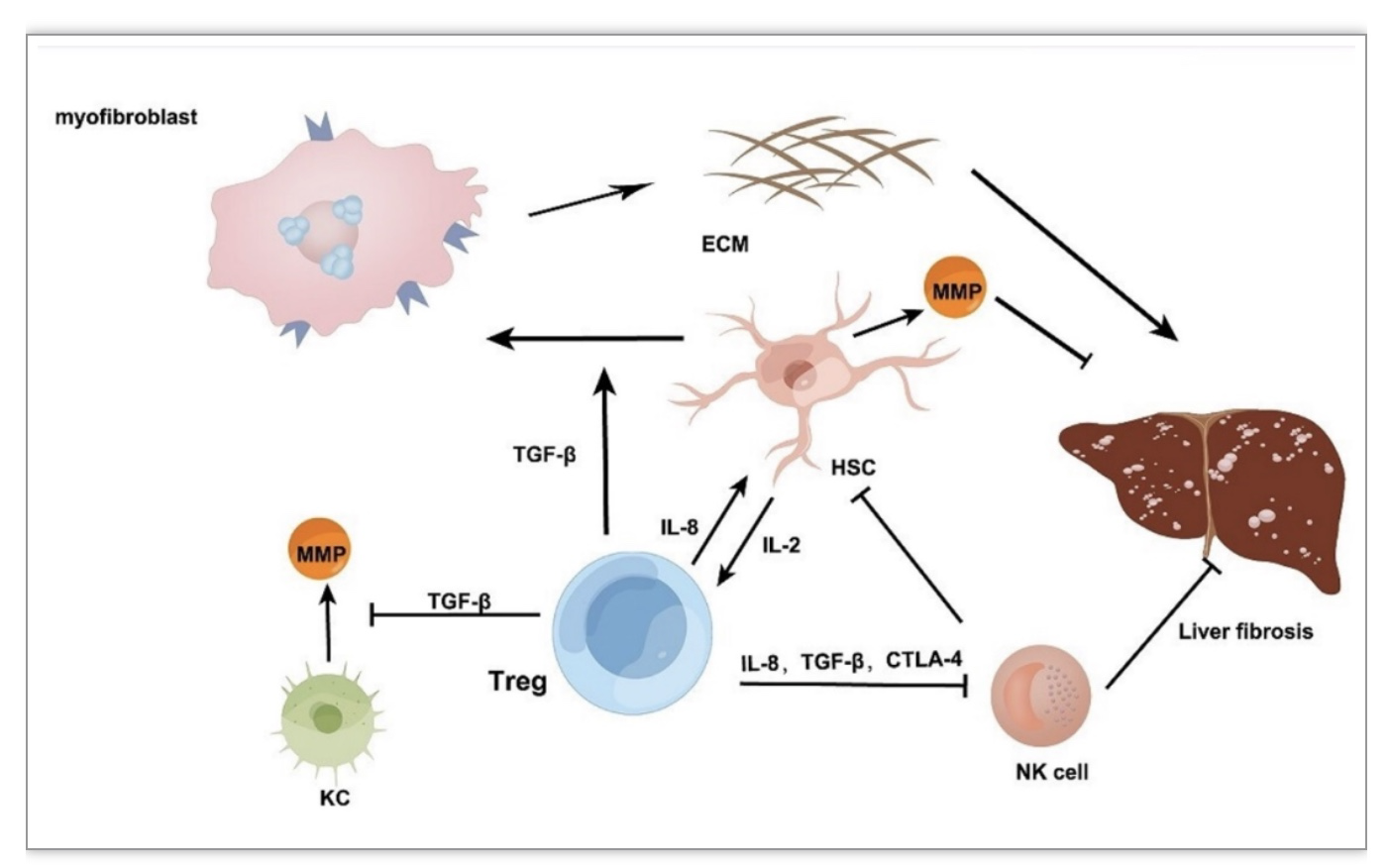
图1 Tregs促进肝纤维化的途径
(图源:K. Wu, et al, Cell death & disease,2023)
Treg细胞还可预防HIV -1诱导的肝纤维化,其机制可能与HSCs活化、肝损伤和肝炎有关[12],一项关于HIV -1诱导的肝纤维化的研究使用地尼白介素(denileukin diftitox)删除了Treg细胞,通过测定各种血浆指标,与对照组相比只有HIV-1+ denileukin diftitox小鼠在感染20天后ALT水平和血清透明质酸显著升高,因此,HIV-1感染和Tregs耗竭会导致肝脏炎症和最终纤维化。其中的机制可能与删除Treg可显著上调肝脏中人类炎症趋化因子MCP-1和MIP-1α的表达,MCP-1与Treg密切相关,可能在炎症启动的纤维化过程中发挥重要作用[13]。
炎症细胞免疫在保护机体免受生理因素影响的同时,也促进肝损伤和纤维化。而Tregs可抑制炎症细胞免疫,从而抑制纤维化。研究发现,四氯化碳(CCL4)注射诱导的慢性肝脏炎症倾向于优先扩增肝脏Treg细胞,还可以显著提高CD4+CD25+ Treg的功能活性,增强了Treg对HSCs活化的抑制能力,从而保护肝脏功能,避免纤维化[14, 15]。
分泌IFN-γ的Th1细胞和产生IL-4的Th2细胞分别是抗纤维化和促纤维化的辅助性t细胞亚群。减少Treg可增强炎症细胞的免疫功能,并驱动诱导Th2细胞分泌IL-4,从而打破Th1和Th2两个亚群之间的平衡,可见Treg起着维持平衡的作用。另外Th2细胞和Ly-6ChighCCR2high炎症单核/巨噬细胞均具有促纤维化功能,分别通过分泌IL -4和TGF-β发挥促纤维化功能,Treg分泌的IL-10可以对其进行调节,从而发挥抗纤维化的作用[16]。
在胆管结扎(BDL)诱导的急性疾病模型中,肝脏中的Tregs降低了其他效应T淋巴细胞功能,从而有效地限制了肝纤维化,据观察发现,在BDL模型中,Tregs的耗竭增加了炎症介质,如趋化因子和细胞因子的生成,并促进了Th17和CD8+ T细胞在纤维化肝脏中的浸润,运用低剂量IL-2可以诱导肝内Treg的扩增,从而减轻胆道损伤和纤维化[17]。
人羊膜间充质基质细胞(hAMSC)可以调节多种疾病中的免疫反应,并表现出与干细胞相似的强大再生修复能力。与单独注射Treg或hAMSC相比,联合输注Treg和hAMSC可改善低级别肝纤维化。其原因可能是Tregs可以提高肝细胞生长因子(HGF)的表达和hAMSC的分化能力,Tregs可调节TGF-β-IDO信号通路进而增强hAMSC的功能[18]。在慢性肝损伤模型中,间充质干细胞(MSCs)和MSC条件培养基(MSC-CM)均能抑制坏死性炎症和纤维化的发生,MSC-CM的效果更好,它能诱导Treg和Th2细胞的活化,以及减少Th17细胞的数量。(图2)
Treg还可以缓解肝脏脂肪变性的病理过程和高水平异常的血液胆固醇和葡萄糖代谢,以及肝酶水平的异常[19],表明出Treg具有潜在的治疗糖尿病和预防早期肝纤维化的作用。
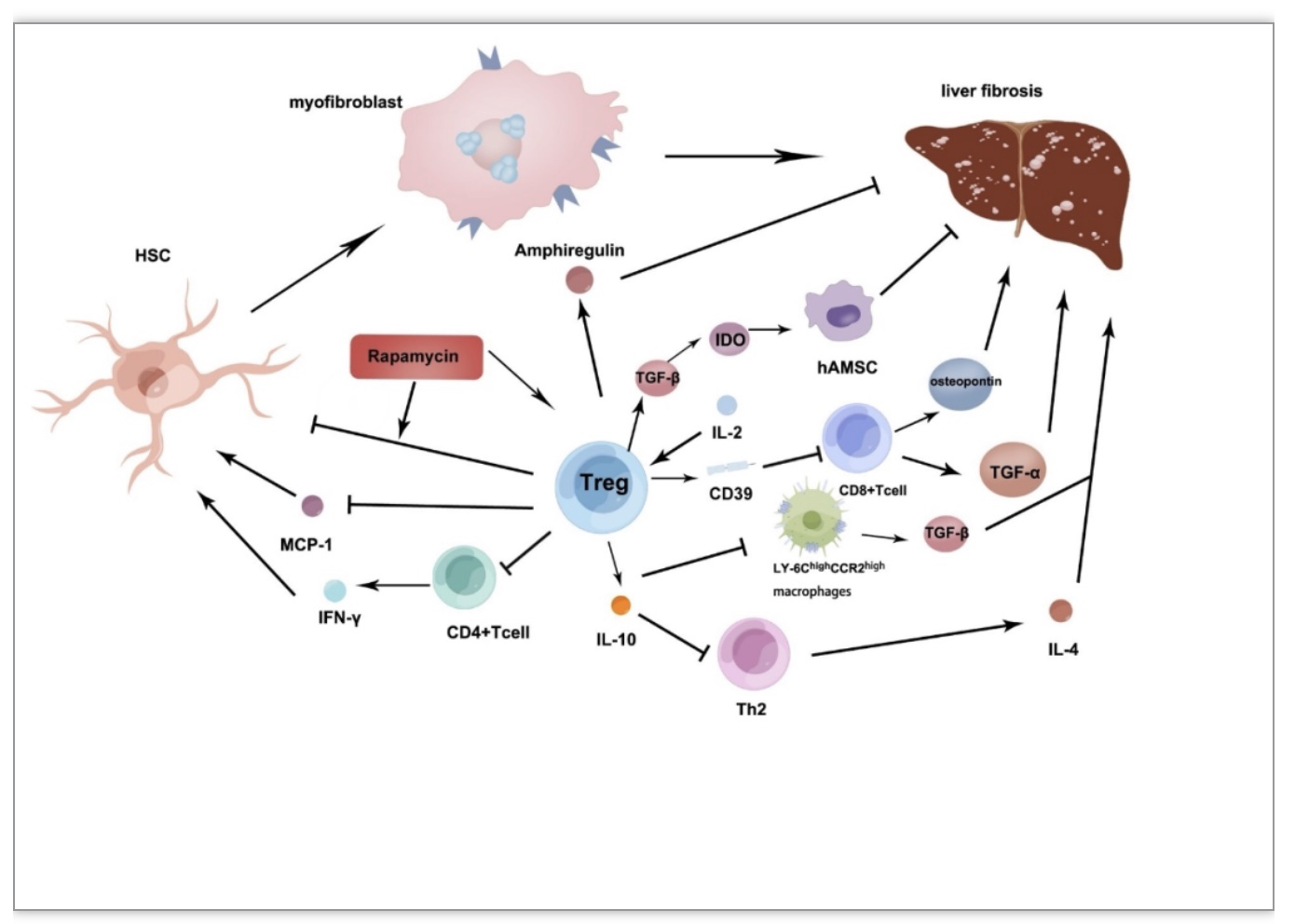
图2 Tregs抑制肝纤维化的途径
(图源:K. Wu, et al, Cell death & disease,2023)
部分病毒可持续损伤肝组织,最终导致肝硬化,Treg/Th17平衡可防止病毒感染时肝脏的过度损伤。研究者发现,在急性HAV患者中,血清IL-17水平与肝损伤程度呈正相关,而肝脏常驻和循环Tregs频率与肝损伤呈负相关[21]。同样,其他研究人员已经证明,在急慢性肝损伤中,肝脏和外周血中Th17细胞的数量和比例均增加。所以一些学者认为Treg/Th17是失代偿性肝硬化的独立预测因素[22]。
lL-35对急、慢性HBV感染中Treg和Th17的平衡有重要影响。研究发现,它可以放大病毒特异性Treg细胞的功能,同时抑制Th17细胞分化[23]。正是IL-35的这种作用导致平衡的打破,造成机体过度的免疫抑制,造成HBV持续感染和慢性疾病,最终导致不可逆的肝纤维化。另外雷帕霉素可以显著降低CCL4诱导的肝纤维化模型中Th17细胞水平和ROR-γT的表达水平,同时可以使Treg频率和Foxp3表达显著增加,甚至可以增强Treg对HSCs的抑制功能。
不仅在肝纤维化中,Treg/Th17平衡也在一些炎症性和自身免疫性疾病中存在,包括系统性红斑狼疮(SLE),类风湿关节炎和原发性胆汁性肝硬化[24-26]。
最近越来越多的数据表明,Treg和Th17细胞在不同的免疫微环境中可发生转化。例如,Treg细胞在IL-6和IL-21的存在下可以转化为表达IL-17的细胞,而Th17细胞在IL-4或IL-12的存在下可以转化为Th1/2细胞[27]。IL-6对于Treg/Th17的平衡具有显著影响,一方面它可以在TGF-β存在的情况下诱导naïve T细胞向Th17细胞发展,另一方面它对于Treg的作用可以分成直接作用和间接作用,直接作用体现在IL-6可以不影响nTregs数量和功能的情况下,抑制了TGF-β诱导的Treg细胞转化,间接作用体现在IL-6能够激活STAT3信号通路,最终使DCs处于低CD80和MHC-II水平的不成熟状态,从而增加IL-10的产量以促进Tregs的生成[28]。总的来看,在Treg/Th17平衡中,IL-6还是偏向于促进Th17的生成。(图3)
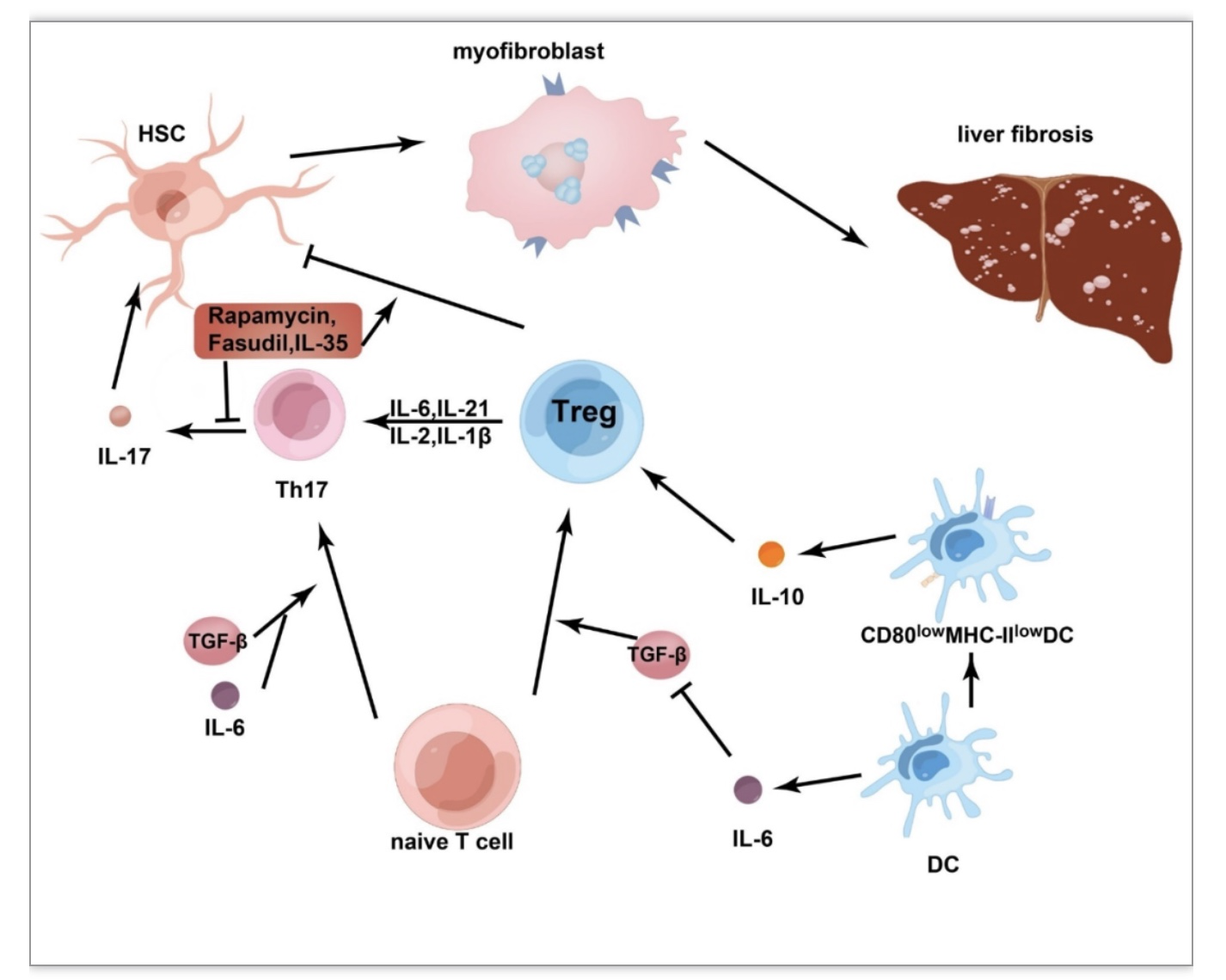
图3 Treg和Th17在肝纤维化中的关系
(图源:K. Wu, et al, Cell death & disease,2023)
前文所述,肝纤维化主要分为两个方面,一是肝细胞或胆管细胞的损伤,二是ECM生成的紊乱。如何处理好这两方面的问题,是治疗肝纤维化的关键所在。Treg在肝纤维化中的作用机制尚未完全阐明,但可以确定的是Treg是表达致病性还是保护功能往往取决于所处的环境条件。由于Treg在不同环境中的二重性,这一领域的研究已成为近年来的热点。由于Treg的二分性,或许通过免疫细胞靶向治疗肝纤维化可以为患者开辟一条新的途径。此外,Treg/Th17的相互作用可能有助于我们分析疾病状态,判断患者的预后,促进诊断和治疗方案的形成。未来的研究需要着重于肝脏组织中Treg和Th17细胞的机制和平衡,以及研究在肝脏特异性治疗中可能影响Th17/ Treg细胞作用的不同信号通路。

