巨噬细胞的两种类型:胚胎来源的组织驻留巨噬细胞(RTM)和循环单核细胞来源的巨噬细胞(mo-mac),而且两者功能有很大差异。

I. 巨噬细胞的来源和功能多样性
提出问题:巨噬细胞存在于多种不同组织/器官中,其来源和功能是否存在差异(异质性)?
相关实验:通过追踪巨噬细胞的来源和标记特定蛋白质,研究巨噬细胞的动态分布和功能。
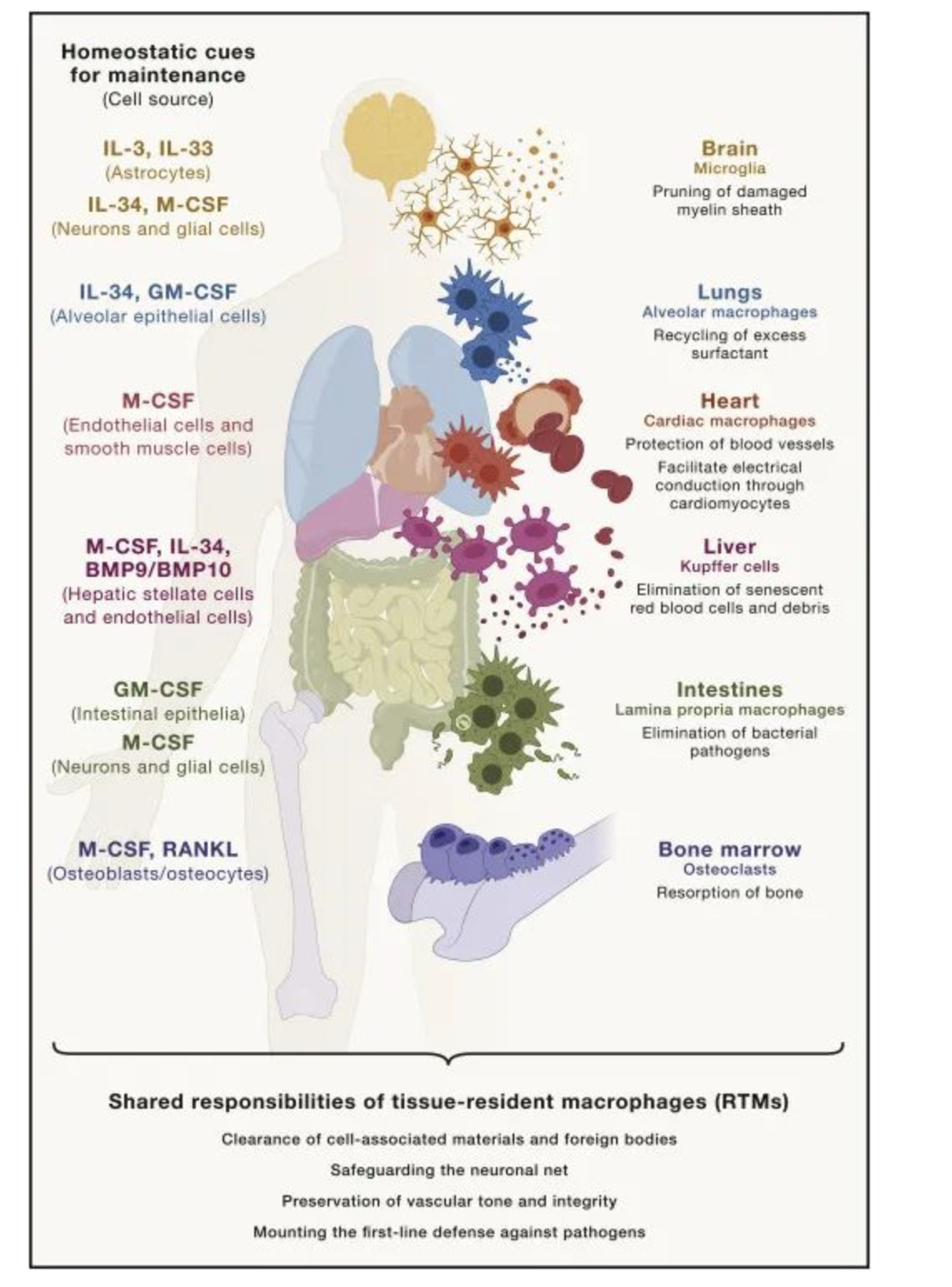
结果:发现胚胎来源的组织驻留巨噬细胞(RTM)和循环单核细胞来源的巨噬细胞(mo-mac)存在差异。RTM通过清除损伤细胞和外来物质,预防不必要的炎症反应。不同部位的RTM具有不同的功能,如腹膜浆膜层RTM伪足包裹促炎碎片,肺泡巨噬细胞清理嗜酸性物质等。RTM具有长寿命且在不同器官中发挥不同的功能,而mo-mac则源自循环单核细胞和炎症状态下增生的巨噬细胞。
讨论:巨噬细胞的来源和功能多样,这种差异性可能与其所处环境和功能需求密切相关。RTM在维持组织稳态和清除损伤物质方面起重要作用,而mo-mac则主要参与炎症和免疫反应。深入理解这些巨噬细胞亚群的功能有助于我们更好地了解其在健康和疾病中的作用。
II. 巨噬细胞调控因子的影响
提出问题:巨噬细胞的功能是否受到细胞因子的调节?
相关实验:科学家用GM-CSF和PU.1等特定细胞因子刺激巨噬细胞,观察其功能和表型的变化。
结果:研究发现,细胞因子GM-CSF和PU.1等可显著影响巨噬细胞的分化、增殖和活性。肺泡巨噬细胞的功能依赖于GM-CSF和PU.1等细胞因子,GM-CSF能够挽救肺泡巨噬细胞,预防肺泡蛋白沉积症的发生。GM-CSF促进巨噬细胞分化和增殖,使其具有更强的抗菌能力;PU.1则参与调节巨噬细胞的转录程序,影响其功能。
讨论:细胞因子对巨噬细胞的调节起到重要作用,这些调控能够改变巨噬细胞的功能和表型,从而适应不同的生理和病理环境。进一步研究巨噬细胞调控因子的机制有助于我们更好地理解巨噬细胞的功能和其在疾病中的作用。
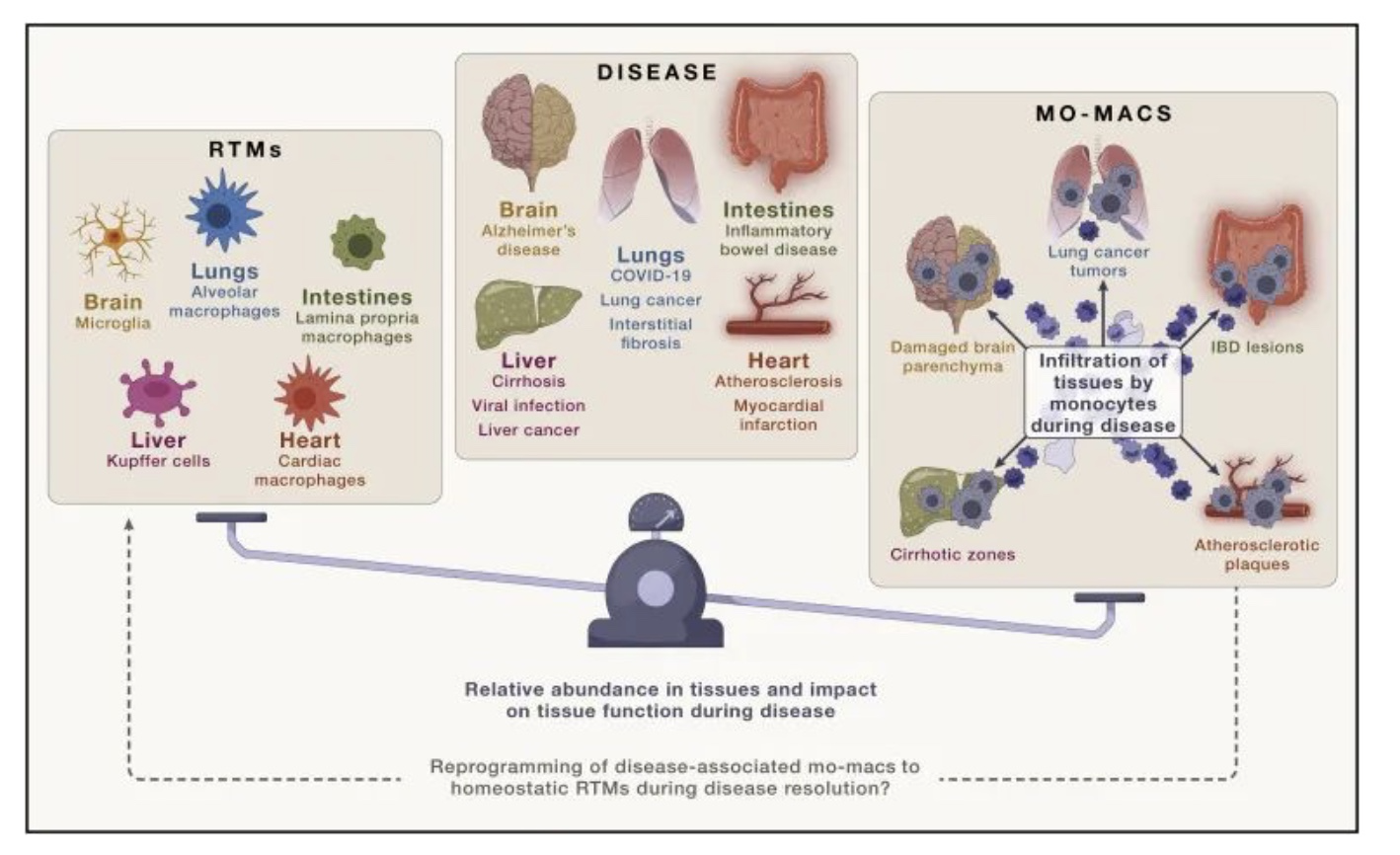
个体发育不同的 RTM 在体内平衡和疾病相关疾病期间的动态:
在稳定状态下,组织内的巨噬细胞主要有两种类型,即胚胎来源的巨噬细胞(Embryonic-derived RTM)和单核细胞来源的巨噬细胞(Monocyte-derived RTM)。具体是哪一种类型的巨噬细胞存在于组织中,取决于具体的组织类型。
尽管这两种巨噬细胞在表型上很难区分彼此,但在稳定状态下它们共同存在并参与组织的功能维持。然而,在疾病过程中,损伤相关信号和特定于疾病的信号会导致血液中的单核细胞被招募到受损组织,并发生炎症分化成为与该疾病相关的单核细胞来源的巨噬细胞,即疾病相关巨噬细胞(mo-macs)。
研究表明,在疾病过程中,这些疾病相关的巨噬细胞在疾病和组织功能方面具有更显著的贡献。它们参与免疫反应、组织修复以及疾病的进展和发展。然而,在疾病解决阶段,当组织开始向稳态转变时,这些巨噬细胞是否会简单地死亡或恢复到真正的RTM表型,以响应恢复稳态组织信号,目前还不完全清楚。
因此,对于疾病相关巨噬细胞在疾病解决阶段的行为和恢复到真正的RTM表型的能力,还需要进一步的研究来解答。这方面的研究对于我们更好地了解疾病的发展过程以及组织的恢复至关重要。
III.巨噬细胞在健康和疾病中的作用
提出问题:巨噬细胞在健康和疾病中的作用有哪些?
相关实验:通过动物模型和疾病样本分析,研究巨噬细胞在不同生理和病理状态下的功能。
结果:巨噬细胞在健康状态下维持组织稳态,清除损伤物质和外来病原体。然而,在炎症和某些疾病中,巨噬细胞可能发挥负面作用,导致炎症反应加剧和组织损伤。
讨论:巨噬细胞作为机体固有免疫的重要组成部分,对于保持组织稳定和抵御病原体入侵起着关键作用。然而,在某些情况下,过度活化或异常调节的巨噬细胞可能导致炎症性疾病的发生和发展。更深入地研究巨噬细胞的功能和调控机制对于预防和治疗相关疾病具有重要意义。

