铜是多种酶的辅助因子,在很多生物学过程中(包括氧化磷酸化、活性氧代谢、铁稳态、结缔组织交联和信号传递等)发挥重要作用。铜缺乏与遗传、神经、心血管和代谢性疾病相关。然而,过量的铜又会导致细胞毒性。Todd Golub团队发现,在主要利用氧化磷酸化反应获能的细胞中,Elesclomol和Disulfiram等几种铜离子载体可促进铜依赖的调节性细胞死亡(regulated cell death,RCD),即铜死亡(cuproptosis)[1,2]。此后,铜死亡作为一种新型的细胞死亡方式,受到科学界的高度关注。该论文系统总结了铜死亡的发生机制,讨论了p53在能量代谢、Fe-S簇蛋白以及谷胱甘肽(GSH)合成中的作用,并提出p53调节铜死亡的几种潜在机制。

在倾向于利用氧化磷酸化作为主要获能方式的细胞中,过量铜离子直接与三羧酸循环中的硫辛酰化蛋白结合,导致这些蛋白发生凝集、Fe-S簇蛋白降解,以及随后的蛋白毒性应激(proteotoxic stress)和细胞死亡。肿瘤抑制蛋白p53是一种重要的代谢调节因子。近年来,越来越多的证据表明p53在重塑肿瘤代谢中起关键作用,包括对糖酵解和氧化磷酸化的调节[3]。由于这两个紧密耦合的代谢过程与细胞对铜死亡的敏感性密切相关,因此,p53可能对铜死亡具有重要调节作用。
即使在氧充足条件下,癌细胞仍偏好糖酵解而非氧化磷酸化产生中间代谢产物和能量,从而实现对铜死亡的抵抗。p53通过多种机制抑制糖酵解,并驱动代谢流转向三羧酸循环和氧化磷酸化,这可能增强癌细胞对铜死亡的敏感性。p53活性维持着线粒体结构和功能的完整性,而p53突变或缺失导致线粒体含量、细胞色素c氧化酶活性和呼吸代谢显著降低,因此,p53还可通过增强线粒体代谢促进铜死亡。Fe-S簇是一类普遍存在的蛋白质,作为辅因子广泛参与酶催化、电子传递和代谢应激等生物学过程[4]。铜死亡的发生伴随着Fe-S簇蛋白的降解,尽管尚不清楚Fe-S簇降解是铜死亡的诱因还是结果。鉴于p53参与Fe-S簇的生物合成,这可能是p53调控铜死亡的另一机制。此外,GSH不仅是抗氧化剂,还是重要的内源性铜离子螯合剂[5]。有趣的是,p53通过对不同靶基因的调控增加或减少胞内GSH的合成,这提示在不同应激条件下p53可能具有促进或抑制铜死亡的功能(图1)。
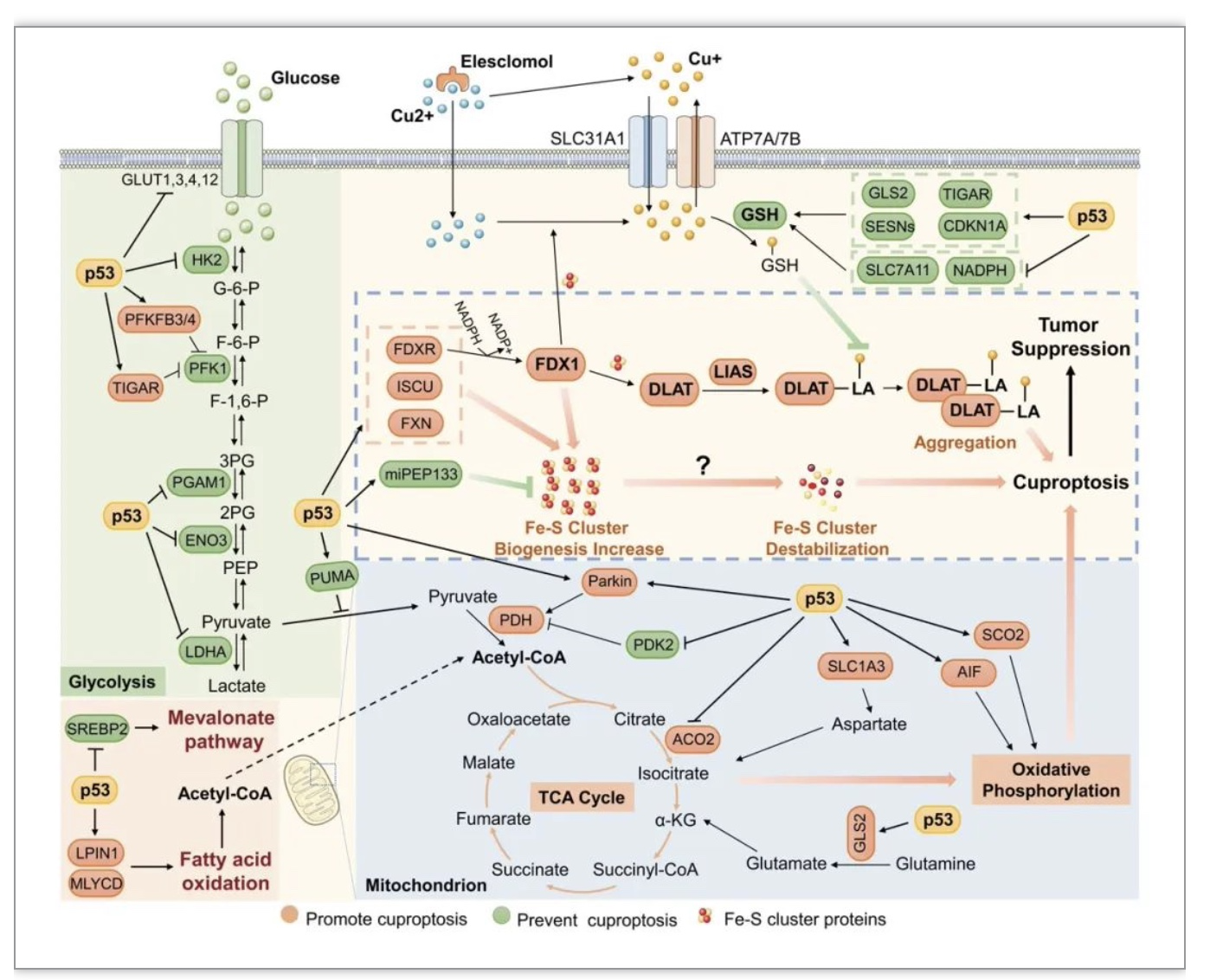
图1 p53对铜死亡的调节
(图源:Xiong C, et al ., Cell Death Differ. 2023)
TP53是人类癌症中最常见的突变基因。癌症相关的p53突变多为错义突变,常发生于DNA结合域。一些p53突变体具有“获得性功能”(gain-of-function)以促进肿瘤的发生和发展[6]。大量研究表明突变型p53通过多种机制增强糖酵解、抑制氧化磷酸化以及调节脂质代谢。因此,突变型p53可能通过这些方式增强癌细胞对铜死亡抵抗(图2)。
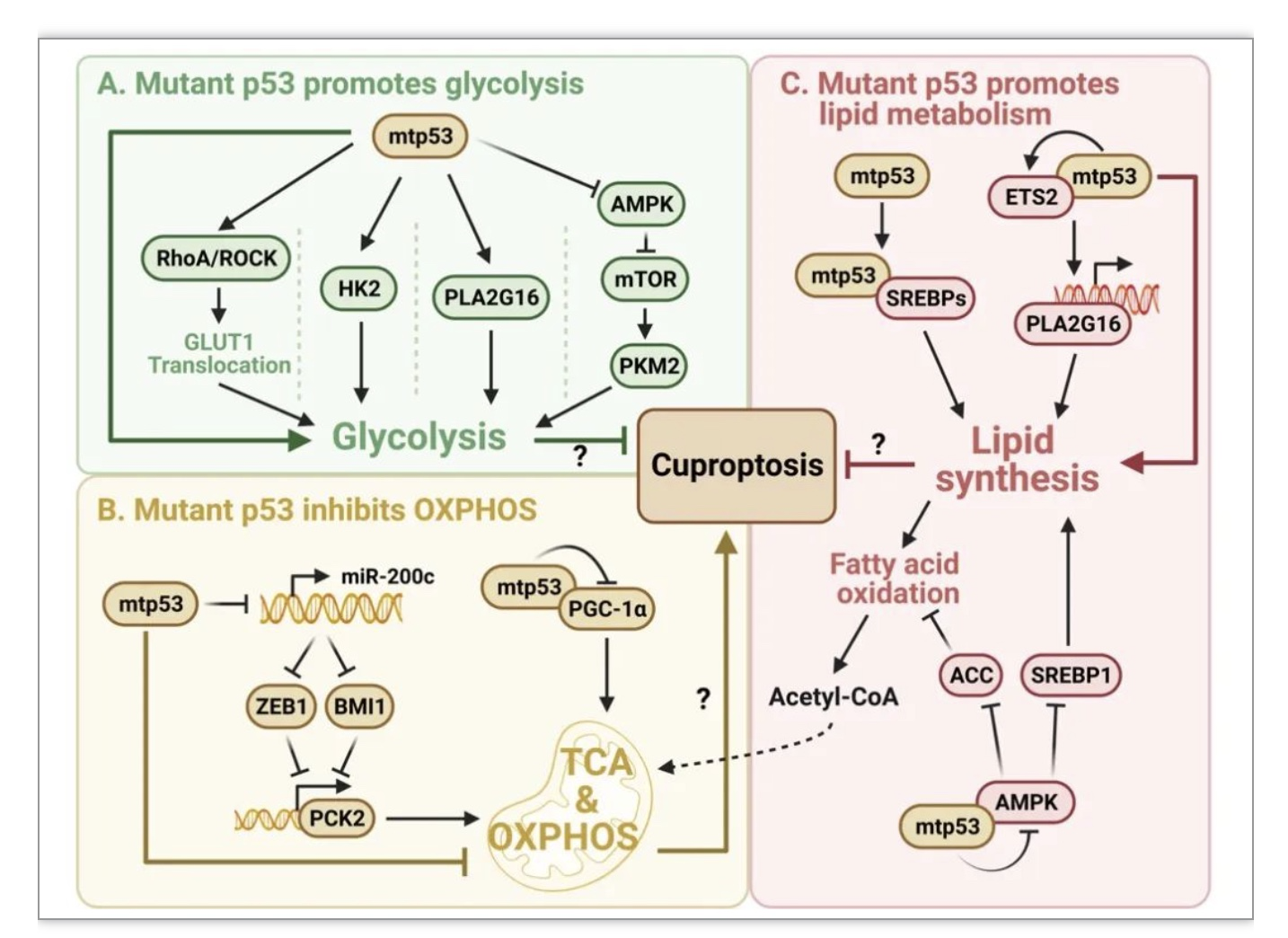
图2 突变型p53对铜死亡的调节
(图源:Xiong C, et al ., Cell Death Differ. 2023)

