合子基因组激活(Zygotic genome activation ,ZGA)是早期胚胎发育中的关键生物学事件,作为生命起始时的第一次转录活动,基因控制从母体向胚胎转变[1]。端粒是染色体末端的特殊结构,其长度在胚胎发育过程中被重置,但在着床前胚胎端粒变化的细节和意义尚不清楚。该研究发现,人类和小鼠胚胎的minor ZGA阶段端粒长度缩短,在major ZGA阶段显著延长。ZGA先锋因子DUX4/Dux是ZGA起始的标示之一,其表达量的波动与端粒长度变化呈负相关。ATAC测序结果表明,在人类minor ZGA中,DUX4启动子区域(即4号染色体长臂亚端粒)的染色质可及性峰瞬时增强。端粒区端粒异染色质H3K9me3的减少协同激活了人类胚胎干细胞中DUX4与p53的表达。研究者们提出,端粒通过染色质重塑调节DUX4/Dux的表达,从而参与了ZGA。

在胚胎发育的初始阶段,经过几次快速的分裂后,母体存储的RNA和蛋白质被清除,合子基因组逐渐激活。起始阶段发生的低水平转录被称为minor ZGA,随后引发胚胎内广泛的转录,称为major ZGA(图1)。随着着床前胚胎单细胞转录组和表观组图谱的绘制,对ZGA发生和调控的机制有了较为深入的认识。在人类早期胚胎,DUX4(小鼠同源物为Dux)作为ZGA的先锋分子被转录,继而激活胚胎卵裂阶段的数百个基因,包括KDM4E,ZSCAN4和PRAMEF家族基因以及内源性逆转录病毒组件,如小鼠MERVL和人类HERVL。人类DUX4定位于亚端粒区域4q35.2,其D4Z4重复序列约为10到100个单位,编码一个同源结构域转录因子。DUX4在成人肌肉组织中的表达将导致面部肩肱骨肌营养不良(FSHD)的疾病。在来自FSHD患者的成肌细胞/肌管中,DUX4的表达与端粒长度成反比。据推测,与年龄相关的端粒侵蚀引起的端粒位置效应(telomere position effect,TPE)的释放可能是导致患者肌细胞中DUX4表达的因素之一。
端粒和亚端粒属于异染色质区域,含有特定的翻译后组蛋白修饰(PTMs),阻碍了周围区域的可及性,从而导致转录受到抑制。端粒异染色影响范围向邻近区域的扩散被认为是TPE调控基因表达的主要机制。并且,端粒异染色质的程度与其长度成正比,端粒越长,TPE越明显。在早期合子基因组形成和胚胎发育过程中,一些研究者已经观察到端粒重复片段在着床前胚胎发育过程中大大增加。在小鼠植入胚胎中也已经观察到端粒长度的重置,并被认为与真正的多能性有关。然而,关于端粒长度的变化和端粒长度重塑在早期胚胎中的作用细节仍不清楚。
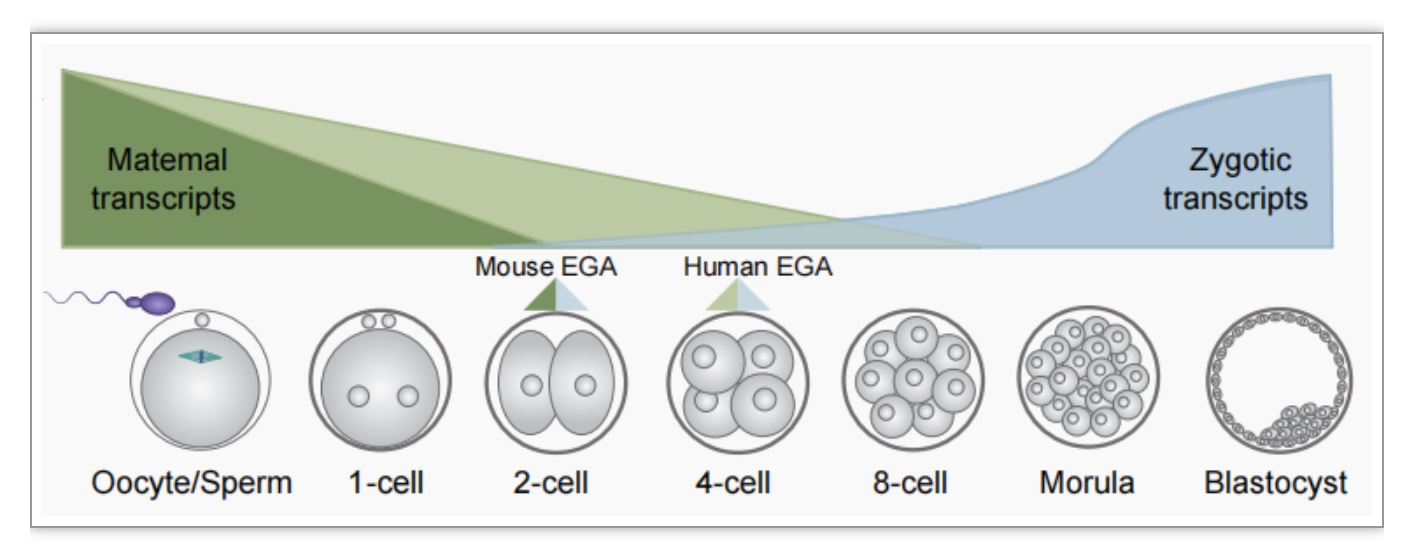
图1 母体-合子过渡(MZT)的过程,包括母体物质的降解和胚胎自身基因组的激活。MZT在所有14个物种中都是保守的,其中ZGA发生在小鼠的双细胞阶段和人类的四细胞阶段。
(图源:Xiaorui Z'hang, et al., iScience, 2023)
研究者首先通过端粒特异性定量荧光原位杂交(Q-FISH)评估了人类和小鼠配子和早期胚胎的端粒长度。发现,人类和小鼠早期胚胎经历了端粒长度的重构,在minor ZGA阶段缩短,major ZGA阶段延长。为了研究端粒重构与ZGA之间的关系,他们利用scRNA-Seq数据集和Q-PCR实验进一步构筑了ZGA先锋因子DUX4/Dux在胚胎中的表达模式,并证实其表达与端粒长度呈负相关。研究者们通过在小鼠胚胎中添加低浓度的α-阿曼尼素干预,引起部分minor ZGA基因延迟激活、端粒延伸失败、Dux持续表达和胚胎发育停滞。表明,major ZGA过程,随着端粒延伸,DUX4/Dux的表达被关闭。这一现象加强了端粒长度和Dux表达之间的关系。
端粒长度调控的基因表达已被证明与染色体可及性有关。研究者们通过分析早期胚胎发育端粒与亚端粒区域的可及性变化(LiCAT-seq),发现DUX4启动子在minor ZGA阶段一个短暂的染色质开放(图2),表明DUX4的表达与端粒区域的可及性有关,并推测端粒可能通过TPE影响邻近的异染色质状态调控DUX4基因的表达。
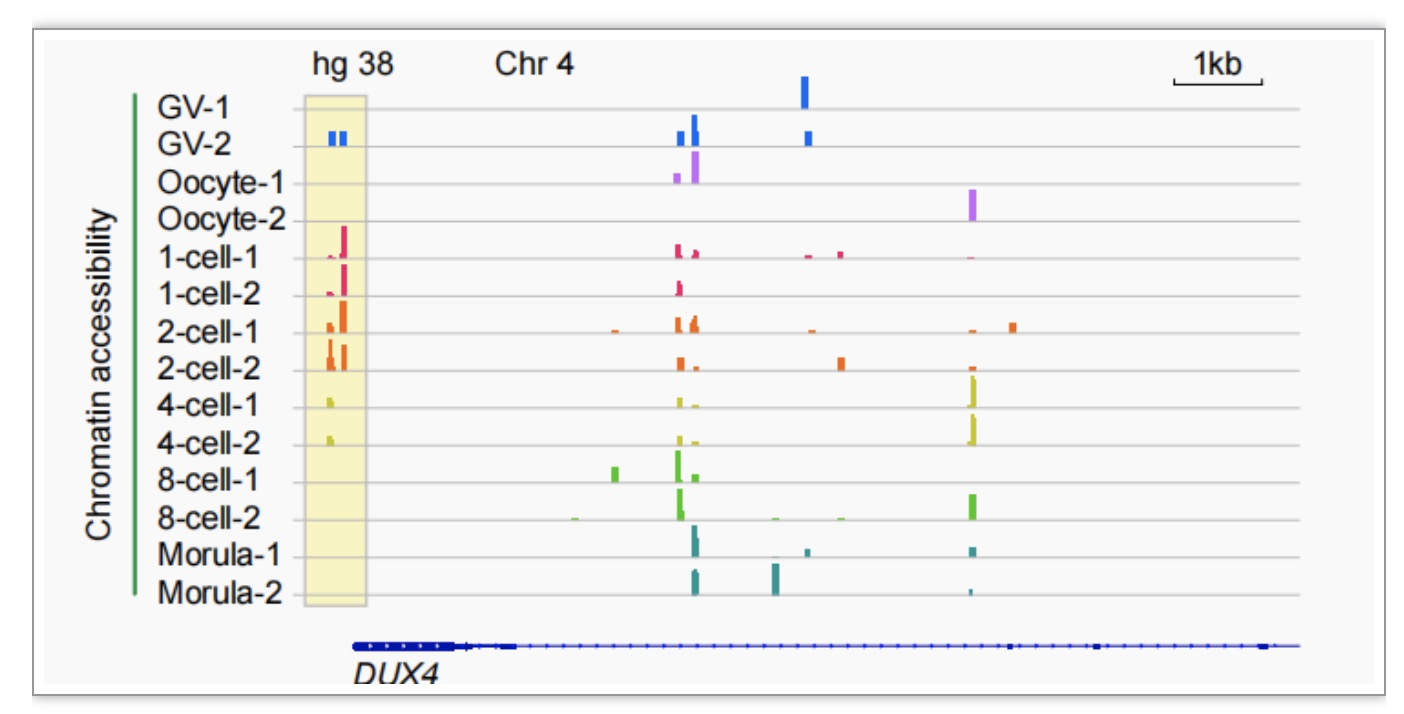
图2. 基因组图显示DUX4邻近区域染色质可及性,在minor ZGA阶段,DUX4启动子区域可及性短暂增加。GV,卵母细胞;MII,卵母细胞;2PN,受精卵;二细胞;四细胞;八细胞和桑葚胚。
(图源:Xiaorui Z'hang, et al., iScience, 2023)
为了进一步研究端粒染色质状态与DUX4表达之间的关系,研究者们以人类胚胎干细胞为模型,通过药物干预端粒的主要异染色质成分H3K9me3和H4K20me3,CRISPR/cas9介导4号染色体端粒区附近的基因编辑,证实TPE主要通过影响邻近的异染色质标记H3K9me3,调控了DUX4基因的表达。研究者又以p53基因敲除的人类胚胎干细胞为模型,探讨了端粒在p53-DUX4调控轴中的作用。发现端粒组蛋白H3K9me3的去甲基化可能促进转录相关的调控因子,如p53,进入结合位点,从而调节DUX4/Dux的激活。
通过上述的实验,研究者们提出(图3),minor ZGA中端粒长度的缩短会减弱端粒位置效应(TPE),导致H3K9me3在端粒区域的扩散减少,从而增加近端区域染色质的可及性。这将促进DUX4-p53转录轴的激活。而在major ZGA中被延长的端粒将诱导DUX4沉默。
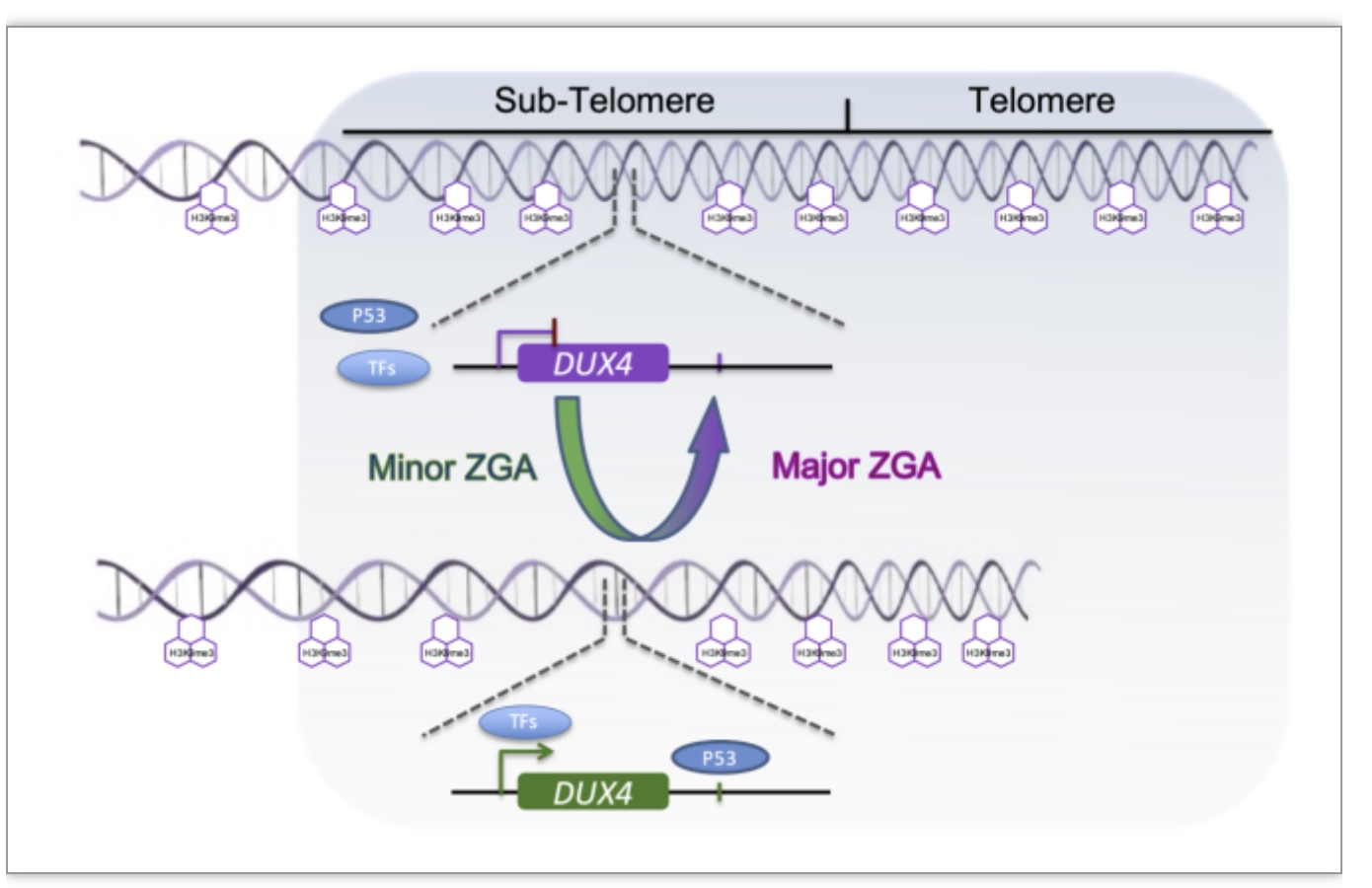
图3. 端粒动态变化调控ZGA先锋因子DUX4的模式图
(图源:Xiaorui Z'hang, et al., iScience, 2023)

