椎间盘退变(IVDD)和骨性关节炎(OA)是常见的退行性关节疾病[1]。IVDD是慢性腰背痛的已知主要危险因素,OA是老年人膝关节疼痛和残疾的主要致病原因。这两种疾病均严重恶化生活质量,现今常规的治疗手段无法从根本上抑制或逆转疾病的进展。因此,研究IVDD和OA的发病机制及其预防和治疗措施有着重大的社会需求及意义。因此,研究IVDD和OA的发病机制及其预防和治疗措施有着重大的社会需求及意义[1]。
大量研究表明,RNA结合蛋白(RBP)与肿瘤、肾脏疾病、神经退行性疾病、代谢性疾病、神经肌肉疾病和感染等密切相关。RBP是由多个中间序列组成的保守蛋白,可与编码基因的蛋白质、信使RNA(mRNA)和非编码RNA相互作用,执行不同的生物学功能,如调节mRNA的稳定性、选择性多聚腺苷化、管理非编码微小RNA (micro RNA,miRNA)的合成,从而影响下游靶点,在细胞转录后的基因控制和表达过程中起关键作用。近年来的研究表明一些RBP参与调控了退行性关节疾病发病机制。
作者回顾了RBP在退行性关节疾病研究的最新进展,总结并围绕着与IVDD和OA发病机制密切相关的慢性炎症、细胞外基质代谢、衰老、凋亡及铁死亡等展开综述和讨论,期待能进一步揭示退行性关节疾病的发病机制及开发新的治疗靶点。

RBP根据其结构可分为典型的RBP和非典型的RBP两大类。已知的大部分RBP通常具有典型重复序列,包括几个特异性RNA结合域(RBD)。常见的RNA结合结构域包括RNA识别基序(RRM)、冷休克结构域(CSD)、双链RNA结合基序(DSRM)、精氨酸-甘氨酸-甘氨酸基序(RGG结构域)和锌指结构域等(图1)。这些RBP可以在数量和排列上自由组合,实现准确的蛋白质识别和功能多样性并由此巨大的分子相互作用网络来调节细胞功能[2]。但是一些非典型RBP没有上述结构,取而代之的是一些特定的RNA结合位点,许多学者认为这类RBPs是RNA相互作用的中间代谢酶[3]。
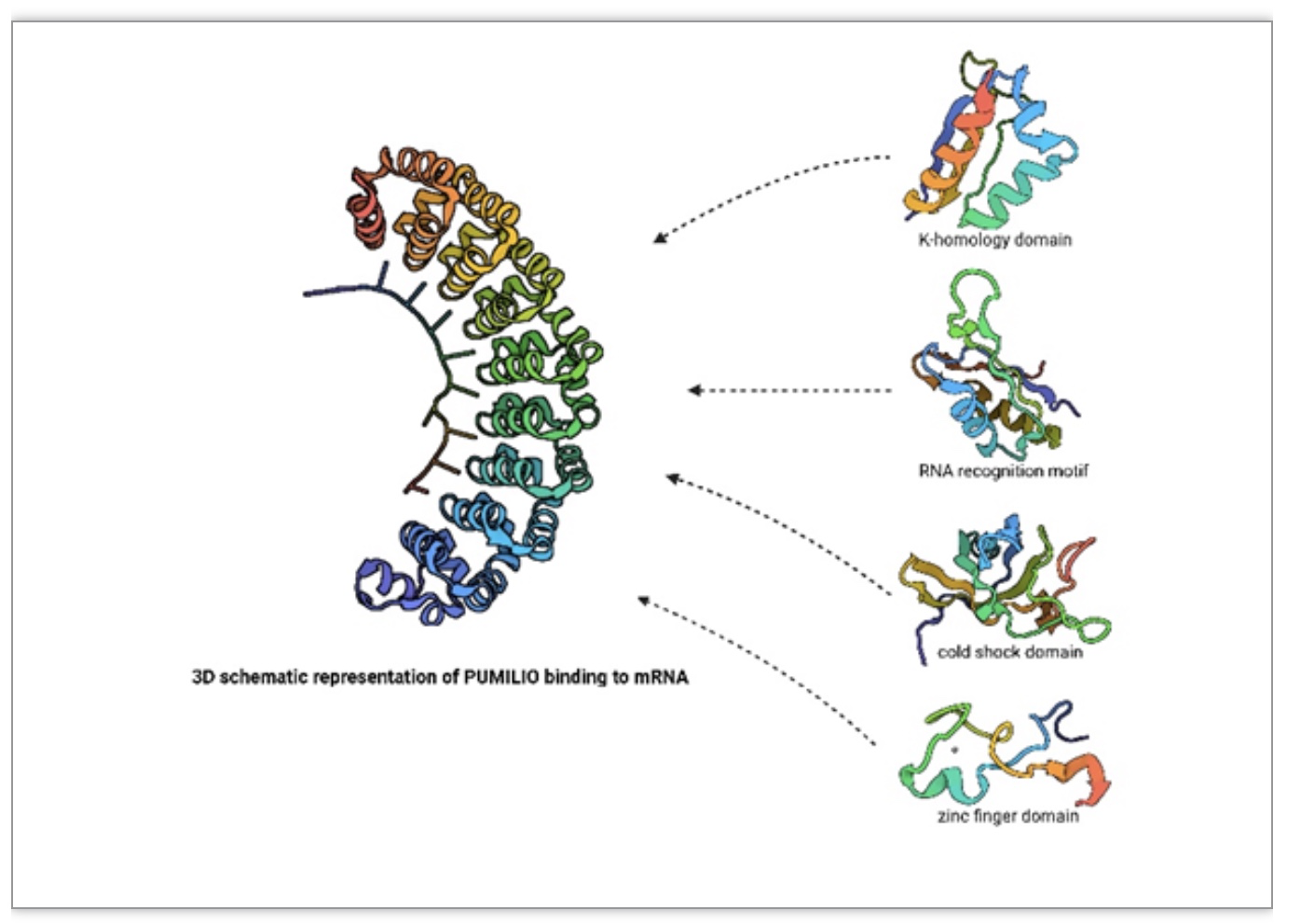
图1. RNA结合蛋白几种常见RNA结合域的三维示意图
(图源:Xiang M, et al., Ageing Res Rev. 2023)
二、富含AU元素的RNA结合蛋白(Au-rich elements-binding protein, ARBP)
ARBP因其对炎症的调控作用而被熟知,ARBPs家族包括tristetraprolin (TTP)、ARE结合因子1 (AUF1)、Hu抗原R(HuR)和T细胞胞内抗原1(TIA-1)。这类蛋白具有广泛的生物学效应,可以调节炎症、免疫功能和自噬,因此在许多疾病模型中都有研究。近年来的研究表明ARBP还可以对软骨细胞外基质(ECM)功能的产生影响(图2)。它们能够影响许多经典的炎症相关因子如COX-2、IL-10、TNF-α、NKRF mRNA的稳定性来调控炎症。椎间盘退变的研究发现HuR还可以稳定自噬相关蛋白7 (ATG7)的mRNA并上调其表达,促进自噬,从而减轻髓核细胞(NPC)衰老[4]。体外软骨细胞实验证实,HuR的敲低上调了MMP13的表达,并下调了MMP13转录抑制因子和ECM相关胶原的表达[5]。
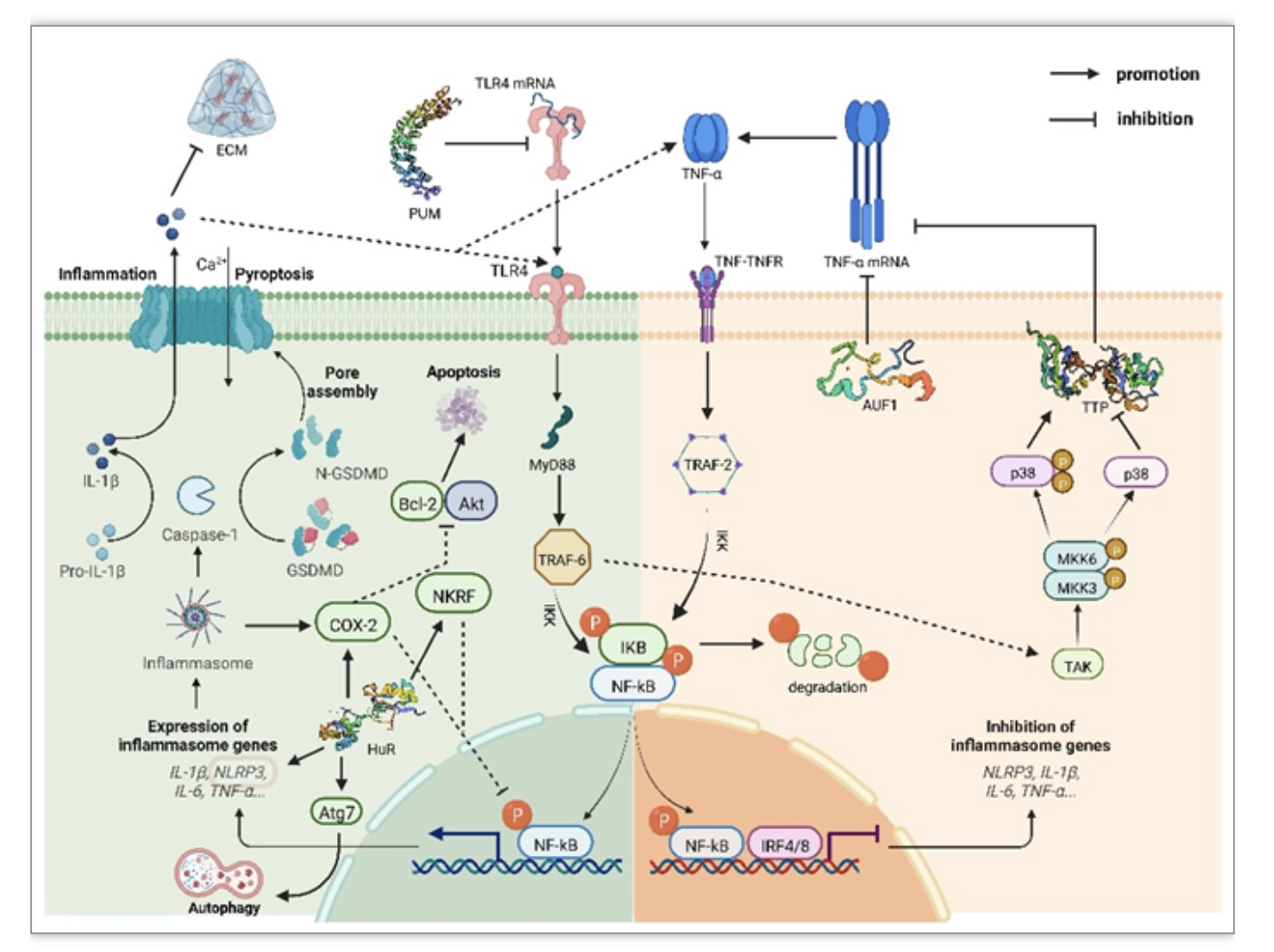
图2. RNA结合蛋白ARBP和PUM调节关节退行性疾病炎症的机制
(图源:Xiang M, et al., Ageing Res Rev. 2023)
FUS与EWS、TAF15RBP一起归属于FET(FUS、EWSR1、TAF15)蛋白家族,其在转录和转录后水平均起作用的核质穿梭RBP。在先前的FUS相关的疾病研究主要集中在与罕见和侵袭性形式的肌萎缩侧索硬化(ALS)和额颞叶痴呆(FTD)上。近年来研究发现FUS在ECM代谢中起重要作用。FUS和linRNA MM2P的相互作用稳定了M2巨噬细胞中的SOX9 mRNA,后者是ECM多种成分的重要调控因子[6]。circRNA SLC7A2在OA模型中降低,其环化受FUS的调控,circSLC7A2 的缺失减少会抑制TIMP3的表达而导致炎症反应,此外在软骨细胞中还发现FUS的敲低会上调降解酶MMP3、MMP13,并下调基质蛋白胶原II来影响ECM的合成[7]。
N6-甲基腺苷化(m6A)是真核细胞中最常见的RNA修饰,在mRNA生命周期中起着重要作用。但是m6A修饰转录物的命运由m6A结合蛋白所决定。它可以高选择性地与 mRNA 上的m6修饰位点结合并通过改变对所修饰mRNA 的识别来调节 m6A 修饰。包括一系列包含YTH结构域的蛋白质(YTHDF1、YTHDF2、YTHDF3、YTHDC1、YTHDC2)、eIF3、HNRPNPA2B1,HNRNPs等。YTHDF1 通过促进核糖体组装和与起始因子相互作用来增强m6A mRNA 翻译。YTHDF衰减m6A RNA稳定性并通过将其引导至细胞质中的加工体来促进其降解。YTHDF3则用以辅助YTHDF1和YTHDF2来执行它们的功能。研究发现Ythdf1介导了Mettl3催化的 Bcl2和Dmp1 mRNA的稳定性,前者抑制了OA炎症中软骨细胞的凋亡和自噬,而后者能够调节软骨细胞的分化[8-9]。椎间盘退变中发现YTHDF2识别减少而出现DNA甲基转移酶3B(DNMT3B)表达增强,DNMT3B又可以进一步通过E4F1 甲基化促进NPC衰老和椎间盘变性[10]。IGFBP2不但可以稳定NLRP3 mRNA,而NLRP3水平升高可以引发NPC的焦亡,还可以增强SIRT1 mRNA的稳定性来调节软骨细胞的增殖和 ECM 降解来加速OA的发展[11-12]。
Pumilio (Pum)/Puf 家族蛋白是一个高度丰富的细胞质 RNA 结合蛋白家族并普遍存在于真核生物中,但人类基因组仅编码两种PUM亚型PUM1和PUM2,PUM通过同源结构域-(Pum-HD)/Puf 结构域直接与靶 mRNA 结合使靶标不稳定。IVDD的发病机制与NPC衰老密切相关,IVDD的研究发现在NPC中RNA结合蛋白PUM可以与细胞周期蛋白E2F3 mRNA结合,使E2F3表达减少而促进NPC衰老[13]。然而,在OA的研究中得到了相反的结论。PUM限制TLR4 mRNA的翻译来抑制NF-κB的活性,并且PUM过表达即使在炎症诱导因子存在的情况下也能增强MSCs的成软骨潜能。在软骨细胞中,敲低PUM会促进软骨表型的丧失[14]。这种不一致可能是因为:①PUM下游结合的蛋白有很多,与不同蛋白的相互作用也可能导致其最终的不同结果。②这种差异也可能是由于在不同的疾病或不同的细胞类型中不一致的表达或者在不同的细胞类型中,PUM是否选择性地结合特定的蛋白质发挥功能。这些还有待进一步证实。也有报道PUM过度激活会导致基因组不稳定,因此PUM在退行性关节疾病中的作用需要进一步研究。
六、冷诱导RNA结合蛋白(cold-induced RNA binding protein,CIRBP或CIRP)
CIRBP是一种在人体多种组织和器官中广泛表达的核质穿梭蛋白,生理情况下位于细胞核内,在应激状态下则异位到细胞质中发挥功能。众所周知,退行性关节疾病与炎症、细胞衰老和死亡密切相关。CIRBP是一种的应激反应的RBP,能够参与多种细胞信号通路,由于其广泛的生物效应而被引起关注(图3):①CIRBP能通过TLR4-MyD88信号通路诱导NADPH氧化酶的活化生成ROS,而MyD88下游是经典的炎症通路TLR4/NF-κB[15]。慢性炎症可以上调CIRBP的表达,而慢性关节炎症与退行性关节疾病的进展关系密切,滑液中的CIRBP浓度与OA中炎症、疼痛及严重程度显著正相关[16-17]。②CIRBP参与凋亡相关信号通路或调控凋亡蛋白来发挥抗凋亡作用,显著抑制受损细胞的线粒体凋亡在应激条件下,CIRBP能抑制内、外源性凋亡途径发挥强大的抗凋亡作用。③细胞衰老的原因包括过量ROS产生的分子损伤的积累和慢性氧化应激状态引起的炎症反应。高ROS水平的异常积累可触发氧化应激,导致机体损伤、细胞衰老、死亡。硫氧还蛋白(Thioredoxin, Trx)是一种重要的抗氧化剂,CIRBP通过促进其翻译来增强ROS清除从而保护细胞免受氧化应激的损伤[18]。在一些肿瘤研究中发现CIRBP改善ERK1/2的磷酸化,刺激涉及S6和4E-BP1蛋白的蛋白质合成,并使原代细胞增殖并绕过复制性衰老。④近期研究证实CIRBP可诱导细胞发生铁死亡。外源性CIRBP刺激细胞能显著降低GPX4,并通过增加依赖于TLR4通路的脂质ROS诱导铁死亡,CIRBP通过与HuR相互作用并激活铁蛋白吞噬作用促进铁死亡[19]。另一项研究发现CIRBP或HuR的抑制能使GSH水平升高,而在铁死亡中GSH水平会出现降低[20]。这些结果表明,CIRBP不但影响催化酶GPX4的表达和还可能调控反应底物GSH的合成。CIRBP对ROS的调控机制复杂且具有双面性。CIRBP可能通过作用于Trx发挥抗氧化作用,引起脂质过氧化和铁死亡。CIRBP对细胞死亡的调控也发现了矛盾。CIRBP通过作用于内源性和外源性凋亡途径表现出强大的抗凋亡作用。相反,它也促进铁死亡。这些矛盾和争论值得进一步深入研究。此外,之前的研究已经证实,软骨和髓核均发现了铁死亡,但它们的铁死亡机制尚未完全阐明。

图3. CIRBP可能涉及与退行性关节疾病发病相关的调控机制
(图源:Xiang M, et al., Ageing Res Rev. 2023)
Lin28家族是哺乳动物中一类高度保守的RBP,由两个同源基因Lin28a和Lin28b组成,它们具有相似的结构和功能特征。Lin28可以在转录后水平选择性地限制miRNA let-7家族的生物合成,进而诱导mRNA剪接或抑制其翻译发挥生物学效应。研究发现Lin28在生理和OA状态下维持软骨完整性是必需的。在胚胎发育期间的关节软骨祖细胞中,Lin28a的过表达增加了关节软骨的厚度[21]。Let-7 miRNA的下游调控着许多目标mRNA,对软骨细胞分化和ECM合成至关重要。在OA小鼠模型中,Lin28a的过表达通过特异性抑制Let-7b和Let-7c miRNA水平而导致软骨丢失[22]。
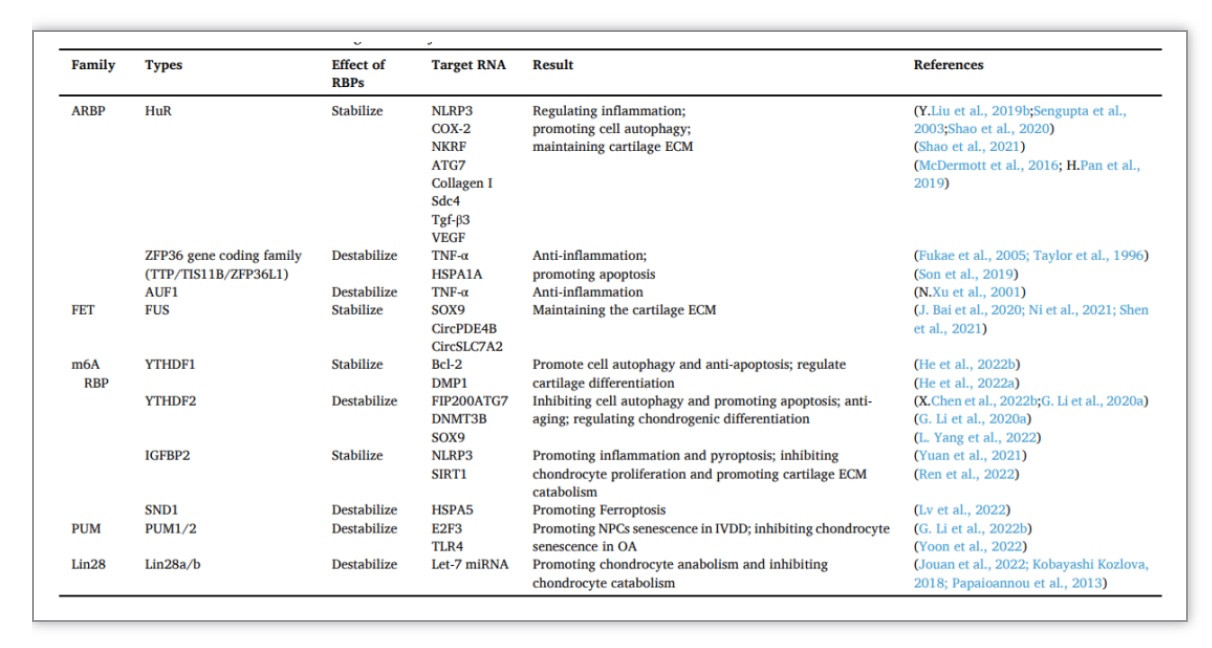
表1. RBP在退行性关节疾病中的已知作用和机制
(表源:Xiang M, et al., Ageing Res Rev. 2023)
RBP是一大类功能复杂的蛋白质,通过调节靶标RNA发挥其生物学效应。值得注意的是,最近研究证实了RBP在持续炎症、软骨ECM代谢、细胞衰老、细胞死亡等相关机制中发挥重要作用,而这些机制与退行性关节疾病密切相关(表1)。然而,RBP除了少数几种机制较为清楚外,其余的作用机制尚未完全被认识。因此,深入研究RBP在软骨细胞和NPC中的功能及其上下游靶点,有助于进一步揭示RBP诱导OA和IVDD的发病机制,可能成为该类疾病新的治疗靶点。