脂质是人体重要营养素之一,是细胞膜的重要组成成分,发挥着能量储存和供应、信号传导、物质运输和调节等重要生理功能。脂质的功能多样性来源于其组成及结构的多样性,如极性头基组成、非极性脂肪酸链组成及其sn位置、碳碳双键(C=C)位置及其顺反异构等。近年来,不少研究在脂质结构解析方面开展了卓有成效的探索,并在多种疾病样本中发现了脂质组成的变化,如在癌症样本中发现脂质C=C位置异构体组成与正常样本显著不同,提示其作为疾病标志物的可能性。然而,疾病条件下脂质C=C位置异构体等组成改变的生物化学机制尚不明确。
该研究利用深度结构脂质组学技术(In-depth Structural Lipidomics)[1-5],通过对关键脂质代谢酶(脂质脱氢酶SCD1等)的生物活性调节,详细分析了乳腺癌不同亚型细胞系中不饱和脂质,特别是不饱和脂质C=C位置异构体的组成变化,揭示了脂质脱氢与脂质氧化对脂质代谢重塑的协同效应,以及脂质氧化与乳腺癌细胞侵袭性之间的潜在关联。

2019年Nature发文报道称,癌细胞为增加自身代谢可塑性,可特异性激活FADS2通路作为SCD1脂质脱氢的补偿路径,会产生特殊的n-10脂质C=C位置异构体[6]。本项研究中,首先对这一现象进行验证,使用SCD1小分子抑制剂CAY10566抑制脂质脱氢活性,利用在线Paternò-Büchi衍生化反应耦合液质联用技术(LC-PB-MS/MS),发现了n-10位脂质C=C位置异构体含量的升高,说明SCD1抑制可重塑脂质C=C异构体组成。这一现象在不同乳腺癌细胞中均被证实。在研究的多种亚型乳腺癌细胞中,BT-474细胞中的FADS2表达最高,且n-10脂质C=C位置异构体含量也最高,在SCD1抑制后n-10脂质C=C位置异构体相对含量的升高也最明显(图1)。
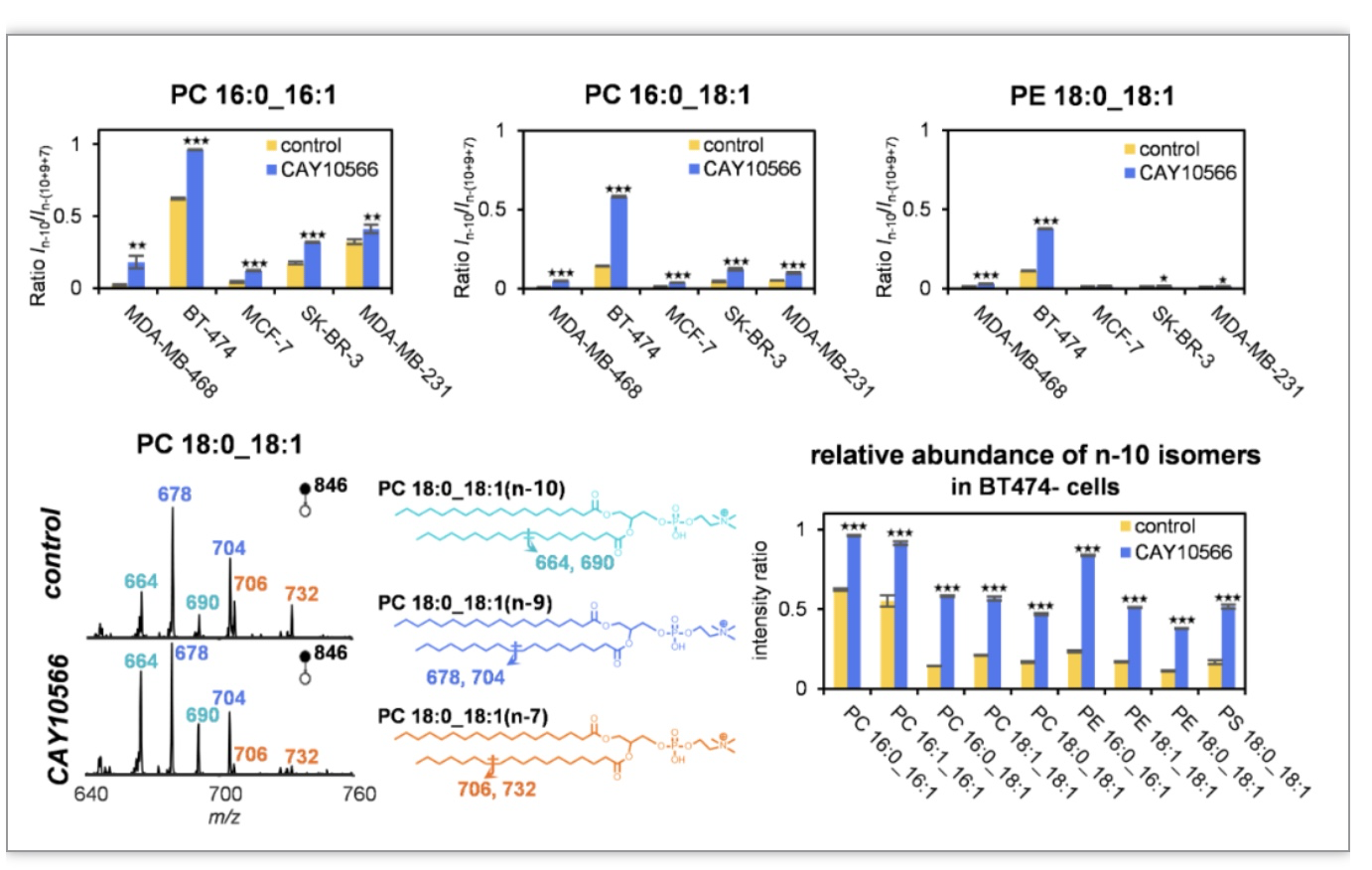
图1 SCD1抑制导致n-10脂质C=C位置异构体相对含量上升
(图源:Cheng, et al., Research, 2023)
接下来,系统分析了不同亚型乳腺癌细胞中C18:1脂质中n-9位异构体与n-7位异构体的相对含量,这是以往研究最为关注的一项指标。结果显示,该指标在不同亚型癌细胞变化不一。其中,在MCF-7细胞系、MDA-MB-468细胞系和BT-474细胞系中,大多数含C18:1酰基链的脂质的n-9/n-7异构体比值呈上升趋势。然而,SK-BR-3细胞系和MDA-MB-231细胞系的变化与预期不符。对于SK-BR-3细胞,大多数单不饱和脂质中n-9/n-7异构体比值上升,而多不饱和脂质中n-9/n-7异构体比值下降;对于MDA-MB-231细胞,除少数脂质如PE 18:1_18:2和PE 18:1_19:0外,大部分脂质中n-9/n-7异构体均下降。基于上述结果,根据除C18:1外另一条脂肪酰基的组成,将各亚型细胞系中被分析脂质分为四组,包括含奇数碳数脂肪酰基磷脂、含饱和脂肪酰基磷脂、含单不饱和脂肪酰基磷脂和含多不饱和脂肪酰基磷脂。不过,在同一亚型细胞系中,每组内磷脂的n-9/n-7异构体组成变化趋势是一致的。本研究也分析了细胞中游离脂肪酸FA 18:1 C=C位置异构体组成,同样发现不同亚型乳腺癌细胞系对SCD1抑制具有不同响应(图2)。

图2 SCD1抑制对不同人类乳腺癌细胞系亚型中C18:1脂质n-9/n-7异构体比值的影响
(图源:Cheng, et al., Research, 2023)
根据已有的脂质代谢通路,C18:0可经SCD1脱氢产生C18:1 n-9,再经脂肪酸氧化(fatty acid oxidation,FAO)产生C16:1 n-9。考虑到FAO也可重塑脂质异构体组成,本研究以PC 16:0_16:1为研究对象,研究SCD1和FAO两者活性同时变化时,脂质异构体组成的变化规律。结果表明,单纯SCD1抑制会增加PC 16:0_16:1中n-9/n-7异构体比值。对比而言,MDA-MB-231和SK-BR-3细胞中FAO活性很高,对FAO(限速酶CPT1)的抑制结果表明同时抑制CPT1和SCD1可提高C18:1中n-9/n-7异构体比例,从而得到与仅抑制SCD1时MCF-7、MDA-MB-468和BT-474细胞系中异构体比例相一致的变化。上述实验表明,不同亚型人乳腺癌细胞中的脂质代谢重塑受到多个脂质代谢酶(包括脂质脱氢和脂质氧化)的共同调控(图3)。

图3 脂质氧化过程对脂质C=C位置异构体组成的影响
(图源:Cheng, et al., Research, 2023)
本研究还探索了脂质C=C位置异构体组成与癌细胞侵袭性的关系,发现癌细胞中高C16:1 n-9/n-7比值对应其高侵袭性。现有研究表明,FAO是细胞供能和提供合成原料的重要途径,并能通过促进上皮-间充质转化和改变细胞微环境,提高癌细胞侵袭性。本文提出利用深度脂质组学技术解析含C16:1磷脂C=C位置异构体组成,通过结构脂质组分析研究脂质氧化活性,并开展脂质组成与癌细胞侵袭性的关联研究(图4)。
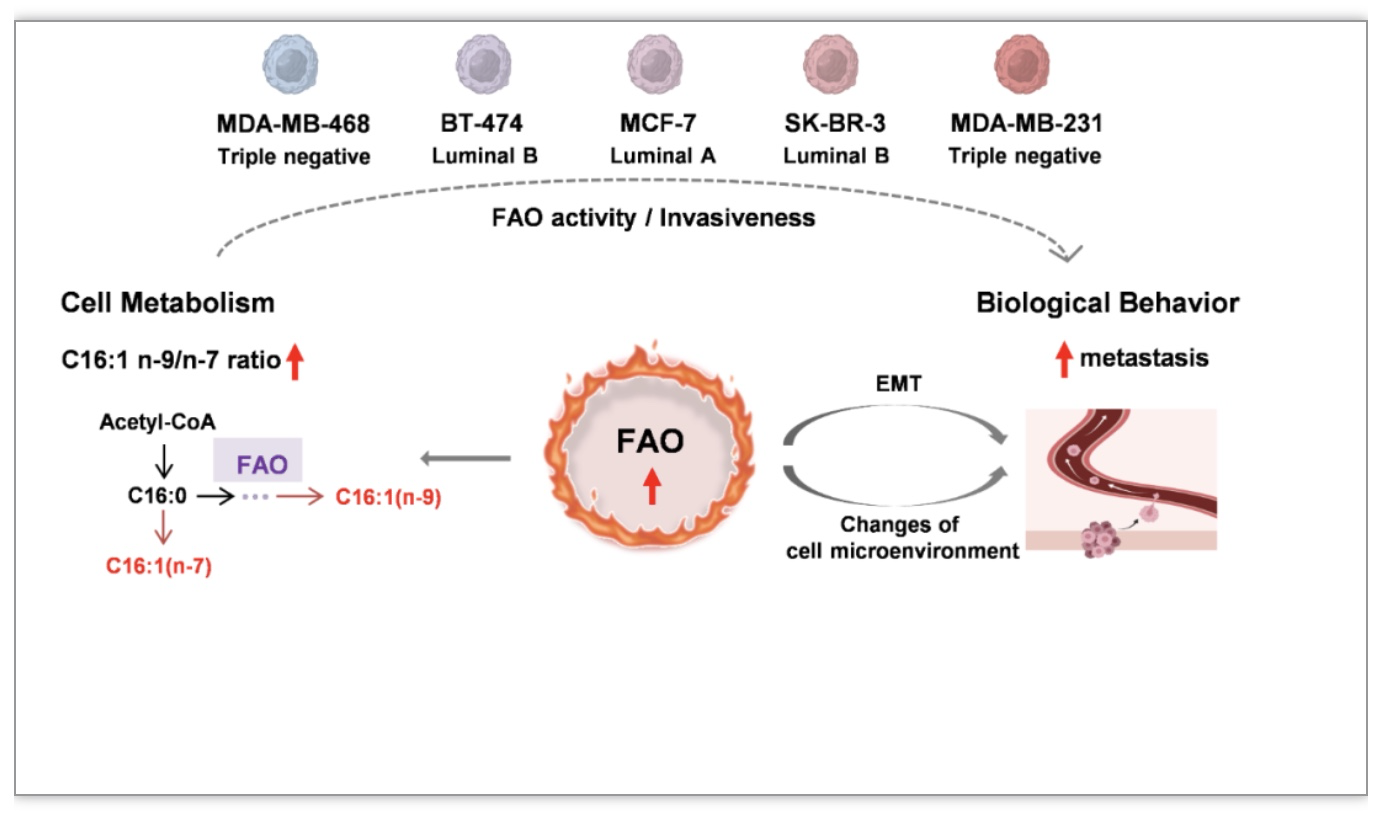
图4 结构脂质组学技术推动脂质组成与癌细胞侵袭性的关联研究
(图源:Cheng, et al., Research, 2023)

