特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种间质性肺疾病,其特征为肺组织慢性进行性纤维化,从而导致肺功能严重的下降。有证据表明,随着人口老龄化的加剧,IPF的发病率正在上升。IPF预后较差,死亡率较高。据报道,IPF诊断后生存期仅有2.5-3.5年[1]。临床上IPF的治疗包括药物治疗、肺移植、干细胞治疗等,但目前来看各种治疗效果都比较有限。关于特发性肺纤维化的发病机制,通常认为与环境、遗传因素以及异常修复过程有关[2]。大量研究表明,作为一种与免疫系统紊乱有关的疾病,T细胞功能失调可能在肺纤维化的进程中起到关键性作用,因此明确各种类型T细胞在肺纤维化进程中的不同作用对于探究特发性肺纤维化发病机制以及寻找更多有效的精准治疗方法有着极其重要的意义。作者们首先概述了当前关于特发性肺纤维化发病机制的研究现状,指出了肺泡上皮细胞的反复修复失调是纤维化形成过程的关键,而免疫细胞分泌的细胞因子水平的变化与这一过程关系密切,紧接着作者们描述了T细胞在肺免疫功能中的重要作用以及肺纤维化病人中T细胞的特征,随后总结了当前不同亚型T细胞在IPF中作用的研究现状,最后指出了未来的研究方向。
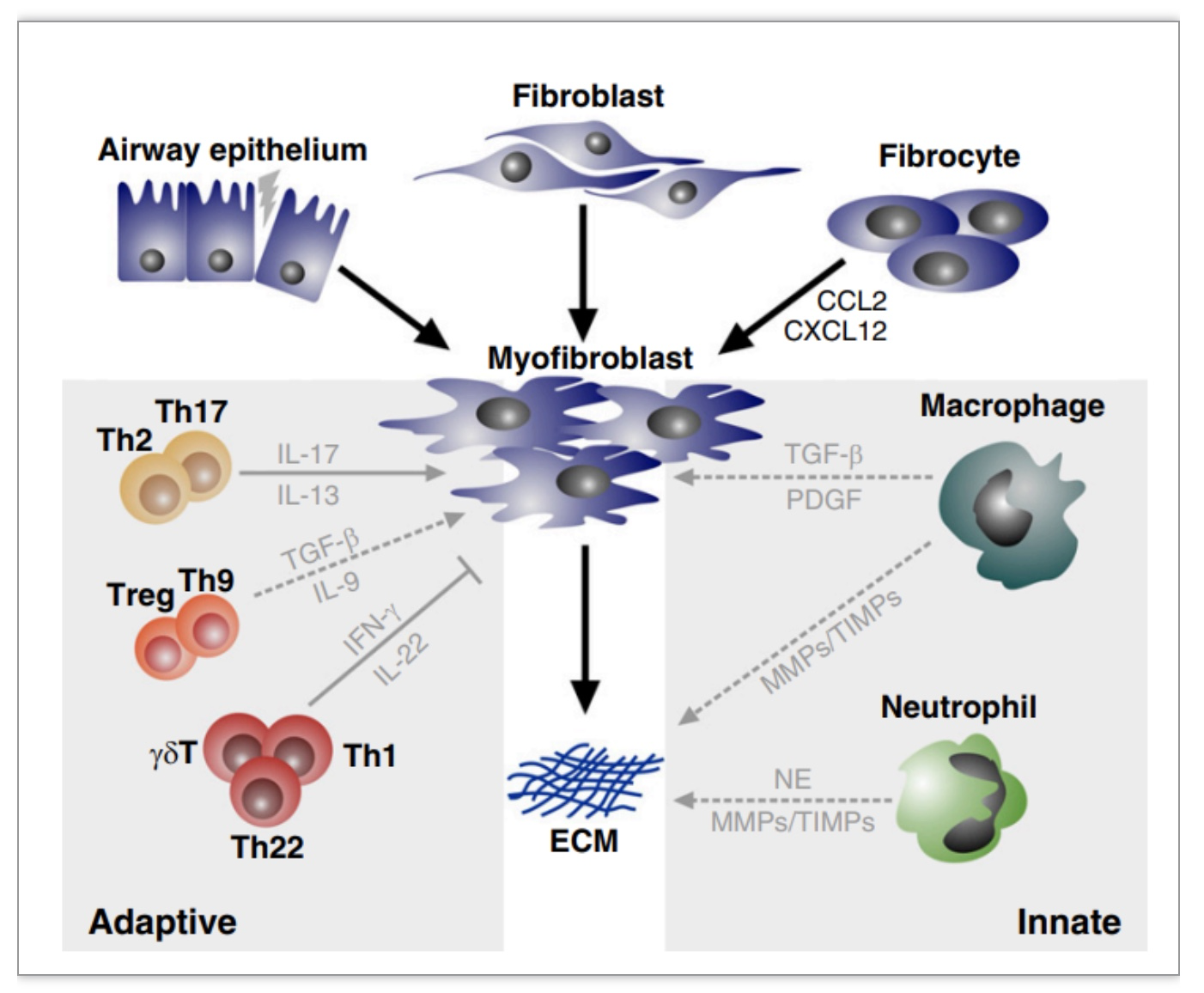
 大量流行病学研究表明,IPF的危险因素多种多样,包括吸烟、金属粉尘[3]、农业工作、木屑、石头、沙子和二氧化硅[4]以及微生物等影响[5]。然而,个体遗传因素被认为是IPF纤维化进程中最重要的因素,但是它们与可能的外部因素的相互作用尚未明确阐明。在发病机制上,肺泡上皮组织的反复微损伤被认为是异常创面修复过程的第一个触发因素,有助于纤维化的发生。因此,反复修复的功能失调的肺泡上皮是最终纤维化形成的关键。具体来说,当1型肺泡上皮细胞(type alveolar epithelial cells, AEC1s)遭遇反复的微损伤时,2型肺泡上皮细胞(type alveolar epithelial cells, AEC2s)本应再生受损的上皮细胞,但由于各种因素,创面愈合过程使得免疫细胞分泌的细胞因子水平发生了变化,最终导致促纤维化和抗纤维化失衡。例如,TGF-β1被认为是一种有效的促纤维化介质,可通过跨膜受体丝氨酸/苏氨酸激酶和胞质SMAD-2/3信号通路促进下游靶基因,包括前胶原I和前胶原III的表达。此外,一些其他信号通路,包括细胞外信号调节激酶(ERK)、丝裂原激活蛋白激酶、磷脂酰肌醇3-激酶/Akt通路和rho样GTPase通路也被发现在TGF-β1促进肺纤维化中发挥作用。因此,尽管IPF中炎症和免疫发生的具体机制仍不甚明确,但是可以肯定的是免疫通路在纤维化过程中发挥着极其重要的作用(图1)。
(图源: Saeed Kolahian, et al., Translational review, 2016)
T细胞作为适应性免疫的重要组成部分,不仅介导了细胞免疫应答,并且参与了部分体液免疫应答的过程。在肺中,CD4+和CD8+ T细胞是主导的适应性免疫细胞,参与病原体的清除,并且倾向于作为记忆T细胞持续存在。此外,除了病因明确的感染性疾病外,很多肺部疾病如哮喘、急性呼吸窘迫综合征等都不同程度地与T淋巴细胞介导的免疫反应有关,肺纤维化也不例外。特别是一些T细胞相关的基因和蛋白,如CD28和LCK,已经被作为IPF的预后生物标志物。具体而言,IPF中外周血单个核细胞(PBMC)的转录分析阐明了T细胞调节基因CTLA4的下调表达与生存率的降低相关。类似地,有研究表明循环T细胞上共刺激分子CD28的表达下降预示着IPF患者的不良预后。另外,IPF肺组织中CD8+ CD28null T细胞显著增加,CD28null T细胞表达与CD28+ T细胞相似的CTLA4,抗CTLA4治疗被证明可以加速IPF的纤维化。因此,CD28null T细胞可能促进纤维化[6],但免疫检查点CTLA4可能具有保护作用,限制了这种作用。由此可见,T细胞相关的表面分子、细胞因子等水平的变化对肺纤维化进程有重要影响。但是,目前关于T细胞在IPF中的作用存在较大争议,从不同亚型的角度具体分析T细胞的作用更具有指导意义。
正常人肺中T细胞数量较少,但IPF中富集的T细胞弥散存在于支气管肺泡灌洗液和肺组织中,与肺部炎症反应一致。研究表明IPF患者肺组织和支气管灌洗液中CD8+ T细胞显著增加。同时,CD8+ T细胞与呼吸困难的分级及疾病严重程度相关,并且CD8+ T细胞在募集并对病毒感染做出反应的过程中会加速对肺的损伤。此外,CD8+ T细胞在IPF纤维化组织中弥漫性浸润,可分为两种,一种产生IFN-γ而不产生IL-4,导致纤维化减弱,一种产生IL-4而不产生IFN-γ的细胞,可以促进纤维化。总之,CD8+ T细胞可能对纤维化过程有反向影响,但CD8+ T细胞水平越高,肺损伤越严重。对于CD4+ T细胞,趋化因子受体CXCR3和CCR4的表达分析表明,Th2细胞可能在IPF中占主导地位。此外,IPF患者肺泡灌洗液中CD4+ T细胞CXCR3和CCR4的表达明显不平衡。因此,过去认为Th1/Th2免疫反应的功能失衡在IPF发病中起着至关重要的作用。Th1/Th2水平甚至在一定程度上可以预测疾病的严重程度和预后。
IPF是一种老年化疾病。随着年龄的增长,负责产生幼稚 T细胞的胸腺在60岁时逐渐被脂肪组织取代,适应性免疫系统随之衰退。幼稚 CD4+和CD8+T细胞在老化的肺中相对于记忆T细胞有明显减少。并且,与年轻正常志愿者相比,老年人支气管肺泡液灌洗液中CD4/CD8比值显著升高,这意味着随着年龄的增长,幼稚 T细胞转化为功能性记忆T细胞的数量减少,这也可能与CD4+ T辅助细胞可被启动的树突状细胞数量减少有关。此外,调节性T细胞在老年人中也被发现数量增加,但这种变化的机制尚不确定,特别是与调节性CD4+ T细胞数量减少有关。事实上,近年来越来越多的研究发现,每一种特定的T细胞亚型都可能通过特定的机制促进或逆转疾病的进展。
大量流行病学研究表明,IPF的危险因素多种多样,包括吸烟、金属粉尘[3]、农业工作、木屑、石头、沙子和二氧化硅[4]以及微生物等影响[5]。然而,个体遗传因素被认为是IPF纤维化进程中最重要的因素,但是它们与可能的外部因素的相互作用尚未明确阐明。在发病机制上,肺泡上皮组织的反复微损伤被认为是异常创面修复过程的第一个触发因素,有助于纤维化的发生。因此,反复修复的功能失调的肺泡上皮是最终纤维化形成的关键。具体来说,当1型肺泡上皮细胞(type alveolar epithelial cells, AEC1s)遭遇反复的微损伤时,2型肺泡上皮细胞(type alveolar epithelial cells, AEC2s)本应再生受损的上皮细胞,但由于各种因素,创面愈合过程使得免疫细胞分泌的细胞因子水平发生了变化,最终导致促纤维化和抗纤维化失衡。例如,TGF-β1被认为是一种有效的促纤维化介质,可通过跨膜受体丝氨酸/苏氨酸激酶和胞质SMAD-2/3信号通路促进下游靶基因,包括前胶原I和前胶原III的表达。此外,一些其他信号通路,包括细胞外信号调节激酶(ERK)、丝裂原激活蛋白激酶、磷脂酰肌醇3-激酶/Akt通路和rho样GTPase通路也被发现在TGF-β1促进肺纤维化中发挥作用。因此,尽管IPF中炎症和免疫发生的具体机制仍不甚明确,但是可以肯定的是免疫通路在纤维化过程中发挥着极其重要的作用(图1)。
(图源: Saeed Kolahian, et al., Translational review, 2016)
T细胞作为适应性免疫的重要组成部分,不仅介导了细胞免疫应答,并且参与了部分体液免疫应答的过程。在肺中,CD4+和CD8+ T细胞是主导的适应性免疫细胞,参与病原体的清除,并且倾向于作为记忆T细胞持续存在。此外,除了病因明确的感染性疾病外,很多肺部疾病如哮喘、急性呼吸窘迫综合征等都不同程度地与T淋巴细胞介导的免疫反应有关,肺纤维化也不例外。特别是一些T细胞相关的基因和蛋白,如CD28和LCK,已经被作为IPF的预后生物标志物。具体而言,IPF中外周血单个核细胞(PBMC)的转录分析阐明了T细胞调节基因CTLA4的下调表达与生存率的降低相关。类似地,有研究表明循环T细胞上共刺激分子CD28的表达下降预示着IPF患者的不良预后。另外,IPF肺组织中CD8+ CD28null T细胞显著增加,CD28null T细胞表达与CD28+ T细胞相似的CTLA4,抗CTLA4治疗被证明可以加速IPF的纤维化。因此,CD28null T细胞可能促进纤维化[6],但免疫检查点CTLA4可能具有保护作用,限制了这种作用。由此可见,T细胞相关的表面分子、细胞因子等水平的变化对肺纤维化进程有重要影响。但是,目前关于T细胞在IPF中的作用存在较大争议,从不同亚型的角度具体分析T细胞的作用更具有指导意义。
正常人肺中T细胞数量较少,但IPF中富集的T细胞弥散存在于支气管肺泡灌洗液和肺组织中,与肺部炎症反应一致。研究表明IPF患者肺组织和支气管灌洗液中CD8+ T细胞显著增加。同时,CD8+ T细胞与呼吸困难的分级及疾病严重程度相关,并且CD8+ T细胞在募集并对病毒感染做出反应的过程中会加速对肺的损伤。此外,CD8+ T细胞在IPF纤维化组织中弥漫性浸润,可分为两种,一种产生IFN-γ而不产生IL-4,导致纤维化减弱,一种产生IL-4而不产生IFN-γ的细胞,可以促进纤维化。总之,CD8+ T细胞可能对纤维化过程有反向影响,但CD8+ T细胞水平越高,肺损伤越严重。对于CD4+ T细胞,趋化因子受体CXCR3和CCR4的表达分析表明,Th2细胞可能在IPF中占主导地位。此外,IPF患者肺泡灌洗液中CD4+ T细胞CXCR3和CCR4的表达明显不平衡。因此,过去认为Th1/Th2免疫反应的功能失衡在IPF发病中起着至关重要的作用。Th1/Th2水平甚至在一定程度上可以预测疾病的严重程度和预后。
IPF是一种老年化疾病。随着年龄的增长,负责产生幼稚 T细胞的胸腺在60岁时逐渐被脂肪组织取代,适应性免疫系统随之衰退。幼稚 CD4+和CD8+T细胞在老化的肺中相对于记忆T细胞有明显减少。并且,与年轻正常志愿者相比,老年人支气管肺泡液灌洗液中CD4/CD8比值显著升高,这意味着随着年龄的增长,幼稚 T细胞转化为功能性记忆T细胞的数量减少,这也可能与CD4+ T辅助细胞可被启动的树突状细胞数量减少有关。此外,调节性T细胞在老年人中也被发现数量增加,但这种变化的机制尚不确定,特别是与调节性CD4+ T细胞数量减少有关。事实上,近年来越来越多的研究发现,每一种特定的T细胞亚型都可能通过特定的机制促进或逆转疾病的进展。
虽然作为一种促炎因子,IFN-γ因为可以抑制成纤维细胞的胶原沉积而被认为是典型的抗纤维化因子。因此,Th0细胞衍生而来的Th1细胞由于产生IFN-γ而被广泛认为是抗纤维化的T细胞。IPF患者肺泡灌洗液或循环中IFN-γ水平的降低正好提示了Th1的积极作用。实验表明,CD4+ T细胞中Th1转录因子T-bet的缺乏使得对博来霉素具有天然抗性的BALB/c小鼠对博来霉素诱导的肺纤维化的易感性更高[7]。IPF中Th1型趋化因子模式分析表明,肺成纤维细胞在正常情况下倾向于诱导Th1型免疫反应,即Th1细胞参与正常瘢痕愈合过程。因此Th1细胞及IFN-γ被认为是抗纤维化的。
与Th1细胞相反,在IPF病理中,Th2细胞被认为是促纤维化细胞,其特征是产生IL-4、IL-5和IL-13。IPF患者肺泡灌洗液中Th2相关细胞因子也显著升高[8-9]。对IL-4和IL-13的研究表明,这两种趋化因子促进成纤维细胞增殖并诱导成纤维细胞向肌成纤维细胞分化,而Th1细胞因子IFN-γ则可以抑制这一过程。此外, IL-4可以刺激巨噬细胞产生一种名为IGF-I的生存因子,保护肌成纤维细胞不发生凋亡,进一步促进纤维化。鉴于Th1和Th2之间的拮抗关系,一些研究人员在安慰剂对照试验中尝试用IFN γ -1b治疗IPF患者,但患者的生存率并没有明显改善。Tralokinumab(一种人IL-13单克隆抗体)的类似试验也没有显示出同样显著的疗效。毋庸置疑,Th1和Th2细胞在IPF发病机制中占有重要地位,受到了众多研究者的关注,但针对Th1 / Th2失衡治疗的策略可能需要更多的评估和论证。
Th17细胞以产生IL-17为特征,被认为是Th细胞的第三个亚群。Th17细胞分泌的经典细胞因子IL-17和IL-22在许多感染情况下有助于宿主防御,但也在多种自身免疫性疾病如类风湿关节炎中被发现可以加速炎症过程。与正常人相比,IPF患者的IL-22无明显变化。IL-17不仅是Th17细胞的产物,还来源于其他多种免疫细胞,包括巨噬细胞、中性粒细胞、NK细胞、ILC3和γδ-T细胞等[10-11]。重要的是,在IPF患者的炎症和纤维化组织中检测到了大量Th17细胞和IL-17, IL-17的增加被认为是纤维化发展的潜在因素。在博莱霉素诱导的IPF肺纤维化小鼠模型中, IL-17被证明不仅可以刺激胶原沉积和ECM产生,而且还介导了TGF-β信号通路。此外, IL-17A也与中性粒细胞募集到肺有关,这是博来霉素诱导纤维化的典型变化,然而关于TGF-β和IL-17A的调控尚不明确。有趣的是,实验表明PD1+Th17细胞是TGF-β的重要来源,CD4+T细胞上PD1的上调可以促进IL-17A和TGF-β的产生,最终加重纤维化。更重要的是,IL-17A抗体治疗可成功改善IPF小鼠模型的纤维化。
此外,Th17谱系还具有对调节性T细胞(Treg)的低敏感性。鉴于Treg细胞有负责调节免疫反应和维持免疫耐受的作用,这一特征在一定程度上对于Th17细胞引起的炎症的持续存在至关重要,也支持了Th17细胞在自身免疫过程中的作用。实验表明,IL-17A的中和诱导了Treg的积累,并缓解小鼠模型中二氧化硅诱导的肺纤维化。事实上,在小鼠中,IL-27能够通过调节Th17和Tregs的失衡来减弱肺纤维化的过程。但实际中关于Th17及相关细胞因子的临床试验证据还很缺乏,有待进一步研究。
Treg被广泛报道具有抗纤维化的作用。在IPF患者中,外周血和肺泡灌洗液中Tregs功能明显受损。支持这一观点的是,通过降低CCR7表达来上调Tregs的表达,可以减弱小鼠的纤维化。然而,由于可以促进TGF-β的产生,导致成纤维细胞增殖,Tregs也被认为是调控纤维化进程的促进因子[12-13]。近期研究报道,IPF患者Treg的比例和绝对数量显著增加,同时Treg/Th17轴出现调控异常。此外,Treg亚型的不平衡,特别是激活型Treg比例的增加,也被证实与IPF的严重程度相关。典型的异常亚型之一,Sema7a+CD4+CD25+FoxP3+ Tregs可能通过抑制损伤诱导TGF-β1促进纤维化。此外,当抑制PD-1途径来逆转Tregs分化时,可通过减少胶原-1积累来改善纤维化进程。有趣的是,Tregs在肺纤维化的不同阶段有相反的作用,在博莱霉素诱导的肺纤维化模型中,Treg可能在损伤阶段产生TGF-β1和胶原积累,但可能在后期改善纤维化的进程。换言之,Treg在IPF的发展过程中起着相互矛盾的作用,具体的促进或抑制作用取决于所处的阶段。由于小鼠模型不足以完全概括人类肺纤维化的情况,因此需要进一步的实验来阐明Treg是否能在体内增强或减轻纤维化。
综上所述,与健康受试者相比, IPF中各亚型T细胞产生的趋化因子在数量或主要物质上有较大不同。作者们指出,虽然IPF的确切发病机制尚不明确,但可以看出,T细胞在纤维化的发生过程中发挥着重要作用,其机制无疑是复杂的。一般来说,T淋巴细胞在IPF中的促纤维化或抗纤维化作用与T细胞的确切亚群以及病理阶段有关。甚至传统意义上的保护作用在某些情况下也可能是有害的。重要的是要认识到T细胞诱导的炎症对损伤恢复至关重要,炎症和炎症消退之间的失衡会导致纤维化。关于未来的研究方向,作者们谈到,与直接观察成纤维细胞增殖或上皮细胞损伤不同,T细胞的研究更加精准,并且因个体免疫微环境而异。关键分子的存在为早期诊断IPF提供了可能,而针对特定T细胞或其产物的分子药物治疗以及恢复T细胞各亚群间的平衡也为IPF的治疗提供了新方法。显然,在T细胞相关治疗中,单纯一刀切的方法并不适用。因此,在IPF患者的诊断和治疗中,非常需要涉及基因组学、生物标志物和免疫分子谱的精准医学的综合评估和进一步研究。