根据供氧含量和血流方向可将肝小叶分为汇管周围区(periportal zone, 1区)、过渡区(intermediary zone, 2区)和中央静脉周围区(pericentral zone, 3区)[1]。肝脏的氧含量、基因表达谱和细胞分布等特征在不同肝分区呈现异质性,导致区域性肝损伤模式[1]。肝缺血再灌注(ischemia-reperfusion, I/R)损伤是肝移植的常见并发症,其损伤模式呈现肝分区特异性[2],但其空间分辨率下的基因表达失调和细胞功能障碍机制尚未被阐明。利用空间转录组学揭示了小鼠肝I/R模型肝分区损伤的分子细胞图谱,预测并验证了传统中药雷公藤(Tripterygium wilfordii)中单体化合物雷公藤红素(Celastrol)通过HIF1α 通路减轻肝I/R损伤。

作者通过对健康小鼠不同肝分区展开空间转录组分析,确定了各分区的标志基因和主要功能。与1区相比,3区富含多种编码细胞色素P450酶的基因,并富集到内源和外源代谢通路(图1a),而1区高表达基因主要富集到组氨酸和谷氨酸代谢与细胞增殖通路(图1b)。此外各分区存在非实质细胞(non-parenchymal cells,NPCs)异质性,表现为1区中如内皮细胞等NPC含量更高(图1c),可能对肝I/R损伤发挥保护作用[3-5]。
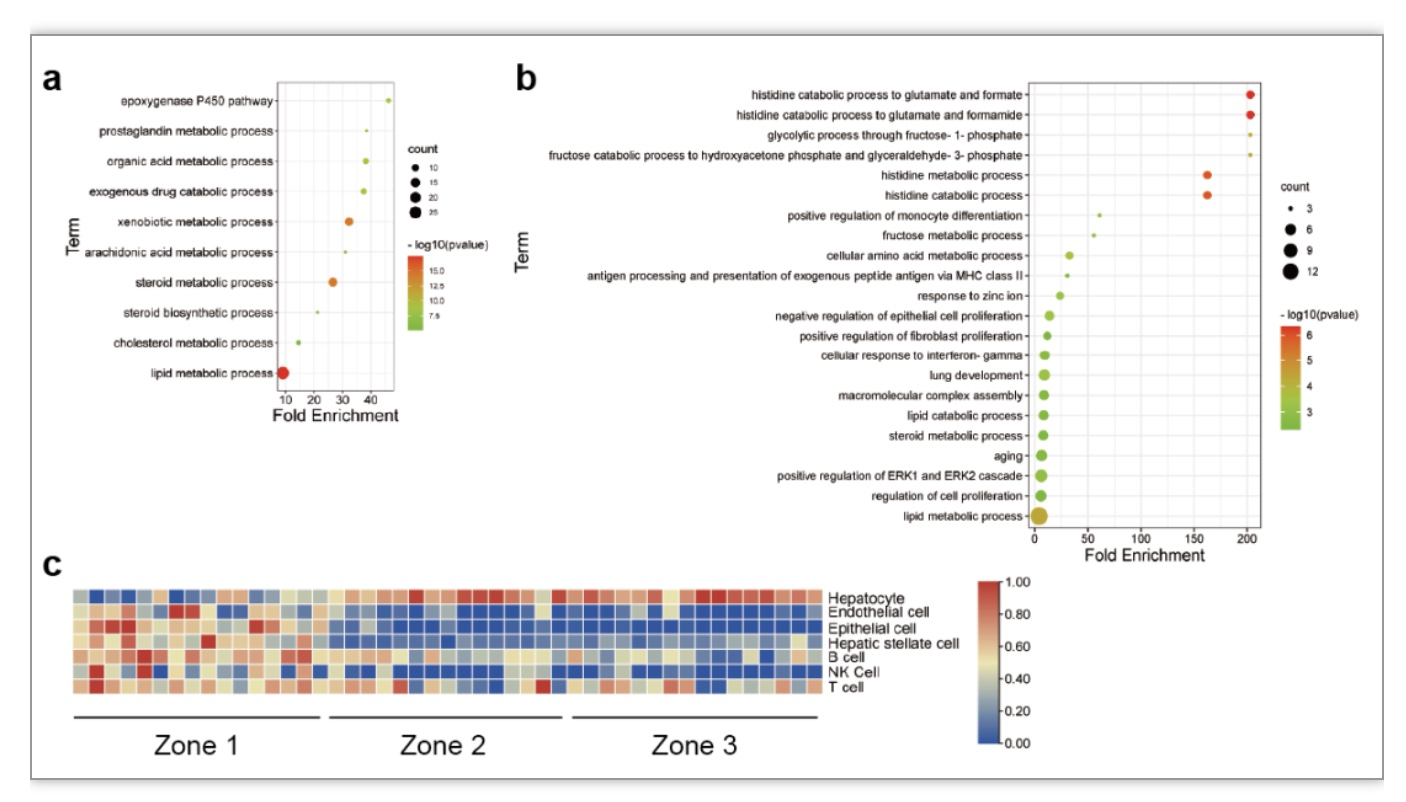
图1. 空间转录组分析小鼠健康肝脏的功能通路和NPCs含量
(图源:Xin J, et al., Commun Biol. 2023)
作者进而建立小鼠I/R模型,发现3区为主要的损伤区域,组织病理学表现为大量细胞坏死、肝窦充血、免疫细胞浸润等肝损伤特征。对各肝分区进行空间转录组分析后发现与健康状态相比,I/R后3区高表达急性期反应基因和热休克蛋白,通路富集在急性炎症反应、未折叠蛋白反应和自噬通路(图2),去卷积分析结果显示I/R后3区肝实质细胞含量显著下降(图3a, b)。免疫浸润分析和免疫组化结果显示3区中促炎性M1巨噬细胞含量上升,而抗炎性M2巨噬细胞含量下降(图3c)。以上结果从分子和细胞层面解释了3区I/R损伤模式的可能机制。
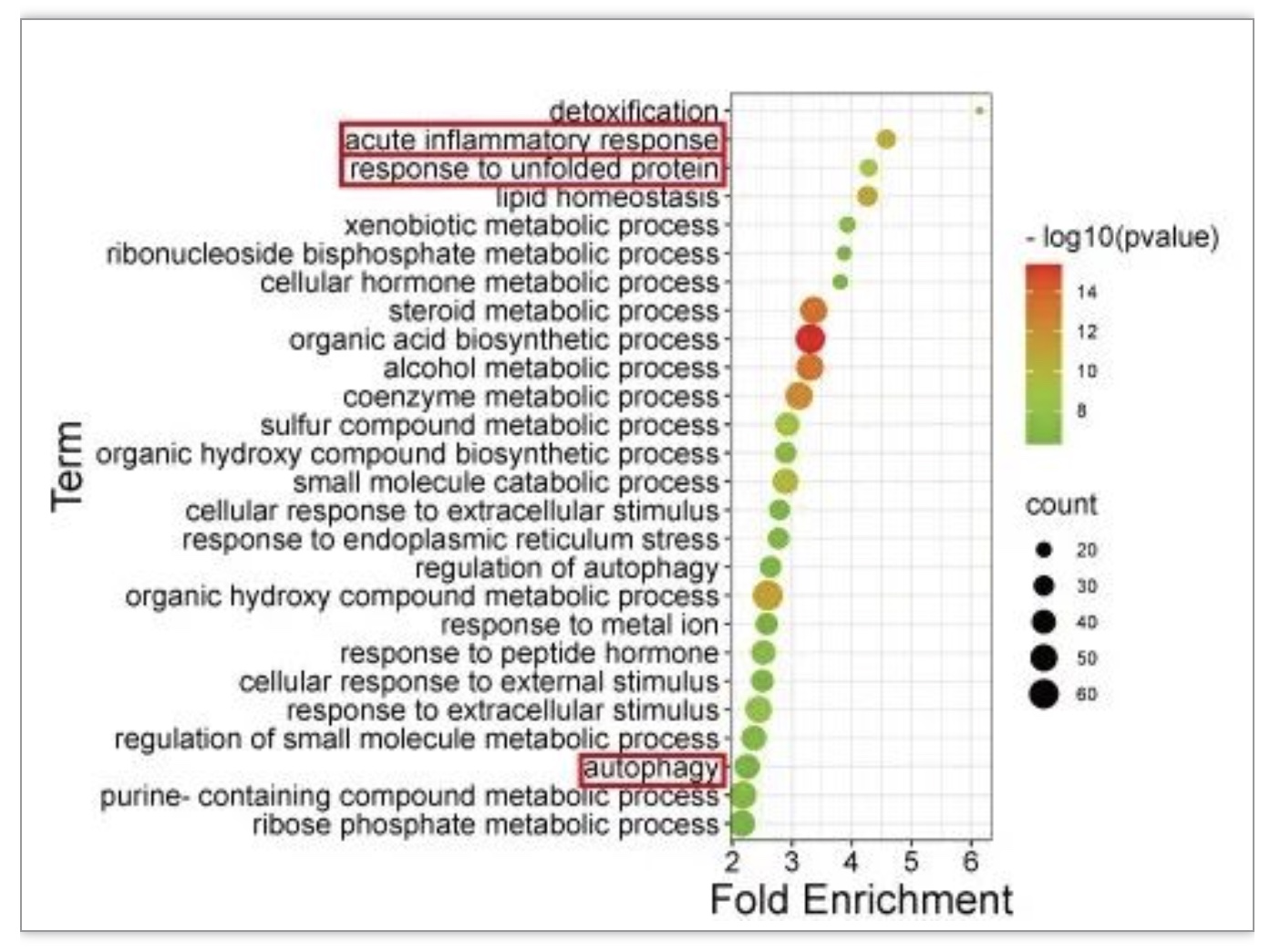
图2. 空间转录组分析I/R后差异基因和功能通路
(图源:Xin J, et al., Commun Biol. 2023)

图3. I/R导致肝实质细胞和肝NPCs的比例和含量改变
(图源:Xin J, et al., Commun Biol. 2023)
作者选取I/R引起3区特异性损伤通路(图2b)中的差异基因,利用CMap数据库预测模拟I/R相关基因扰动的小分子药物。通过对3条通路候选药物取交集确定Celastrol为唯一候选药物(图4a)。进而以H&E染色等实验验证Celastrol可显著减轻小鼠肝I/R损伤(图4b)。
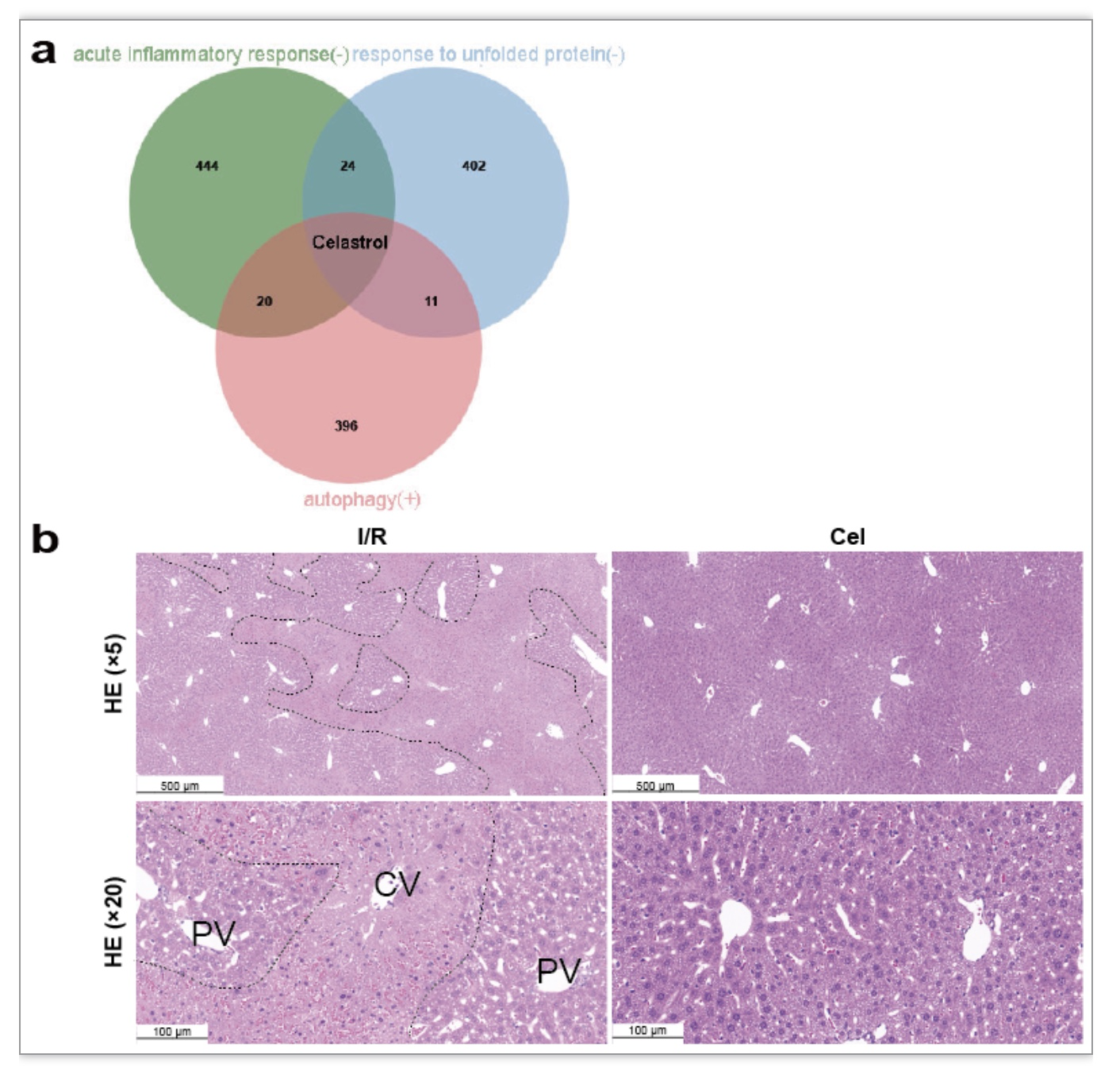
图4. Celastrol减轻小鼠肝I/R损伤
(图源:Xin J, et al., Commun Biol. 2023)
作者通过GEO数据分析、Hub基因分析等方式预测缺氧诱导因子1α (HIF1α)可能是Celastrol减轻I/R损伤的关键分子靶点。通过分子对接、双荧光素酶报告基因实验证明Celastrol可与HIF1α 结合并激活HIF1α 通路(图5a-d)。综上所述,Celastrol可能成减轻临床肝移植引起I/R损伤的潜在治疗药物。
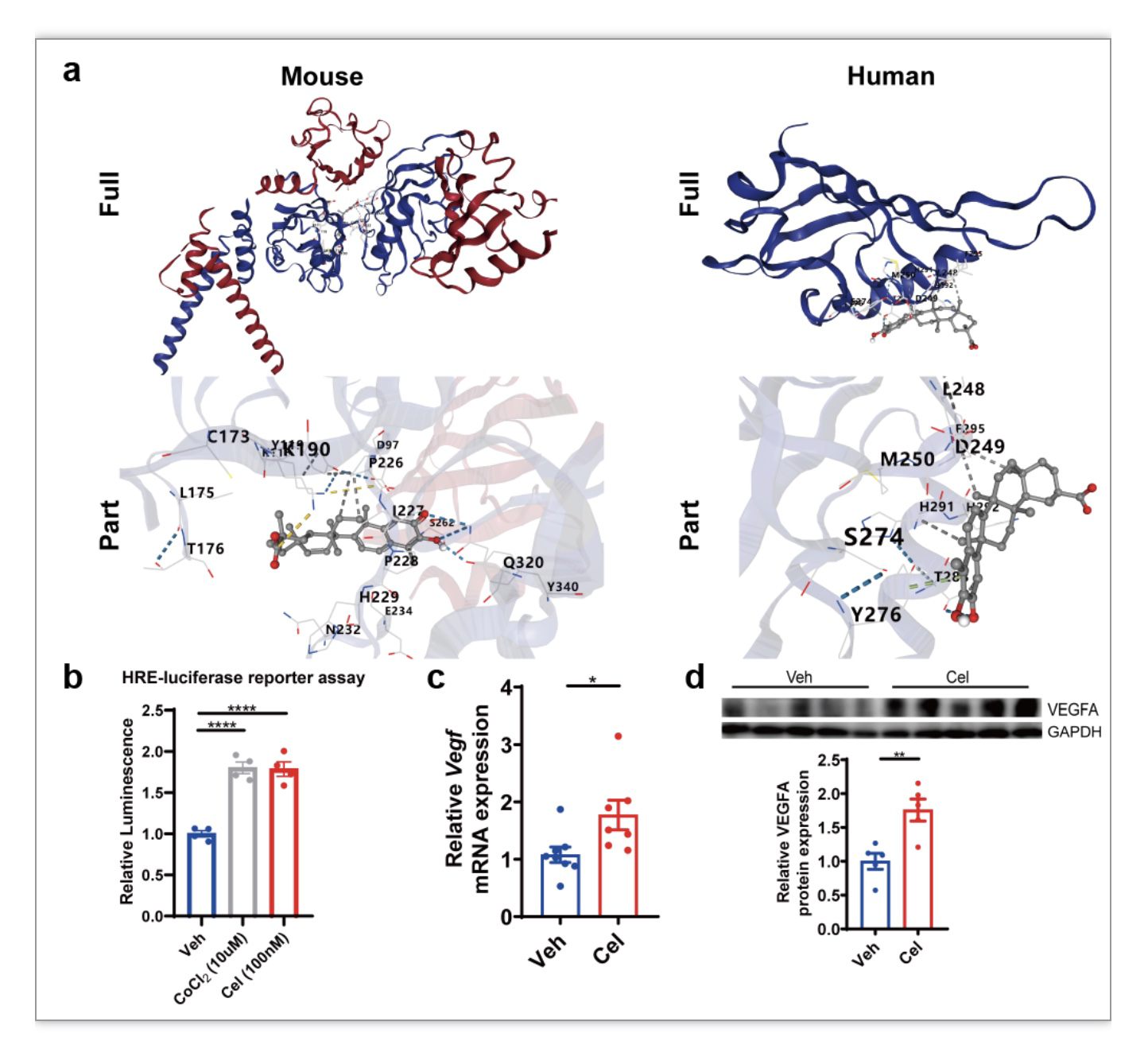
图5. Celastrol激活HIF1α 通路
(图源:Xin J, et al., Commun Biol. 2023)
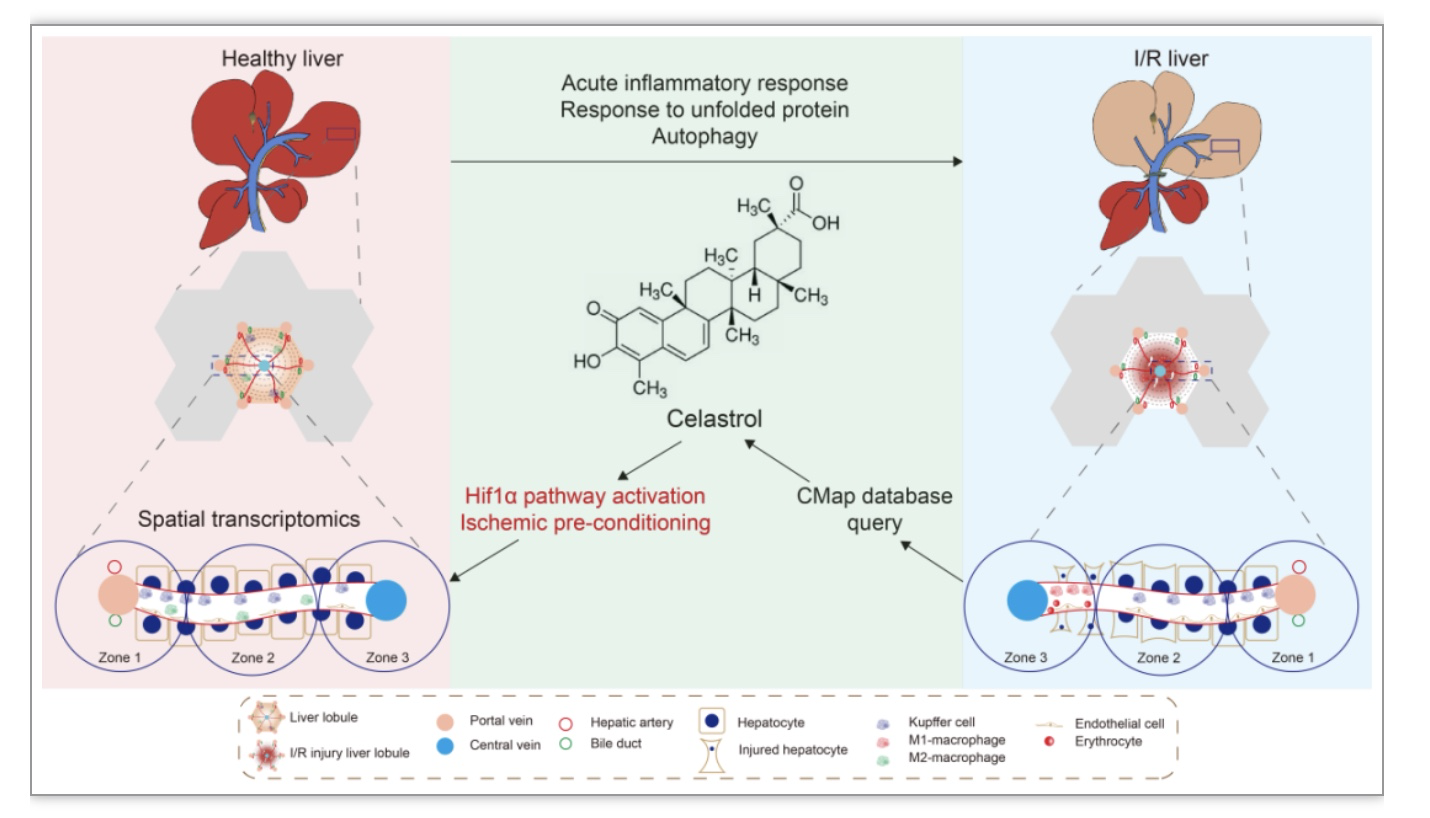
图6. 空间转录组分析肝I/R引起急性炎症反应、未折叠蛋白反应和自噬通路改变和细胞含量变化,并预测验证Celastrol通过激活HIF1α 通路、达到缺氧预处理作用从而减轻肝I/R损伤
(图源: Nature Portfolio Health Community 同作者发表的Behind the Paper评论

