同源重组(Homologous Recombination, HR)在基因组双链断裂(Double-Stranded Break, DSB)修复中以高保真的方式发挥着重要作用。在古菌中执行这一任务的主要是核酸酶NurA和ATP依赖的的转位酶HerA。古菌的NurA-HerA复合体介导了DSB DNA末端的切除,并且生成了用于匹配源序列的游离3’末端。虽然目前古菌的NurA和HerA结构已得到解析,但关于其DSB DNA末端切除的相关分子调控机制研究仍十分有限。在细菌中也发现了编码NurA-HerA蛋白的基因,其与古菌的蛋白序列一致性低于20%。目前关于细菌NurA-HerA复合体的生物学功能仍存有争议,其结构和生化活性研究较少,NurA-HerA在细菌DSB DNA末端切除中的详细机制研究尚处空白。该研究首次解析了耐辐射奇球菌(Deinococcus radiodurans, dr)HerA的晶体结构并依靠低分辨冷冻电镜数据构建了一个drNurA-HerA-DNA复合物的模型,同时,结合生化实验分析,鉴定了其各亚基互作以及发挥功能的关键氨基酸残基,阐述了其对DSB DNA的5’端进行特异性切割并产生游离的重组型3’单链DNA末端的可能机制。该研究为解析细菌NurA-HerA复合体介导的DSB DNA末端处理机制提供了新的见解。

该研究首先通过X射线衍射和低分辨率冷冻电镜解析了drHerA的结构,数据显示drHerA无论在是否结合核苷酸的情况下都形成稳定且形态类似的六聚体(图1A,B)。每个drHerA包括三个结构域:N端的HAS桶状结构域,其形成了底物DNA的出口;RecA样ATP酶结构域;螺旋束结构域,它插入了RecA样ATP酶结构域内部并形成了底物DNA的入口。在RecA样ATP酶结构域内部还鉴定到一个保守的HerA/FtsK家族dsDNA特异性易位相关基序(TR motif)(图1C)。根据低分辨冷冻电镜密度图,利用解析的drHerA结构和AlphaFold2预测的drNurA结构,获得了drHerA-NurA复合物的模型(图1D)。与古细菌型NurA相比,drNurA显示出不同的二聚化形式。
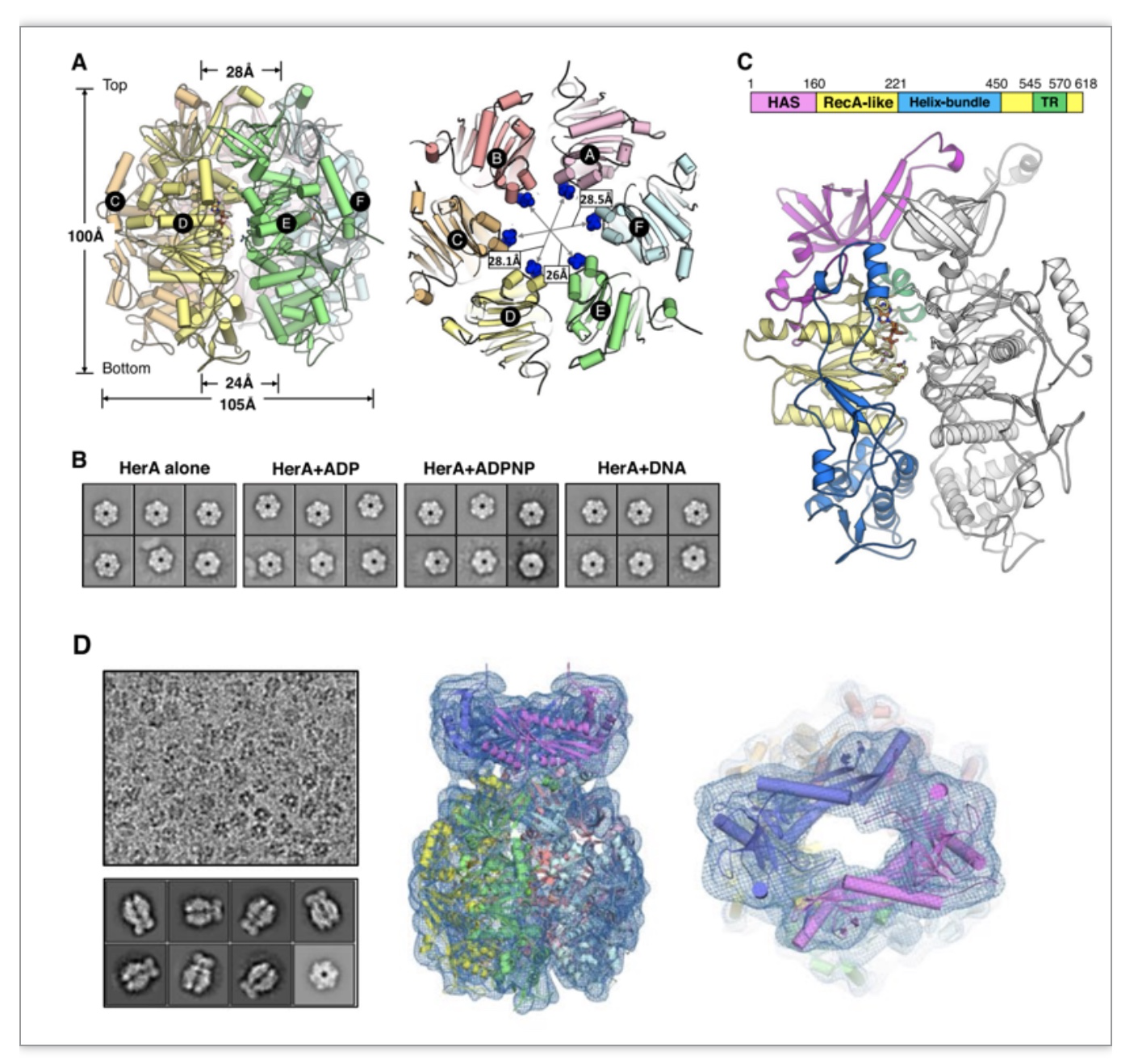
图1. drHerA及drNurA的结构总览
(图源:Yang J, et al., BMC Biol , 2023)
与古菌NurA-HerA一样,drHerA与drNurA之间的相互作用对于它们进行正常的生理活动亦是必不可少的。古菌NurA和HerA的互作主要由一些疏水相互作用介导,一个NurA分子以不同部位分别结合三个HerA分子。而对drHerA与drNurA互作界面的分析发现, drHerA的互作部位带高负电荷,drNurA的互作部位带高正电荷,同时,一个drNurA分子可以利用不同部位分别结合四个drHerA分子(drHerA六聚体中有两个亚基同时被两个drNurA结合)(图2)。利用点突变和凝胶排阻层析实验找到了关键互作位点——drHerA上的三个保守的带负电氨基酸残基,以及drNurA上的四个带正电荷的保守基序。这些数据提示细菌NurA-HerA和古菌NurA-HerA有着不一样的互作模式。
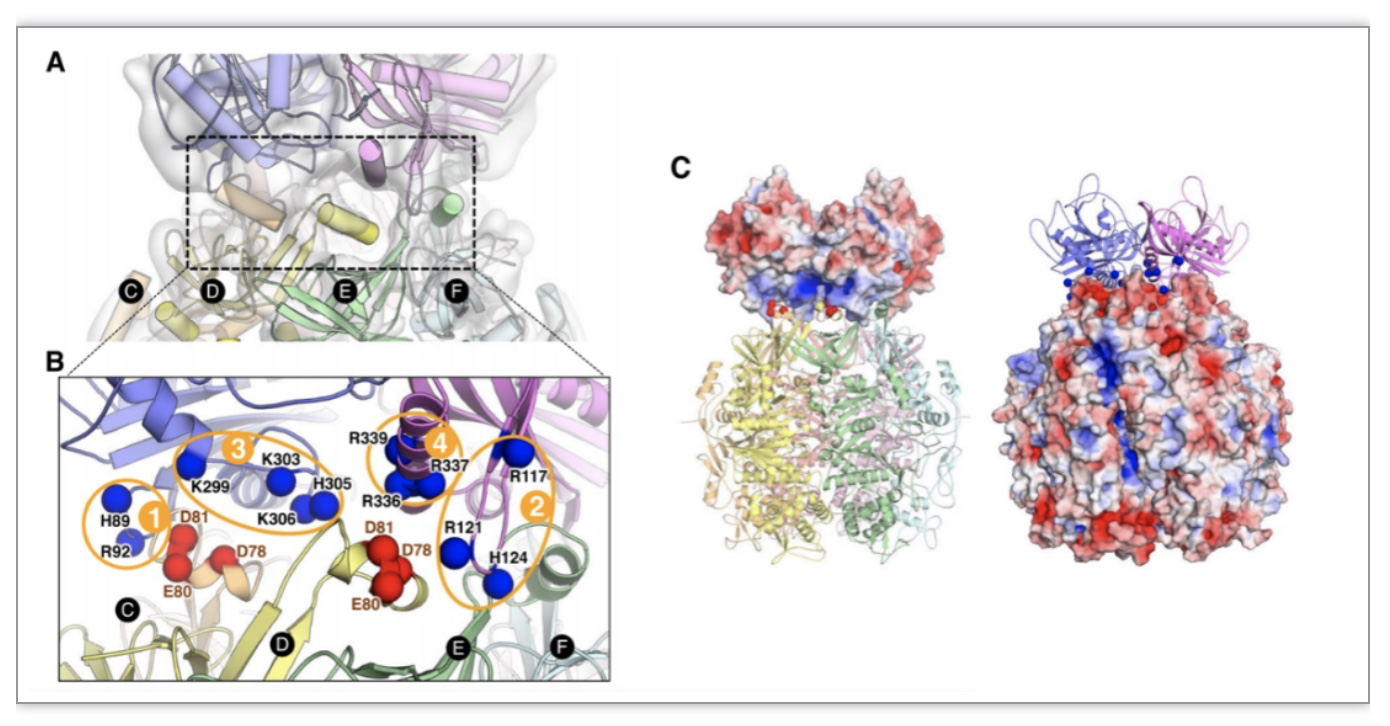
图2. drNurA-HerA互作界面分析
(图源:Yang J, et al., BMC Biol , 2023)
drNurA-HerA-dsDNA复合物的结构模型显示,虽然drHerA六聚体的孔隙大小足以允许dsDNA通过,但drNurA二聚体形成的孔隙对于完整的DNA双螺旋来说太窄,双链DNA只有在被解离成单链后才可能进入drNurA的催化位点(图3)。随后的生化数据表明,drNurA亚基上的一个针状基序对于dsDNA的解开是必不可少的。
同时,研究还找到了drHerA上与dsDNA转位相关的保守残基,R552和R495,他们分别位于环状转位酶共有的一个保守基序以及HerA/FtsK家族dsDNA特异性易位相关基序上,两者距离为~14Å,约等于dsDNA的大沟宽度(图3),因此,推断这两个残基很可能分别结合并负责其中一条DNA的转位,如此便可以保证dsDNA的两条链同时顺利转位。
此外,核酸酶实验还发现,转位状态下的drNurA-HerA复合体偏好水解5’端DNA链,而静止状态下的复合体对3’端DNA链也有水解活性。推测是由于转位状态下的drHerA结构发生连续变化,连带着drNurA的结构发生变化,从而影响了其酶切活性,这种转位依赖的酶切活性调控机制可以帮助解释NurA-HerA在体内处理DSB时,特异性降解5’端DNA链,为同源重组提供游离3’单链DNA末端的分子机制。
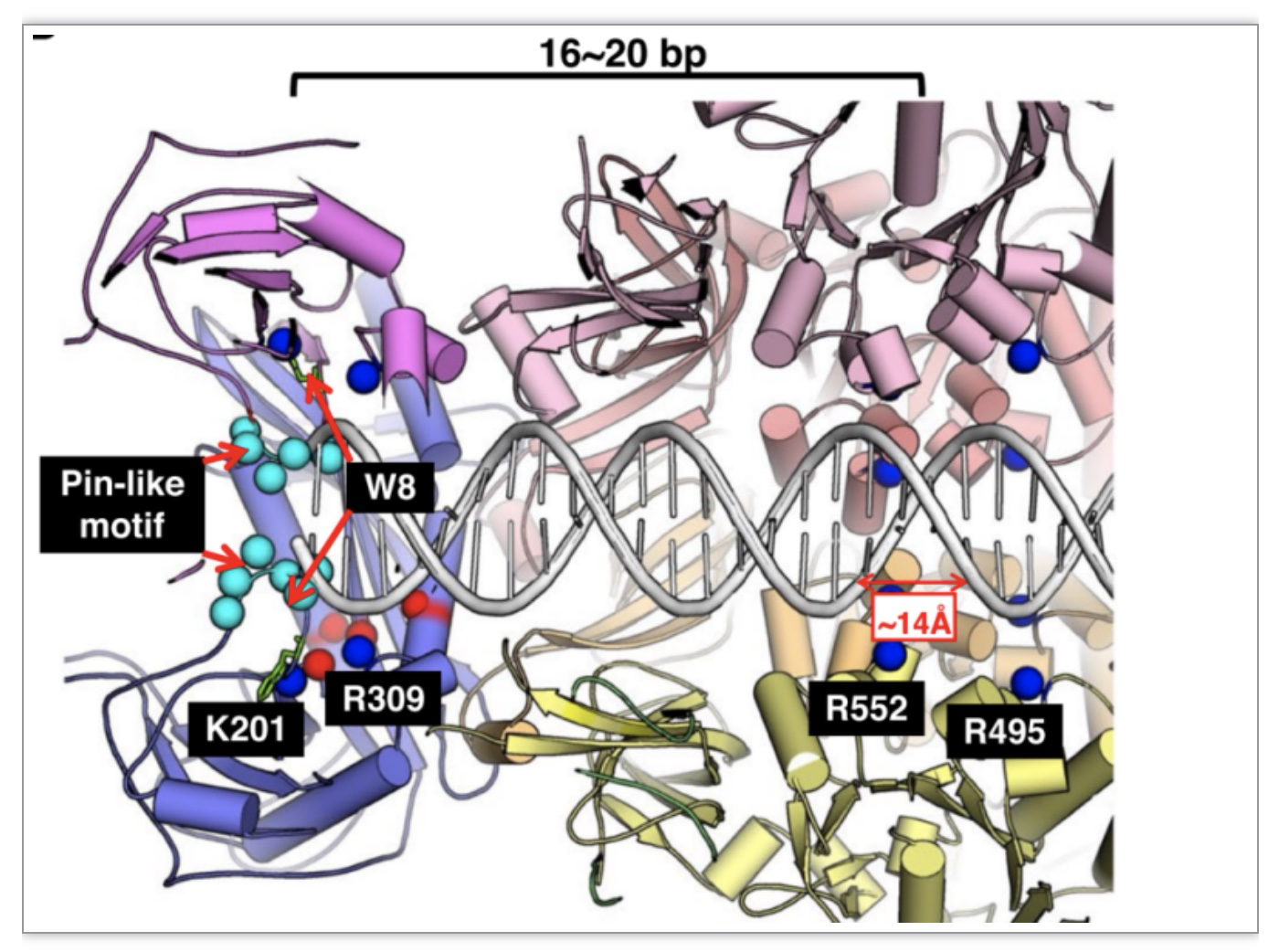
图3. drNurA-HerA-dsDNA复合物结构模型
(图源:Yang J, et al., BMC Biol , 2023)
然而,drNurA-HerA的生物学功能还存在着争议,表型实验表明,drNurA-HerA复合物能削弱菌体对DNA损伤剂的耐受,这种情况在嗜热栖热菌的DNA损伤修复研究中也有被观察到,这说明细菌与古菌的NurA-HerA复合物可能在生物学功能上也有差异。
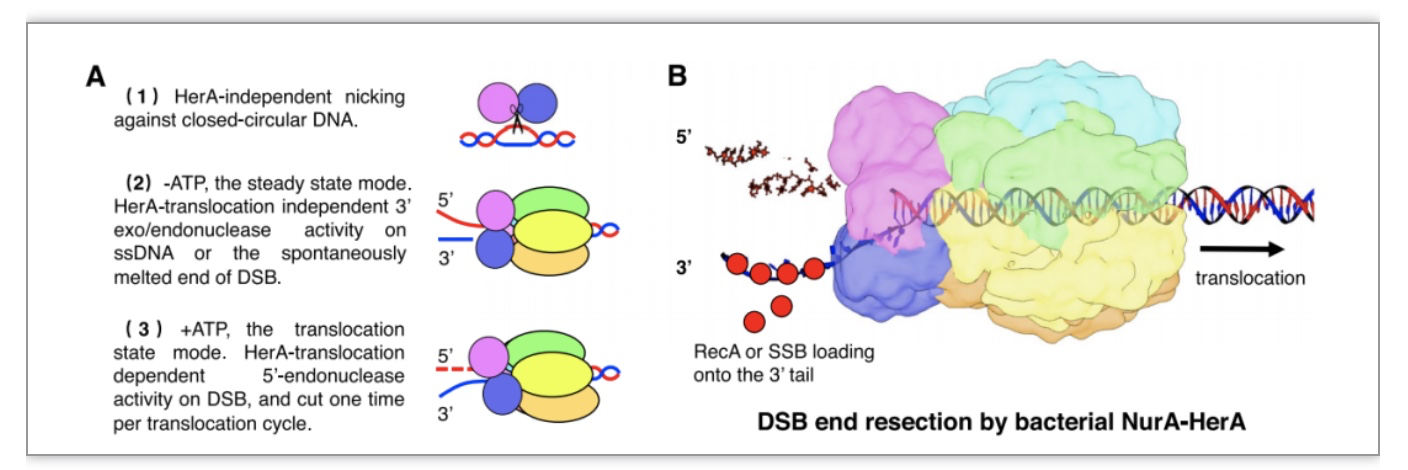
图4. drNurA -HerA复合体的DNA末端切除模型
(图源:Yang J, et al., BMC Biol , 2023)

